植物油是人类重要的食物,也是人体必需脂肪酸的主要来源,它不仅为人类提供营养,还能提供能量。玉米油是一种人们常食用的植物油,具有很高的营养价值[1-2]。研究表明,玉米油中含有0.77%的植物甾醇,可以减少人体对胆固醇的吸收。同时玉米油是必需脂肪酸的极好来源,其含量超过600 g/kg,主要以亚油酸(C18∶2)为代表。尽管玉米油的不饱和程度很高,生育酚含量也相对较高,约为1 g/kg。其中γ-生育酚占70%~80%,α-生育酚占20%~25%,δ-生育酚占3%~5%[3]。实验表明玉米油对唐氏综合症小鼠有积极的治疗作用[4]。
在世界范围内,尤其是在中国,使用玉米油进行油炸是一种常见的食品热加工烹饪方法,而相关的油炸食品也深受广大消费者的喜爱。同时,其他的热加工也是玉米油主要的食用方式。研究表明,加热过程是煎炸油和油炸食品风味形成的关键操作过程,在此过程中,玉米油中的不饱和脂肪酸氧化被认为是挥发性物质的主要来源,这些挥发性物质构成了油炸食品的风味,包括香味和不和谐的风味,特别是不和谐的风味物质是引起油炸食品酸败的主要原因[5]。近年来,研究人员在煎炸油和油炸食品中的异味成分构成和特征方面进行了大量的研究工作,研究发现在煎炸油和油炸食品的的尾气中检测出大量的挥发性醛类物质,如:己醛、庚醛和戊醛等,这些醛类通常给人带来不快的腐臭味道且缩短油炸食品的保质期,并影响消费者对相关食品的接受度[6-7]。研究同时发现,在常温条件下长期放置的玉米油及其相关食品,由于自氧化、光敏氧化生成的醛类也是其不和谐风味及相关食品风味劣化的主要原因[8-10]。
鉴于此,为了探究玉米油在热加工特别是油炸过程中风味的形成机制,本文应用真空辅助固相微萃取(solid-phase microextraction,SPME)技术分析检测加热过程中不同温度段玉米油挥发性物质的构成,从而揭示热加工过程中不同温度段风味的形成和特点,进而阐明玉米油热加工过程风味形成的机制,为油脂热加工过程中风味的人工调控提供理论依据。
1 材料与方法
1.1 实验材料
玉米油,辽宁省大连市当地超市;标准化学品:戊醛、己醛、庚醛、辛醛、糠醛、1-戊三醇、戊醇、己醇、庚醇、辛醇、甲苯、乙苯、对二甲苯、苯乙烯、2-戊呋喃和C4-C20正构烷烃(均为分析纯),美国Sigma-Aldrich(上海)公司。
1.2 实验仪器
Supelco 50/30 μm DVB/CAR/PDMS 手动固相微萃取(SPME)萃取头,美国 Supelco 公司;Agilent 7890A/5975C 气相色谱质联用仪,美国安捷伦科技有限公司;BS224S 电子分析天平,德国赛多利斯科学仪器;HH-4 型数显恒温水浴锅,常州智博瑞仪器制造有限公司。
1.3 实验方法
应用真空辅助固相微萃取系统对玉米油进行升温和挥发物的收集,该系统已经应用于本课题组的前期研究工作中,并成功的揭示了小麦粉和大豆油在热加工过程中挥发性物质形成的规律[11-12]。装置如图1所示,取0.1 g的玉米油放置在样品瓶1中,将样品瓶1置于油浴中,初始温度为30 ℃,加热30 min。同时将样品瓶2置于70 ℃的水浴锅中恒温加热。待玉米油挥发性化合物达到饱和状态,将样品瓶2抽真空3 min达到负压状态。利用样品瓶2中产生的负压将样品瓶1中的挥发性化合物通过聚四氟乙烯管导入到样品瓶2中,将SPME萃取头置于样品瓶2中的玉米油挥发性化合物吸附30 min,完成挥发性物质的萃取吸附,随即立刻插入到GC-MS进样口中进行检测,并将2号瓶取出,更换新瓶,用真空泵将瓶抽到负压,等待下一温度下挥发性化合物的引入。同时,样品瓶1继续加热到下一个温度,然后用真空泵将样品瓶1抽真空3 min,以清除上一个温度段残留在瓶中的挥发性化合物,进而消除对下一温度段产生的挥发性化合物的干扰。重复上述操作,将玉米油加热至60、90、120、150和180 ℃。
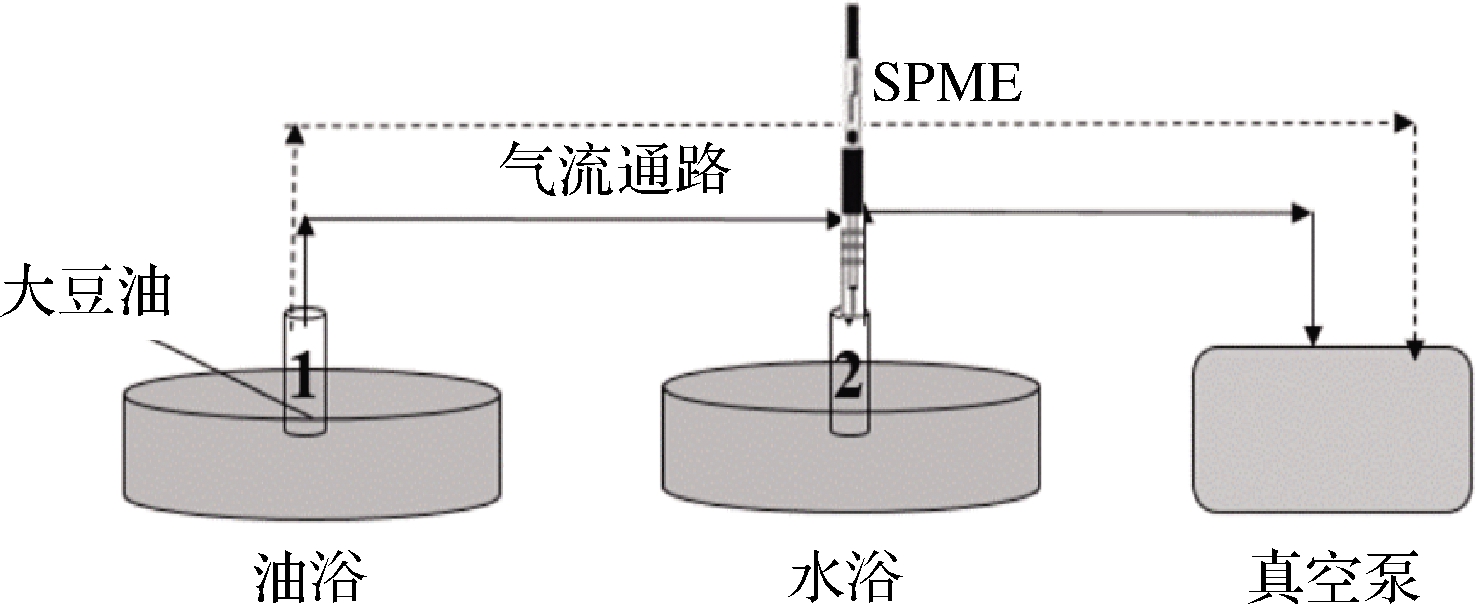
图1 挥发性成分萃取实验示意图
Fig.1 Schematic diagram of volatile matter extraction
1.4 色谱条件
采用Agilent 7890A GC-MS5975C色谱仪, Agilent HP -5MS (30 m×0.25 mm,0.25μm)色谱柱;程序升温:初始度30 ℃,保留时间为3 min,以 5 ℃/min的速率升至280 ℃,320 ℃后运行5 min,整个周期时间为52 min。进样口温度250 ℃;检测器250 ℃;质量选择检测器温度250 ℃;载气氦气,流速1 mL/min。EI电离源,电子能量为70 eV;离子源温度230 ℃;扫描范围40~400 amu,选取Scan模式。四极杆检测器温度150 ℃。以相同气色谱条件检测正构烷烃 (C7-C30),计算保留指数。采用NIST11谱库检索及比对文献报道的RI值,保留匹配度大于或等于800的成分,对化合物进行鉴定分析,然后通过和标准化合物进行比对,最终确定化合物的种类。
1.5 统计分析
1.5.1 显著性分析
对玉米油中挥发性风味成分的测定进行了3次重复试验。数据以均数±标准误差表示。采用SPSS 16.0软件进行统计分析。均数间的差异采用单因素方差分析(邓肯多变量检验)。P<0.05表示差异显著。
1.5.2 主成分分析
主成分分析(principal component analysis, PCA),是将高维变量转化为低维变量的一种多元统计分析方法,是一种多重数据分析技术。使用 Unscrambler 9.7对半连续加热过程中不同温度下玉米油的挥发性物质进行主成分分析,检验其重复以及各化合物分布区域和所起的贡献。
2 结果与分析
2.1 加热过程中玉米油中挥发性化合物的组成
基于色谱峰质图与NIST标准质谱库标准谱图以及标准化合物综合比对,玉米油加热过程中,共定性分析检测到了52种挥发性物质,包括醛(21种)、酮(8种)、醇(9种)、呋喃(3种)、酸和酯(8种)和芳香化合物(3种),如表1所示。
由表1可以看出,醛类物质在所鉴定出的物质中比例最大,是玉米油挥发性风味物质的主要构成成分,共鉴定出8种饱和醛(戊醛、己醛、庚醛、辛醛、壬醛、癸醛、十一醛、十二醛),9种烯烃醛[(E)-2-己烯醛,(Z)-2-庚烯醛,(E)-2-辛烯醛,(E)-2-壬烯醛,(E)-2-癸烯醛,(Z)-2-壬烯醛,2-十一烯醛,(Z) -4-庚烯醛,(E)-4-壬烯醛],3种二烯醛[(E,E)-2,4-庚二烯醛,(E,E)-2,4-辛二烯醛,(E,E)-2,4-癸二烯醛]。挥发性醛类是油脂氧化产生的主要的挥发性风味物质,其风味阈值相对较低[13-15],一般低浓度的挥发性醛通常赋予食品一定的麦香、奶油味以及焦糖味等香气,而高浓度的醛则带有浓烈的溶剂味,人们俗称“哈喇味”,因此调节和控制挥发性醛类的生成对改善相关食品的风味有重要的意义。研究表明,醛类主要是不饱和脂肪酸热氧化形成的产物。玉米油中亚油酸含量为59.8%,油酸25.8%,棕榈酸11.0%,1.7%的硬脂酸和1.1%的亚麻酸。同时研究发现,加热产生的挥发性醛主要来源于油酸、亚油酸和亚麻酸的氧化[16-18]。在醛类化合物中,壬醛主要来源于油酸,戊醛、己醛,2,4-癸二醛主要来源于亚油酸;2,4-庚二烯醛来源于亚麻酸[5]。
醇酮类化合物是继玉米油加热过程中鉴定出的挥发性醛类之后第二大类风味化合物,醇类包括饱和醇、不饱和醇和环状醇。并且挥发性醇酮挥发性化合物是在150 ℃以后形成的。醇类物质的形成主要源于脂质氧化或醛类物质的还原[19]。在这些挥发性醇中, 1-辛烯-3-醇,作为一种具有蘑菇气味的重要挥发性醇,它是亚油酸-10-氢过氧化物的分解产物。在热加工过程如油炸过程中,亚油酸-10-氢过氧化物分解生成的2-辛烯-1-醇中羟基的位置异构化是形成1-辛烯-3-醇主要反应途径之一[20-21]。挥发性酮是油炸食品味道的重要组成,高浓度的挥发性酮类给人带来浓烈的溶剂味,低浓度的酮类通常带来一定的花香;如,6-十二烷酮[22]。然而,在油炸过程中产生的挥发性酮被认为是对人体健康有潜在危害的物质。一方面,甲基酮等挥发性酮可能是饱和脂肪酸的热过氧化产物;另一方面,在深度油炸过程中,由6-十二烯氧化分解生成的不饱和酮类,如6-十二烷酮可氧化生成其他酮类化合物[23-24]。
在玉米油加热过程中同时检测到了一定量的呋喃类,芳香族和酸酯类化合物,呋喃类挥发物通常带来一定的甜香味,但是其具有一定的毒性。研究发现其与肝脏肿瘤(肝细胞腺瘤或癌)[25]和白血病[26]的发病有关。同时氧化多不饱和脂肪酸可以促进呋喃生成,且,α,β-不饱醛为烷基呋喃的前体。例如,有研究证实:(E)-4-羟基-2-壬烯醛是戊基呋喃的前体[27-28],研究同时发现氨基酸可以催化α,β-不饱和醛转化为烷基呋喃,相应α,β-不饱和醛是中间产物。例如,2-乙基呋喃可以由(E)-2-己烯醛通过4-羟基-2-己烯醛形成,2-丙基呋喃可以由(E)-2-庚醛通过4-羟基-2-庚醛形成[29]。由于α,β-不饱和醛是由脂肪酸氧化产生的,因此,油脂中的脂肪酸的构成影响α,β-不饱和醛转化为相应呋喃的生成。同时实验结果显示,芳香族类化合物仅在60 ℃以下可以检测到,在较高温度下均未检出。推测其原因是,这些化合物是油脂萃取中残留的溶剂。酸酯类挥发物对油脂风味的影响相对较小,本研究不加以讨论。
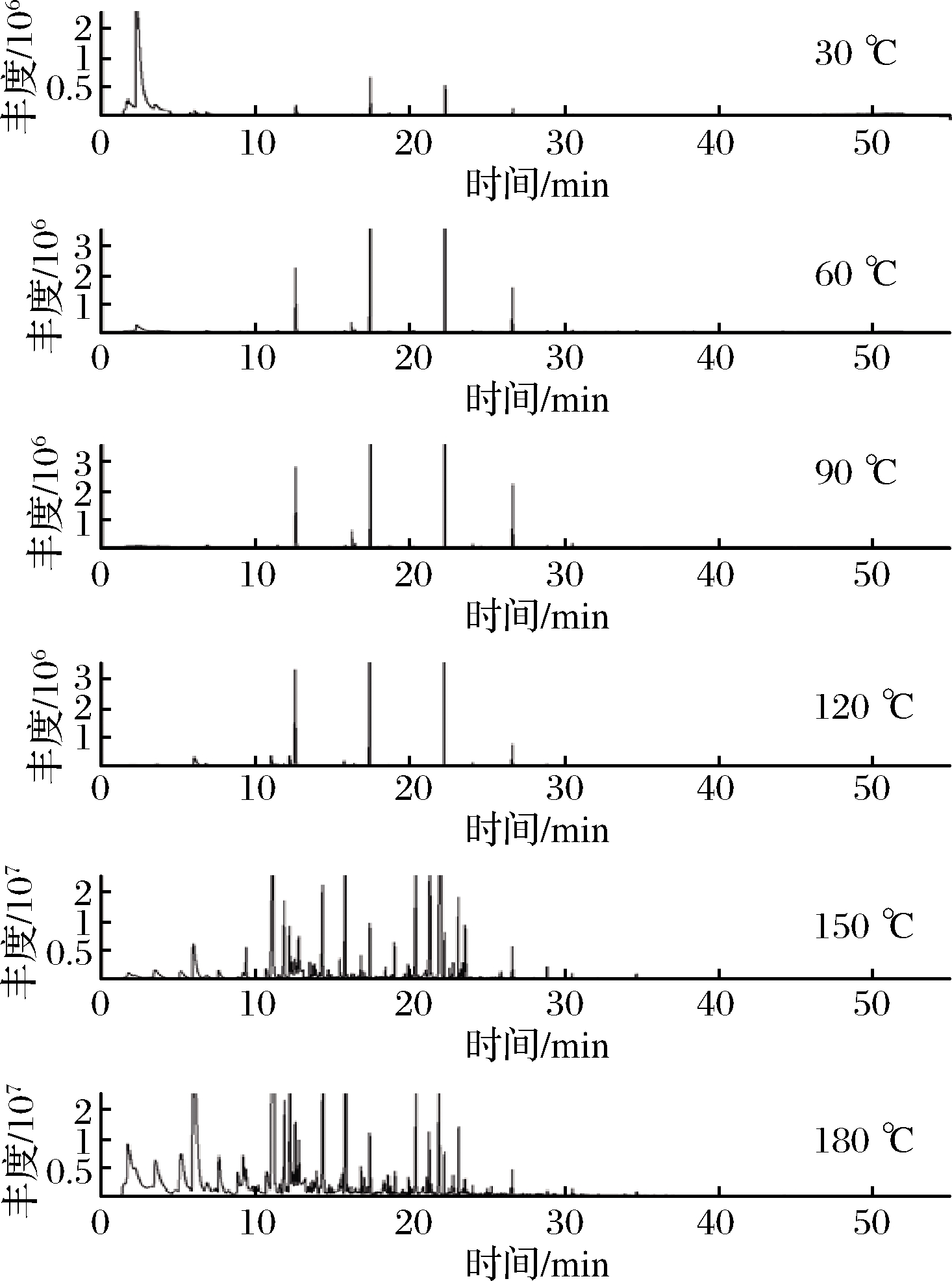
图2 基于GC-MS的不同温度加热玉米油总离子流图
Fig.2 Total ion currentchromatogram of corn oil heated at different temperatures based on GC-MS
表1 玉米油在加热过程中产生的挥发性化合物
Table 1 Volatile compounds from the corn oil in the heating process
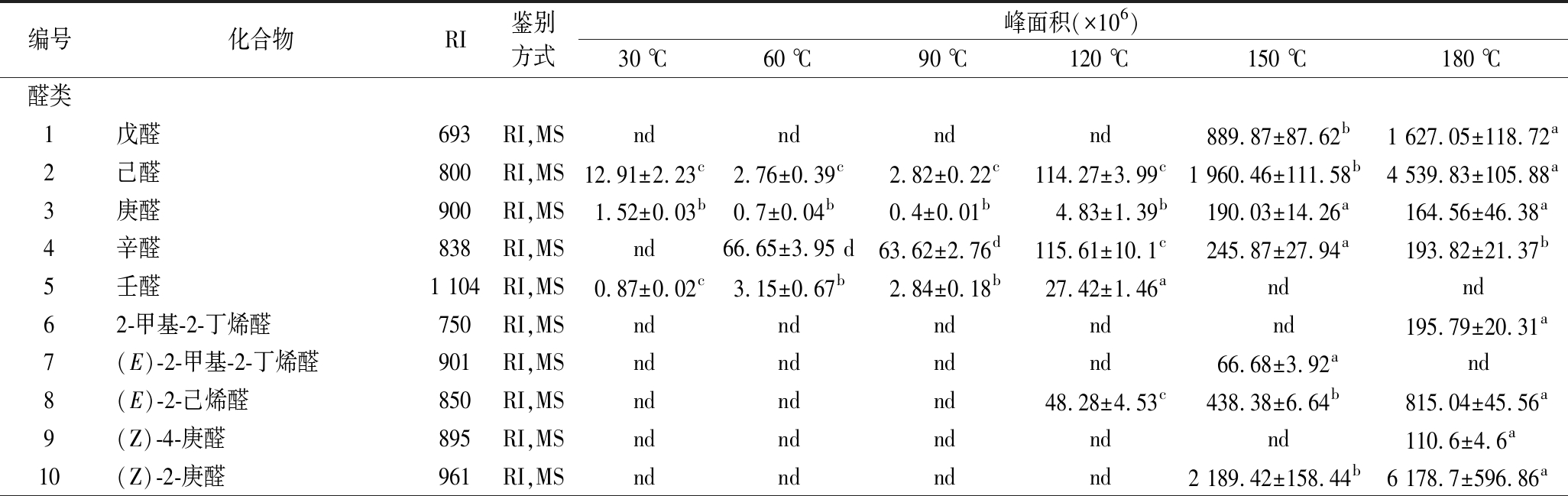
编号化合物RI鉴别方式峰面积(×106)30 ℃60 ℃90 ℃120 ℃150 ℃180 ℃醛类1戊醛693RI,MSndndndnd889.87±87.62b1 627.05±118.72a2己醛800RI,MS12.91±2.23c2.76±0.39c2.82±0.22c114.27±3.99c1 960.46±111.58b4 539.83±105.88a3庚醛900RI,MS1.52±0.03b0.7±0.04b0.4±0.01b4.83±1.39b190.03±14.26a164.56±46.38a4辛醛838RI,MSnd66.65±3.95 d63.62±2.76d115.61±10.1c245.87±27.94a193.82±21.37b5壬醛1 104RI,MS0.87±0.02c3.15±0.67b2.84±0.18b27.42±1.46andnd62-甲基-2-丁烯醛750RI,MSndndndnd nd195.79±20.31a7(E)-2-甲基-2-丁烯醛901RI,MSndndndnd66.68±3.92a nd8(E)-2-己烯醛850RI,MSndndnd48.28±4.53c438.38±6.64b815.04±45.56a9(Z)-4-庚醛895RI,MSndndndndnd110.6±4.6a10(Z)-2-庚醛961RI,MSndndndnd2 189.42±158.44b6 178.7±596.86a
续表1
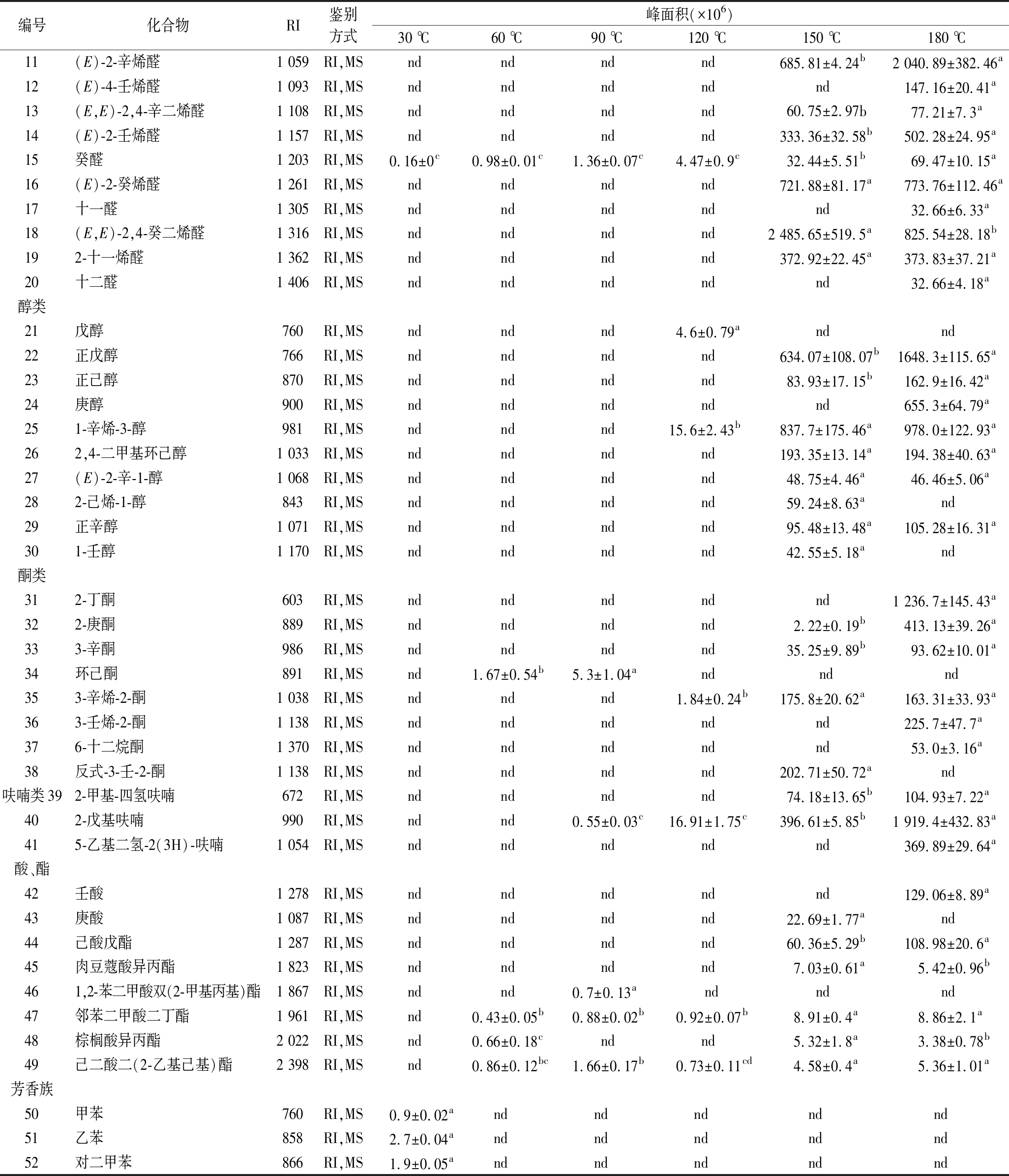
编号化合物RI鉴别方式峰面积(×106)30 ℃60 ℃90 ℃120 ℃150 ℃180 ℃11(E)-2-辛烯醛1 059RI,MSndndndnd685.81±4.24b2 040.89±382.46a12(E)-4-壬烯醛1 093RI,MSndndndndnd147.16±20.41a13(E,E)-2,4-辛二烯醛1 108RI,MSndndndnd60.75±2.97b77.21±7.3a14(E)-2-壬烯醛1 157RI,MSndndndnd333.36±32.58b502.28±24.95a15癸醛1 203RI,MS0.16±0c0.98±0.01c1.36±0.07c4.47±0.9c32.44±5.51b69.47±10.15a16(E)-2-癸烯醛1 261RI,MSndndndnd721.88±81.17a773.76±112.46a17十一醛1 305RI,MSndndndndnd32.66±6.33a18(E,E)-2,4-癸二烯醛1 316RI,MSndndndnd2 485.65±519.5a825.54±28.18b192-十一烯醛1 362RI,MSndndndnd372.92±22.45a373.83±37.21a20十二醛1 406RI,MSndndndndnd32.66±4.18a醇类21戊醇760RI,MSndndnd4.6±0.79andnd22正戊醇766RI,MSndndndnd634.07±108.07b1648.3±115.65a23正己醇870RI,MSndndndnd83.93±17.15b162.9±16.42a24庚醇900RI,MSndndndndnd655.3±64.79a251-辛烯-3-醇981RI,MSndndnd15.6±2.43b837.7±175.46a978.0±122.93a262,4-二甲基环己醇1 033RI,MSndndndnd193.35±13.14a194.38±40.63a27(E)-2-辛-1-醇1 068RI,MSndndndnd48.75±4.46a46.46±5.06a282-己烯-1-醇843RI,MSndndndnd59.24±8.63and29正辛醇1 071RI,MSndndndnd95.48±13.48a105.28±16.31a301-壬醇1 170RI,MSndndndnd42.55±5.18and酮类312-丁酮603RI,MSndndndndnd1 236.7±145.43a322-庚酮889RI,MSndndndnd2.22±0.19b413.13±39.26a333-辛酮986RI,MSndndndnd35.25±9.89b93.62±10.01a34环己酮891RI,MSnd1.67±0.54b5.3±1.04and nd nd353-辛烯-2-酮1 038RI,MSndndnd1.84±0.24b175.8±20.62a163.31±33.93a363-壬烯-2-酮1 138RI,MSndndndndnd225.7±47.7a376-十二烷酮1 370RI,MSndndndndnd53.0±3.16a38反式-3-壬-2-酮1 138RI,MSndndndnd202.71±50.72and呋喃类392-甲基-四氢呋喃672RI,MSndndndnd74.18±13.65b104.93±7.22a402-戊基呋喃990RI,MSndnd0.55±0.03c16.91±1.75c396.61±5.85b1 919.4±432.83a415-乙基二氢-2(3H)-呋喃1 054RI,MSndndndndnd369.89±29.64a酸、酯42壬酸1 278RI,MSndndndndnd129.06±8.89a43庚酸1 087RI,MSndndndnd22.69±1.77and44己酸戊酯1 287RI,MSndndndnd60.36±5.29b108.98±20.6a45肉豆蔻酸异丙酯1 823RI,MSndndndnd7.03±0.61a5.42±0.96b461,2-苯二甲酸双(2-甲基丙基)酯1 867RI,MSndnd0.7±0.13a ndndnd47邻苯二甲酸二丁酯1 961RI,MSnd0.43±0.05b0.88±0.02b0.92±0.07b8.91±0.4a8.86±2.1a48棕榈酸异丙酯2 022RI,MSnd0.66±0.18cndnd5.32±1.8a3.38±0.78b49己二酸二(2-乙基己基)酯2 398RI,MSnd0.86±0.12bc1.66±0.17b0.73±0.11cd4.58±0.4a5.36±1.01a芳香族50甲苯760RI,MS0.9±0.02and nd nd nd nd 51乙苯858RI,MS2.7±0.04and nd nd nd nd 52对二甲苯866RI,MS1.9±0.05and nd nd nd nd
注:nd代表未检测到;肩标a~d代表差异显著(P<0.05)
2.2 不同加热温度下玉米油挥发性物质的变化规律
食品的加热过程是一个复杂的过程,伴随着许多化学反应的发生和物质的形成。为了探索玉米油风味的形成机理,研究不同加热温度下产生的挥发性物质的构成非常必要。图3直观地展示了加热过程中玉米油不同挥发物的形成温度,以及各温度段挥发性物质的构成。同时,不同温度下各挥发性物质含量的变化以热图的方式加以表示,热图的颜色冷色系代表了化合物的含量相对较少,暖色系表示化合物含量相对较大,具体见图4。

图3 玉米油各挥发性物质的形成温度
Fig.3 The formation temperature of different volatile compounds
为了直观地了解不同挥发物的形成温度,玉米油在不同加热温度点的挥发物组成如图3所示。总的趋势表明,在较低的温度下,只有少量醛类化合物形成;而大量的醛类、醇类、酮类和酸酯类化合物则是在较高的温度下形成的。在30 ℃加热时共鉴定出7个挥发物,包括醛(4种)、芳香族化合物(3种)分别为己醛、庚醛、壬醛、癸醛、甲苯、乙苯、对二甲苯。然而,这并不意味着这些化合物是在这个温度点产生的,有可能是玉米油的基本挥发成分。随着温度的升高,在60 ℃和 90 ℃下分别产生了5种和2种挥发物。如图3所示,在60 ℃下生成了辛醛、环己酮、邻苯二甲酸二丁酯、棕榈酸异丙酯、己二酸二(2-乙基己基)酯, 90 ℃下生成了2-戊基呋喃、1,2-苯二甲酸双(2-甲基丙基)酯。可见低温下生成的醛类物质基本上都是饱和醛。为了更直观地观察不同温度下化合物的变化趋势,绘制了玉米油挥发性风味物质的热图。结果如图4所示。热图的颜色由冷逐渐变热。图3显示了醛类、醇类和酮类、呋喃类、芳香族化合物和酸类酯的热图。从图4也可以看出,除芳香族化合物外,大多数挥发性化合物的颜色随着温度的升高由冷逐渐变热。

图4 不同加热温度下玉米油挥发性物质热图
Fig.4 Heatmaps of corn oil compounds in the course of heating
如图3所示,在150 ℃下生成的挥发性化合物有23种,包括醛(9种)、酮(3种)、醇(7种)、呋喃(1种)、酸酯(3种),其中在加热过程中生成的醛和醇化合物最多,如戊醛、(Z)-2-庚醛、(E)-2-辛烯醛、(E,E)-2,4-辛二烯醛、(E)-2-壬烯醛和(E,E)-2-4-癸二烯醛。油脂的黄油味和总体气味与己醛、庚醛、戊基呋喃呈负相关。油脂的酸臭和油漆味与戊醛有关。鱼腥味和豆腥味与(E,E)-2-4-癸二烯醛呈中度相关。油脂的草味、酸味、油漆味和丙烯醛味与己醛、庚醛、庚醛和戊基呋喃呈显著正相关。此外,己醛是一种已知的脂质氧化分解产物,已被用作各种油脂氧化的指标。同时,由图3可以看出,在此温度点,己醛、庚醛、(Z)-2-庚醛和2-戊基呋喃的浓度也显著增加。因此,在整个加热过程中,150 ℃被认为是形成玉米油挥发性化合物的临界温度点,异味开始大量释放。120 ℃和180 ℃分别有4种和11种挥发性化合物生成,大多数酮类挥发性化合物在150 ℃下生成,酸在180 ℃下检测。
为了更好地理解加热过程中的玉米油风味构成和变化特性,应用所鉴定出的53种化合物的数据进行了PCA,得分图和载荷图分别如图5和图6所示。其中前两个主要成分PC1和PC2占总变化的73.8%,PC1解释了49.7%的变化,PC2解释了24.1%的变化。
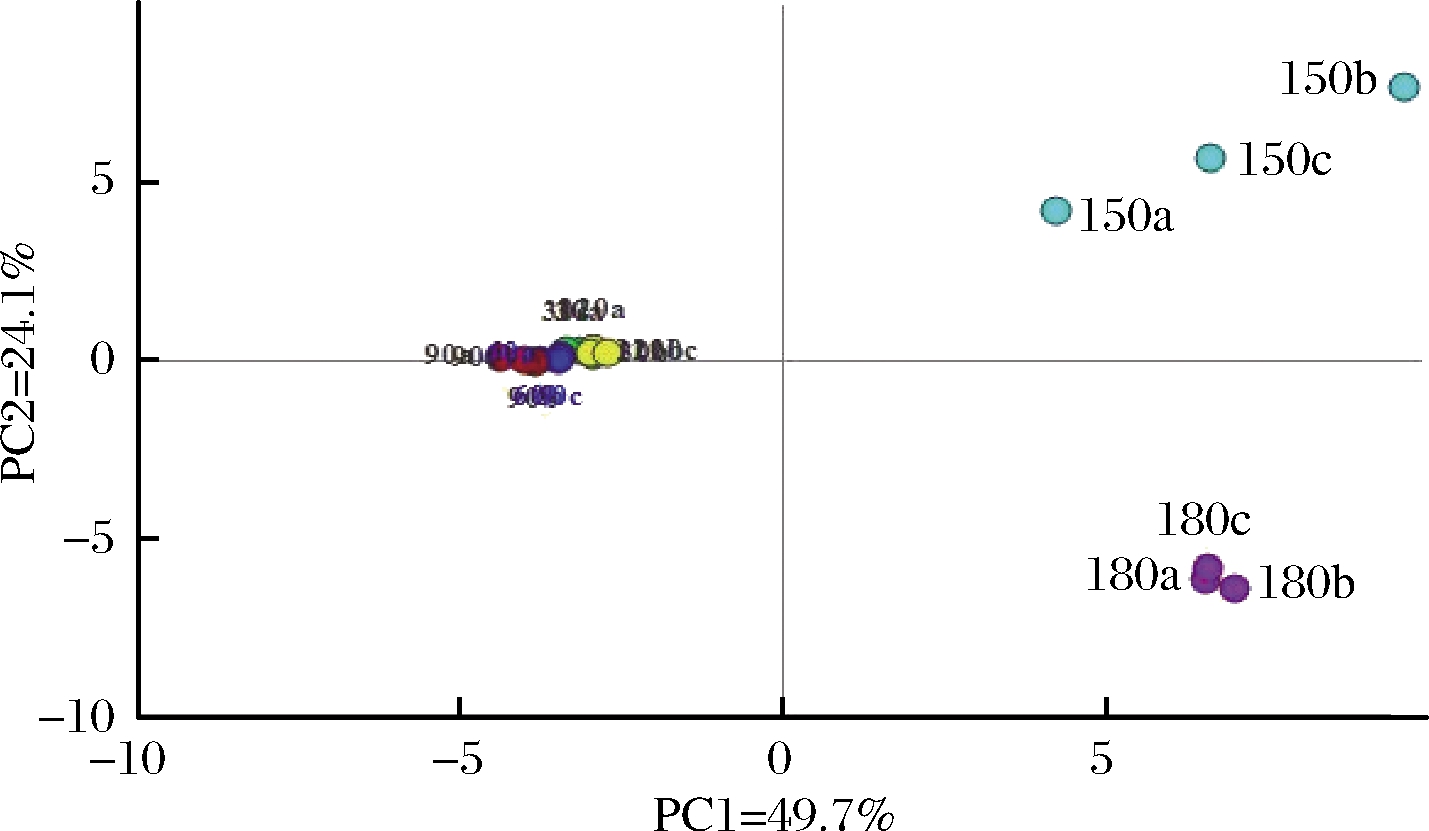
图5 玉米油挥发性物质主成分分析得分图
Fig.5 Score scatter plot of volatiles from corn oil

图6 玉米油挥发性物质主成分分析载荷图
Fig.6 Loading plot of volatiles from corn oil
如图5所示,低温的得分点(30、60、90、120 ℃)主要位于主成分一负载荷区域,而高温的得分点(150,180 ℃)则位于主成分一的正载荷区。这表明低温度时的挥发性物质的构成与高温时有较大差异。同时,30、60、90、120 ℃的得分点彼此靠近甚至重叠,温度较低时不同稳定点的挥发性物质的构成较为相似。对应于相应的载荷图(图6),发现辛醛、壬醛、癸醛、戊醇、环己酮等化合物对低温时的风味贡献较大,同时,说明这些化合物是在低于120 ℃下产生的。由图5同时可知,在较高温度150 ℃和180 ℃下的得分点和低温下的得分点可以明显区分开,分布在PC1的正载荷区域,即第一象限和第四象限,这表明玉米油在高温下和低温下风味构成有很大的差别。对应载荷图6,发现己醛、庚醛、(E)-2-甲基-2-丁烯醛、(E)-2-己烯醛、(E)-2-壬烯醛、2-十一烯醛、十二醛等化合物对高温时的风味贡献较大,同时绝大多数挥发性化合物出现在这一区域内,这也进一步表明了绝大多数挥发性化合物是在较高温度下形成的。
当加热温度升高到大于120 ℃时,不同高温点的玉米油风味构成差异也非常明显。由图5看出,150 ℃ 和180 ℃这2个温度下的样品首先因位于PC1的正载荷区域,区别于低温度时的样品;同时又分别位于PC2的正载荷区域和负载荷区域,由第二主成分分开。这表明150 ℃和180 ℃的挥发性物质形成既有同作为高温度加热条件下的相似性,也有不同加热温度下的差异性。并且,结合相应的载荷图发现大多数鉴定的挥发性化合物位于 PC1的正载荷区域,这表明所有这些化合物都参与了高温度段样品整体风味轮廓的构成,但却有着量上的差异。对150 ℃时的风味贡献较大的化合物有(E)-2-壬烯醛、2-十一烯醛、正戊醇、(E)-2-辛烯-1-醇、2-己烯-1-醇、2-庚酮、2-甲基四氢呋喃、己酸戊酯等,对180 ℃时的风味贡献较大的化合物有庚醛、(E)-4-壬烯醛、十一醛、十二醛、庚醇、3-壬烯-2-酮、6-十二烷酮等。这和图4的结果一致,即这些挥发性化合物的含量在高温度时处于一个基本含量较高且在增长的水平,与一些文献中报道的油脂氧化相关的一些醇、醛类物质含量变化规律很符合。
3 结论
真空辅助顶空固相微萃取并结合气质联用的方法(HS-SPME-GC-MS)可以有效地分析玉米油加热过程中不同温度点挥发性风味物质的构成,确定了各挥发性物质形成的温度,150 ℃是整个加热过程一个重要的温度控制点,基本搞清了玉米油加热过程中风味的形成机制。
[1] PERES F, JELEN H H, MAJCHER M M, et al.Characterization of aroma compounds in Portuguese extra virgin olive oils from Galega Vulgar and Cobrançosa cultivars using GC-O and GC×GC-ToFMS[J].Food Research International, 2013, 54(2):1 979-1 986.
[2] 宋晓寒, 王会.玉米油的营养功能及提取工艺[J].食品安全导刊, 2018(21):135-136.
SONG X L, WANG H.The nutritional function and extraction process of corn oil[J].China Food Safty Magezine, 2018(21):135-136.
[3] BIANCHI F, CARERI M, MANGIA A, et al.Retention indices in the analysis of food aroma volatile compounds in temperature-programmed gas chromatography:Database creation and evaluation of precision and robustness[J].Journal of Separation Science, 2015, 30(4):563-572.
[4] LI Q, TANG X, LU S, et al.Composition and tocopherol, fatty acid, and phytosterol contents in micro-endosperm ultra-high oil corn[J].Grasas Y Aceites, 2019, 70(3):311.
[5] FUJISAKI M, ENDO Y, FUJIMOTO K.Retardation of volatile aldehyde formation in the exhaust of frying oil by heating under low oxygen atmospheres[J].Journal of the American Oil Chemists Society, 2002, 79(9):909-914.
[6] ZHANG W, LI N, FENG Y, et al.A unique quantitative method of acid value of edible oils and studying the impact of heating on edible oils by UV-Vis spectrometry[J].Food Chemistry, 2015, 185(15):326-332.
[7] PETER M F, NIKOLAUS B.Genotoxicity of lipid oxidation compounds[J].Free Radical Biology and Medicine, 2017(111):244-252.
[8] FULLANA, A, CARBONELL A A, SIDHU S.Volatile aldehyde emissions from heated cooking oils[J].Journal of the Science of Food and Agriculture, 2004, 84(15):2 015-2 021.
[9] KATRAGADDA H R, FULLANA A, SIDHU S, et al.Emissions of volatile aldehydes from heated cooking oils[J].Food Chemistry, 2010, 120(1):59-65.
[10] ZHU X, WANG K, ZHU J, et al.Analysis of cooking oil fumes by ultraviolet spectrometry and gas chromatography-mass spectrometry[J].Journal of Agricultural and Food Chemistry, 2001, 49 (10):4 790-4 794.
[11] CHAI D, LI C W, ZHANG X X, et al.Analysis of volatile compounds from wheat flour in the heating process[J].International Journal of Food Engineering, 2019, 15(10):1-13.
[12] XIAO L, LI C W, CHAI D, et al.Volatile compound profiling from soybean oil in the heating process[J].Food Science & Nutrition, 2020, 8(2):1 139-1 149.
[13] XIAO W, JIANG H S.Principle of MS/MS and Application of GC/MS/MS to environmental analysis[J].Environmental Science and Technology, 2004.
[14] 徐星. 植物油氧化过程中脂肪酸和挥发性成分变化的研究[D].杭州:浙江工商大学, 2012.
XU X.Study on changes of fatty acids and volatile components in the process of vegetable oil oxidation[D].Hangzhou:Zhejiang Gongshang University, 2012.
[15] PIERLUIGI D, YURAWECZ M P, MOSSOBA M M, et al.Improved identification of conjugated linoleic acid isomers using silver-ion HPLC separations[J].Journal of AOAC International, 2004,87(2):563-568.
[16] JABEUR H, ZRIBI A, MAKNI J, et al.Detection of chemlali extra-virgin olive oil adulteration mixed with soybean oil, corn oil, and sunflower oil by using GC and HPLC[J].Journal of Agricultural and Food Chemistry, 2014, 62(21):4 893-4 904.
[17] KAROUI I J, MSAADA K, ABDERRABBA M, et al.Bioactive compounds and antioxidant activities of thyme-enriched refined corn oil[J].Journal of Agricultural Science and Technology, 2016, 18(1):79-91.
[18] GOICOECHEA E, GUILLEN M D.Volatile compounds generated in corn oil stored at room temperature.Presence of toxic compounds[J].European Journal of Lipid Science and Technology, 2014, 116(4):395-406.
[19] SAGUY I S, DANA D.Integrated approach to deep fat frying:Engineering, nutrition, health and consumer aspects[J].Journal of Food Engineering, 2003, 56(2-3):143-152.
[20] 聂雪梅, 刘仲明, 张水华, 等.电子鼻及其在食品领域的应用[J].传感器技术, 2004, 23(10):1-3.
NIE X M, LIU Z M, ZHANG S H,et al.Electronic nose and its application in food field[J].Transducer and Microsystem Technologies, 2004, 23(10):1 - 3.
[21] LIZHI H, TOYODA K, IHARA I.Discrimination of olive oil adulterated with vegetable oils using dielectric spectroscopy[J].Journal of Food Engineering, 2010, 96(2):167-171.
[22] LORENZO, JOSE M, Influence of the type of fiber coating and extraction time on foal dry-cured loin volatile compounds extracted by solid-phase microextraction (SPME)[J].Meat Science, 2014, 96(1):179-186.
[23] DAVID M C, ANTHONY J H M M, WING C T,et al.A characterization of the Raman modes in a J-aggregate-forming dye:A comparison between theory and experiment[J].The Journal of Physical Chemistry, 2010, 114(44):11 920-11 927.
[24] GOPINATH A, PUHAN S, NAGARAJAN G.Theoretical modeling of iodine value and saponification value of biodiesel fuels from their fatty acid composition[J].Renewable Energy, 2009, 34(7):1 806-1 811.
[25] ANONYMOUS. Toxicology and carcinogenesis studies of Furan (CAS No.110-00-9) in F344 rats and B6C3F1 mice(Gavage Studies)[J]. National Toxicology Program Technical Report Series, 1993, 402: 1-286.
[26] JUAN P HERN NDEZ-URIBE, GONZALO RAMOS-L
NDEZ-URIBE, GONZALO RAMOS-L PEZ, YEE-MADEIRA H, et al.Physicochemical, rheological and structural characteristics of starch in maize tortillas[J].Plant Foods for Human Nutrition, 2010, 65(2):152-157.
PEZ, YEE-MADEIRA H, et al.Physicochemical, rheological and structural characteristics of starch in maize tortillas[J].Plant Foods for Human Nutrition, 2010, 65(2):152-157.
[27] HENRY S LAIN, ANDREW PROCTOR. Lipid hydrolysis and oxidation on the surface of milled rice[J].Journal of the American Oil Chemists Society, 2003, 80(6):563-567.
[28] ZHANG Q, QIN W, LI M, et al.Application of chromatographic techniques in the detection and identification of constituents formed during food frying:A review[J].Comprehensive Reviews in Food Science and Food Safety, 2015, 14(5):601-633.
[29] PORTER N A, CALDWELL S E, MILLS K A.Mechanisms of free radical oxidation of unsaturated lipids[J].Lipids, 1995, 30(4):277-290.