重金属是指比重大于5的金属,包括铅、镉、汞、砷、铬、锌和铜等45种。其中,对人体危害较大的有铅、镉、汞、砷等。重金属是一种对生物和环境具有严重影响的普遍污染物,其在水体中不能被分解,在微生物的作用下能够转化为毒性更强的金属化合物[1]。在食物链系统的放大作用下,重金属容易在动物和人体内积累,对黏液组织、肠道、骨骼、中枢神经系统和生殖系统等造成严重的伤害。此外,长期接触有毒重金属可能对动物和人体有致癌作用[2]。
现阶段,用于重金属检测的方法主要是以原子荧光法[3]、原子吸收法[4]、电感耦合等离子体原子发射光谱法[5]和电感耦合等离子体质谱[6]等为代表的大型仪器分析法,这类方法可对重金属进行精准定量,但前处理步骤繁琐、成本较高且要求专业人员操作。以免疫测定法为代表的快速检测法由于具有可定性或半定量的检测重金属污染物、灵敏度高等特点,被越来越多的用于重金属的检测中,然而,特异性抗体的质量和较为苛刻的储存条件等一直是制约其应用的关键问题。近年来,“第四代抗体”——适配体作为抗体识别的替代物,已成为重金属检测领域的研究热点。
适配体是通过指数富集配体系统进化(systematic evolution of ligands by exponentialenrichment,SELEX)技术体外人工筛选得到的单链DNA或RNA,长度一般为25~60个碱基(腺嘌呤A;胸腺嘧啶T;鸟嘌呤G;胞嘧啶C)。与抗体相比,适配体具有高亲和力和特异性,更易化学合成与修饰,无免疫原性等优点[7-8]。作为一种分子识别元件,适配体可以在芳香环的叠加、氢键、范德华力和静电作用下,折叠成特定的二级或三级结构后可结合包括重金属[9]、蛋白质[10]和真菌毒素[11]在内的多种靶分子。量子点(quantum dot,QDs)、金纳米粒子(Au nanoparticles,AuNPs)、还原氧化石墨烯(reduced graphene oxide,rGO)等纳米材料是用于固定化适配体的有效材料,具有独特的光学、电子和催化性质,应用于适配体技术可以极大地提高复杂样品基质中重金属污染物监测的灵敏度、选择性和准确性[12-13],因此被深入研究并广泛应用于重金属的定量检测。本文概括了重金属离子Pb2+、Hg2+、Cd2+、Ag+、As3+的适配体序列,并总结了多种结合纳米材料的适配体传感器在重金属检测中的技术应用及优缺点。
1 适配体检测方法
近年来,研究者们利用SELEX程序筛选到多种重金属离子的适配体,表1列举了利用适配体技术检测重金属Pb2+、Hg2+、Cd2+、Ag+、As3+的方法。
1.1 适配体用于Pb2+的检测
研究表明[14-17],3种类型的功能性DNA分子对Pb2+具有特异性的亲和力,一种是依赖于Pb2+的8-17 脱氧核酶,其是以Pb2+为辅因子,在易裂核糖核苷位置显示出裂解活性;第二种是GR-5脱氧核酶,其与依赖于Pb2+的8-17脱氧核酶具有类似的裂解活性,但对Pb2+的选择性比8-17脱氧核酶要高。近年来,由于具有独特的高阶结构和超高的G-四聚体(G-4)稳定化效率,富含G的适配体结合荧光测定法、比色法和电化学法在重金属离子Pb2+的检测中展现出良好的应用前景。LI等[18]利用在Pb2+存在时,富含G的适配体容易从无规则卷曲转换成更稳定的G-4分体结构,开发了用于水中Pb2+测定的一种高选择性和高灵敏的适配体电化学法,该方法的线性范围为0.001~1 000 μmol/L,检出限为0.4 nmol/L。LONG等[19]基于Pb2+可以诱导适配体构象变化,形成稳定的G-4/Pb2+复合物,开发了一种竞争性的适配体荧光测定法,用于环境样品中Pb2+的检测,该方法的线性范围为1~300 nmol/L,检出限为0.22 nmol/L。
1.2 适配体用于Hg2+和Ag+的检测
由于具有可逆的金属结合力,目标金属离子会在离子半径、配位行为和水合效应等阳离子性质的作用下,结合适配体并诱导产生特异性的二级结构[20-22]。当溶液中含有Hg2+和Ag+时,目标金属离子会将T-T和C-C错配转换为稳定的碱基对并形成相应的特定结构,其中,T-T错配会选择性的捕获Hg2+以形成T-Hg2+-T复合物[23-24],而C-C错配只能识别Ag+形成C-Ag+-C复合物[25-26]。WU等[27]开发了基于T-Hg2+-T结构的磁性适配体电化学法,用于水样中Hg2+的测定。由于链霉亲和素和生物素之间的特异性相互作用,生物素标记的富含T的适配体与固定在磁性玻碳电极表面的链霉亲和素修饰的磁珠结合。当溶液中加入Hg2+时,富含T的适配体可以捕获Hg2+形成稳定的T-Hg2+-T结构,导致电化学信号发生变化,实现Hg2+的高灵敏和高选择性测定,该方法的检出限为0.33 nmol/L,线性范围为1~200 nmol/L。XI等[28]开发了基于C-Ag+-C结构的比色法,用于快速、选择性和灵敏地检测水溶液中的Ag+,该比色法的线性范围为1 nmol/L~1 μmol/L,检出限低至0.236 nmol/L。
1.3 适配体用于Cd2+的检测
WU等[29]利用SELEX技术筛选到了Cd2+的高亲和力适配体Cd-4(解离常数为34.5 nmol/L),对Cd-4碱基序列进行分析,与富含A和C的非重复性单链DNA序列相比,富含T和G的单链DNA更容易与Cd2+结合,这与A和C缺乏形成配位键的位点,对Cd2+的亲和力较弱有关。在此基础上,并进一步将Cd-4作为分子识别元件,开发了用于Cd2+测定的比色法,该比色法的线性范围为10 nmol/L~1 mmol/L,检出限低至4.6 nmol/L。
1.4 适配体用于As3+的检测
KIM等[30]基于亲和柱的SELEX技术筛选到了As3+的高亲和力适配体Ars-3(对As3+和As5+的解离常数分别为7.05 nmol/L和4.95 nmol/L)。WU等[31]利用适配体Ars-3作为分子识别元件,开发了基于带正电荷的阳离子聚合物介导的AuNPs聚合的比色法,检出限为5.3×10-9。然而,由于AuNPs对反应条件十分敏感,该比色法的稳定性有待进一步提高。在此基础上,WU等[32]进一步提出了一种新型的血红素-H2O2体系氧化3,3′,5,5′-四甲基联苯胺(3,3′,5,5′-tetramethylbenzidine,TMB)比色法。在没有As3+时,适配体Ars-3在π-π作用下结合到血红素的吡咯环上,从而抑制血红素对TMB的催化活性,溶液呈现蓝色。添加As3+后,适配体Ars-3会与As3+结合形成Ars-3/As3+复合物,游离的血红素催化氧化TMB,生成二氨基甲酸酯的黄色产物,溶液由蓝色逐渐变为黄色。该比色法在检测稳定性提高的前提下,实现了As3+的高灵敏和选择性测定。
现阶段,虽然已经筛选到了多种重金属离子的适配体,但利用适配体技术检测重金属只局限在Pb2+、Hg2+、Cd2+、Ag+、As3+等靶标物上,其他重金属的适配体在应用范围、特异性和亲和力方面的研究仍较为欠缺。
表1 适配体重金属检测方法
Table 1 Aptamers detection methods for heavy metals

目标物适配体序列(5′→3′)检测方法及参考文献线性范围和检出限Pb2+GGGT GGGT GGGT GGGT适配体电化学法[18]0.001~1 000 μmol/L0.4 nmol/LPb2+GGGT GGGT GGGT GGGT适配体荧光测定法[19]1.0~300.0 nmol/L0.22 nmol/LHg2+TCTT TCTT CCCT TGTT TGT适配体电化学法[27]1~200 nmol / L0.33 nmol / LAg+TCAG CCCG GCGCCC CCCT GA比色法[28]1 nmol/L~1 μmol/L0.236 nmol/LCd2+GGAC TGTT GTGG TATT ATTT TTGG TTGT GC比色法[29]10 nmol/L~1 mmol/L4.6 nmol/LAs3+TTAC AGAA CAAC CAAC GTCG CTCC GGGT ACTT CTTC ATCG比色法[31]NR5.3 μg/LAs3+TTAC AGAA CAAC CAAC GTCG CTCC GGGT ACTT CTTC ATCG比色法[32]10~200 μg/L6 μg/L
注:NR表示未报道(下同)
2 基于纳米材料的适配体传感器在重金属检测中的应用
基于纳米材料的适配体传感器是以适配体为分子识别元件,以与靶标物的特异性作用引起的直接或间接信号变化并结合纳米材料的独特性能来进行检测的一类传感器[33-35]。根据信号转换方式的不同,其可分为基于纳米材料的电化学适配体传感器、基于纳米材料的荧光适配体传感器、基于纳米材料的比色适配体传感器、基于纳米材料的表面增强拉曼光谱(surface enhanced Raman spectroscopy,SERS)适配体传感器等几大类。表2列举了几种基于纳米材料的适配体传感器的优缺点及应用现状。
表2 基于纳米材料的重金属适配体传感器
Table 2 Aptasensors for heavy metal detection based on nanomaterial materials
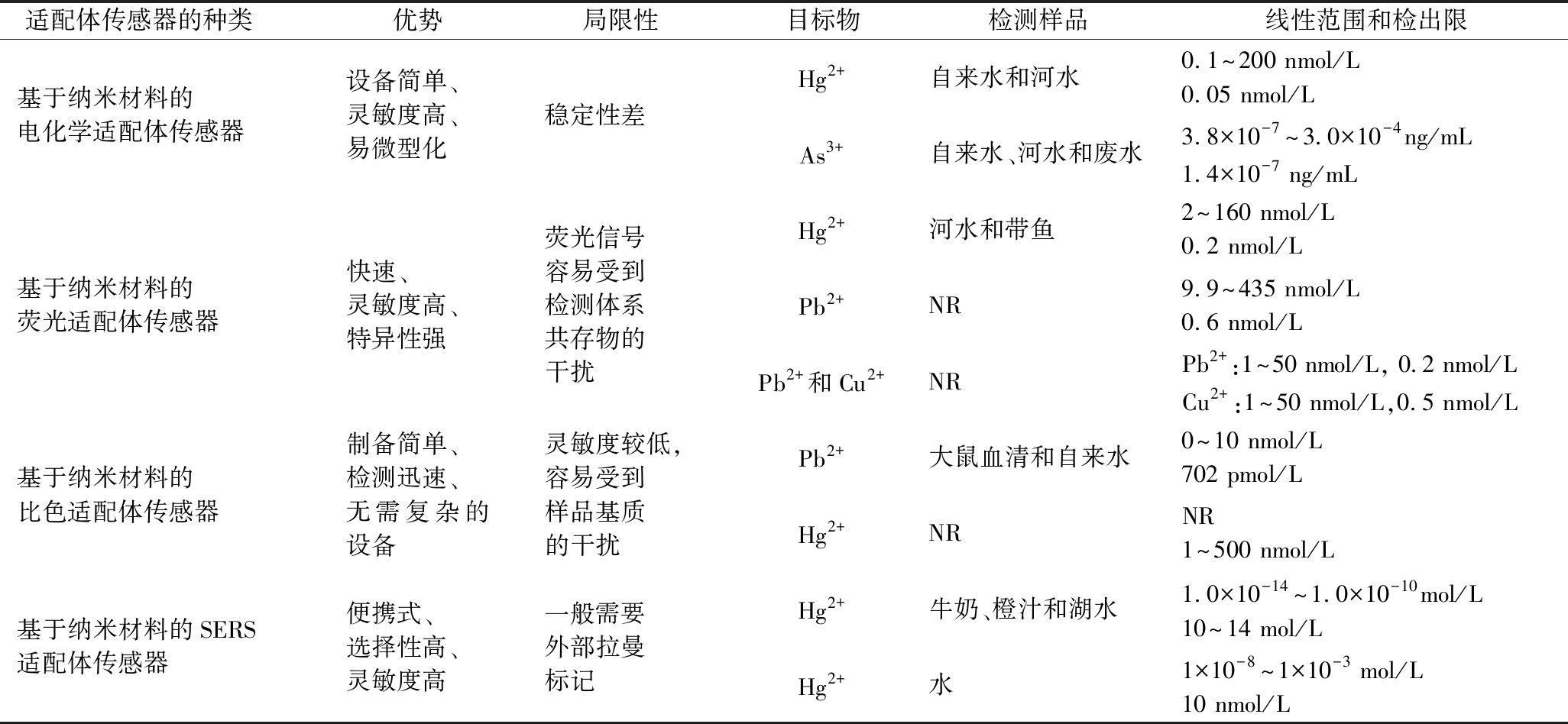
适配体传感器的种类 优势局限性目标物检测样品线性范围和检出限基于纳米材料的电化学适配体传感器设备简单、灵敏度高、易微型化稳定性差Hg2+自来水和河水0.1~200 nmol/L0.05 nmol/LAs3+自来水、河水和废水3.8×10-7~3.0×10-4ng/mL1.4×10-7 ng/mL基于纳米材料的荧光适配体传感器快速、灵敏度高、特异性强荧光信号容易受到检测体系共存物的干扰Hg2+河水和带鱼2~160 nmol/L0.2 nmol/LPb2+NR9.9~435 nmol/L0.6 nmol/LPb2+和Cu2+NRPb2+:1~50 nmol/L, 0.2 nmol/LCu2+:1~50 nmol/L,0.5 nmol/L基于纳米材料的比色适配体传感器制备简单、检测迅速、无需复杂的设备灵敏度较低,容易受到样品基质的干扰Pb2+大鼠血清和自来水0~10 nmol/L702 pmol/LHg2+NRNR1~500 nmol/L基于纳米材料的SERS适配体传感器便携式、选择性高、灵敏度高一般需要外部拉曼标记Hg2+牛奶、橙汁和湖水1.0×10-14~1.0×10-10mol/L10~14 mol/LHg2+水1×10-8~1×10-3 mol/L10 nmol/L
2.1 基于纳米材料的电化学适配体传感器
将纳米材料应用于电化学适配体传感器中可以有效地提高传感器的导电性能和催化性能[36-37],具有设备简单、灵敏度高、易微型化等特点,是目前重金属分析最活跃的研究领域之一。
ZHANG等[38]开发了高灵敏和选择性检测Hg2+的电化学适配体传感器,在Au-S共价键作用下固定在金电极表面的DNA-1与适配体杂交形成双链体结构,当体系中存在靶标物Hg2+时,Hg2+特异性的结合适配体形成更稳定的T-Hg2+-T结构,使得与DNA-1杂交的适配体量减少,电化学信号增大。该传感器的线性范围宽(0.1~200 nmol/L),灵敏度高(检出限为0.05 nmol/L),并已成功的用于自来水和河水中Hg2+的检测(加标回收率为96.9%~102%,相对标准偏差为2.35%~3.17%)。ENSAFI等[39]基于3D-rGO/AuNPs开发了用于测定As3+的新型电化学适配体传感器,如图1所示,将3D-rGO/AuNPs滴涂修饰到玻碳电极上,再在Au-S共价键作用下将5′-硫代适配体修饰到3D-rGO/AuNPs的表面,当存在靶标物As3+时,5′-硫代适配体与As3+结合形成G-4分体结构,阻碍反应体系的电子转移,使得电化学阻抗谱的信号增加。在最佳检测条件下,该电化学适配体传感器对As3+的检出限(1.4×10-7 ng/mL)极低,线性范围为3.8×10-7~3.0×10-4 ng/mL,并已成功地用于实际水样中As3+的测定(自来水,河水和废水中的加标回收率为96%~104%)。此外,所开发的基于3D-rGO/AuNPs的电化学适配体传感器具有良好的的选择性(高浓度的其他金属离子如Zn2+、Ag+和As5+等不影响As3+的测定)和重现性(相对标准偏差为2%)。基于纳米材料的电化学适配体传感器具有灵敏度高、设备简单、易微型化、选择性强的优点,但检测的稳定性有待进一步提高。
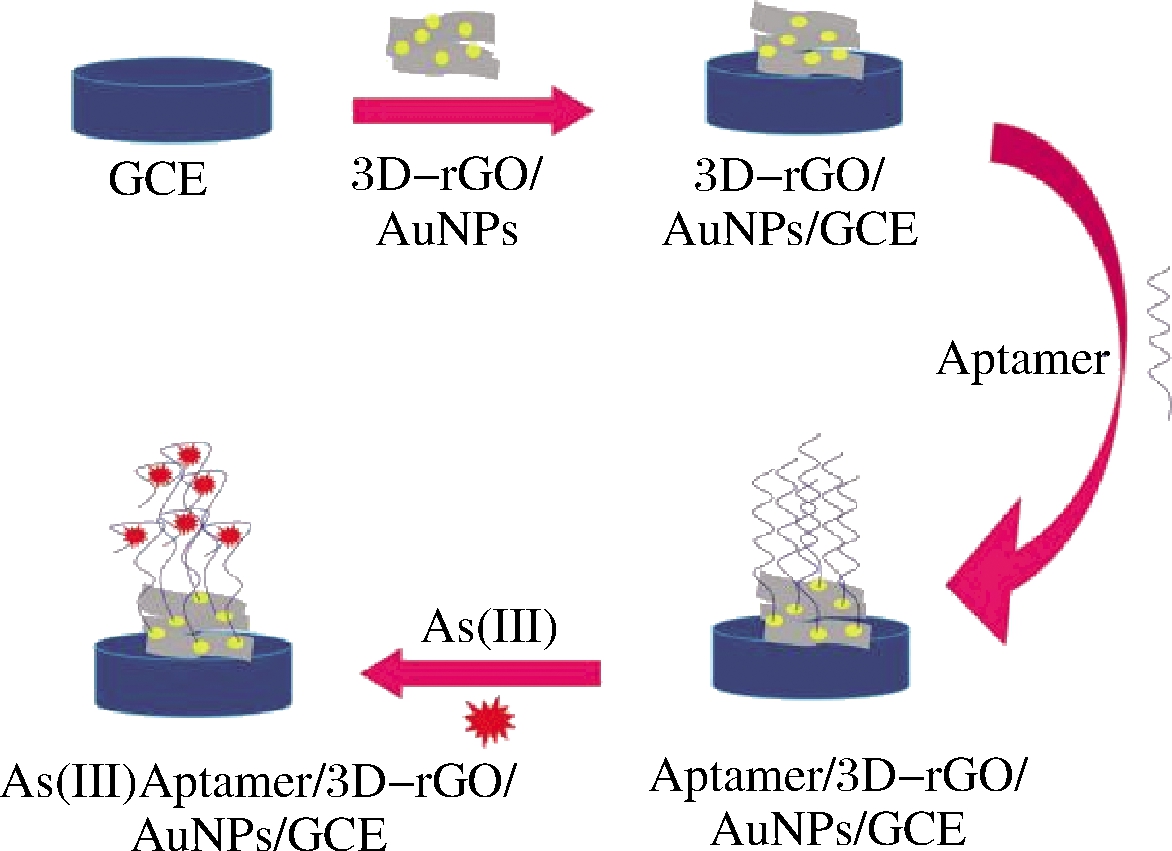
图1 电化学适配体传感器的示意图[39]
Fig.1 The mechanism reaction of the proposed electrochemical aptasensor[39]
2.2 基于纳米材料的荧光适配体传感器
近年来,基于纳米材料的荧光适配体传感器在分析化学领域中备受研究者们的关注[40],被认为是一种重要的重金属检测工具。
SUN等[41]基于磁分离和T-Hg2+-T碱基对的形成,开发了用于Hg2+检测的荧光适配体传感器。如图2所示,链霉亲和素修饰的磁珠会在链霉亲和素-生物素的强相互作用下捕获生物素修饰的适配体形成适配体功能化的磁珠,在没有Hg2+的情况下,荧光标记的信号转导探针可以通过碱基互补配对与适配体功能化的磁珠结合。磁分离后的检测溶液中几乎没有荧光标记的信号转导探针,导致荧光信号弱。当溶液中存在Hg2+时,Hg2+会诱导适配体和辅助DNA之间形成T-Hg2+-T碱基对。通过磁分离去除适配体功能化的磁珠后,溶液中会残留一定量的荧光标记的信号转导探针,导致荧光信号显著增强。该传感器的线性范围为2~160 nmol/L,检出限为0.2 nmol/L,已成功的用于河水和带鱼中Hg2+的测定(回收率为92.94%~105.16%,变异系数为0.44%~0.94%)。ZHAO等[42]利用石墨烯QDs的良好生物相容性和强荧光性,石墨烯QDs和GO之间独特的电子转移引起的荧光猝灭以及G-4/Pb2+复合物的形成而导致的荧光恢复来实现Pb2+的定量分析。该荧光适配体传感器检测时间短(1 min)、线性范围宽(9.9~435 nmol/L),且对Cd2+、Ag+、Cu2+、Hg2+等干扰离子表现出良好的选择性。
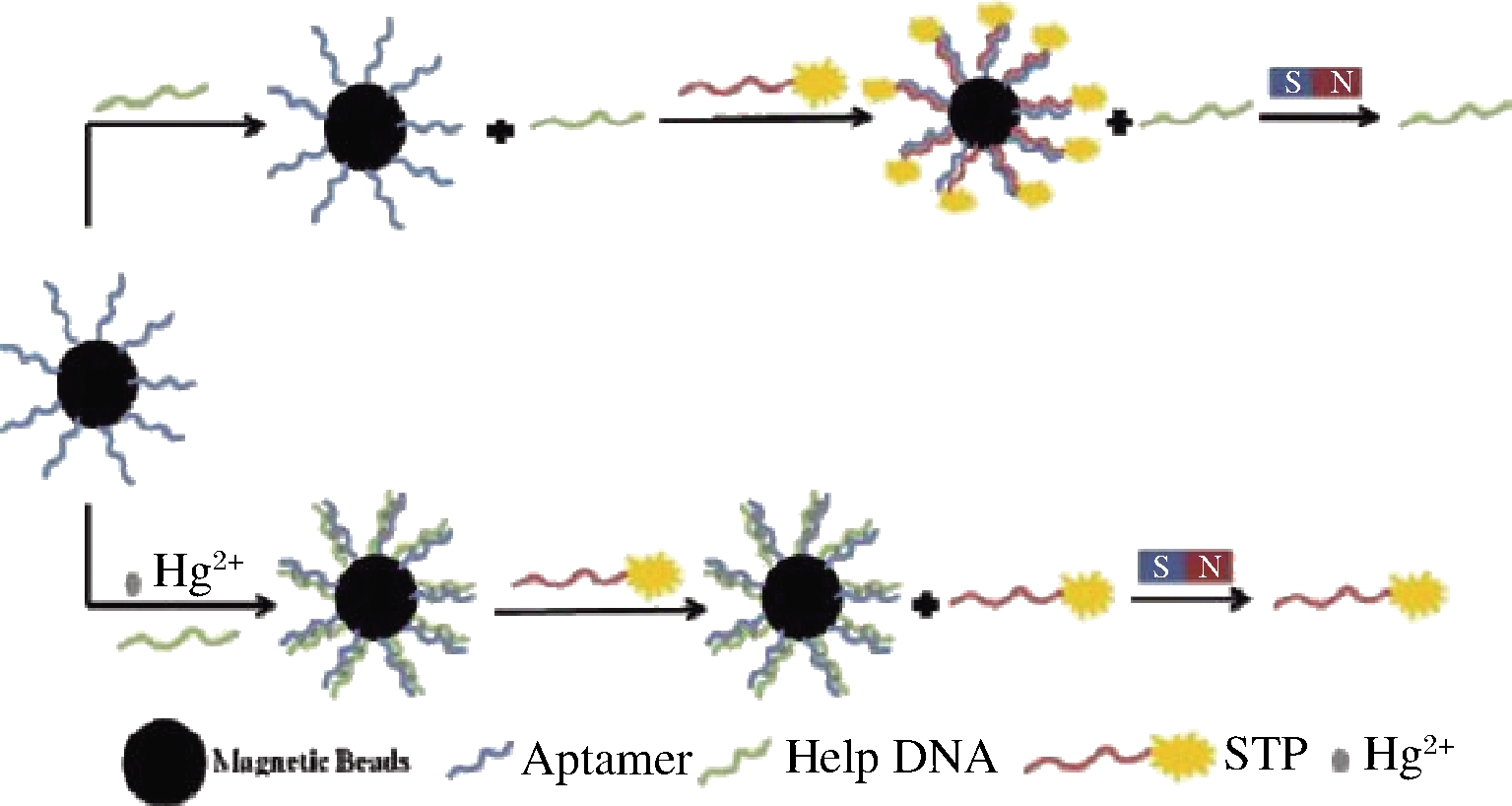
图2 基于T-Hg2+-T碱基对和磁分离的 Hg2+荧光测定的示意图[41]
Fig.2 Schematic illustration of the fluorescent assay for Hg2+ based on T-Hg 2+-T base pairs and magnetic separation[41]
WU等[43]提出了一种基于QDs和DNA酶的荧光适配体传感器,用于Pb2+和Cu2+的高灵敏、高选择性检测。在没有目标金属离子Pb2+和Cu2+的情况下,DNA酶与底物在碱基互补配对的作用下结合,由于荧光共振能量转移,DNA酶上标记的猝灭剂可以有效地猝灭QDs的荧光。在Pb2+和Cu2+存在时,金属离子会优先与DNA酶结合,使得底物和DNA酶远离QDs的表面,反应体系的荧光恢复。该传感器的线性范围为1~50 nmol/L,Pb2+和Cu2+的检出限分别为0.2 nmol/L和0.5 nmol/L。总的来说,基于纳米材料的荧光适配体传感器可以实现重金属离子的快速、高灵敏和高特异性测定,但荧光信号容易受到检测体系共存物的干扰,影响测定的准确性。
2.3 基于纳米材料的比色适配体传感器
基于纳米材料的比色适配体传感器具有无需仪器的可视化潜力、实验成本低、操作简单等特点[44-45],已成为不同种类重金属离子检测最理想的方法之一。
AuNPs是一种经典的贵金属纳米材料,具有较高的消光系数且在不同聚集态时会产生不同的颜色变化[46],被广泛用于比色适配体传感器的构建中。WU等[29]利用AuNPs这种独特的性能,开发了用于Cd2+测定的比色法。当不存在Cd2+时,适配体与二烯丙基二甲基氯化铵(poly dimethyl ammonium chloride,PDDA)结合形成“双链体”结构,溶液中的AuNPs由于缺乏PDDA而无法聚集,此时溶液的颜色是酒红色。当溶液中存在靶标物Cd2+时,适配体优先与Cd2+结合,游离的PDDA会聚集AuNPs,溶液的颜色从酒红色变成蓝色。TAGHDISI等[47]开发了一种基于聚乙烯亚胺和AuNPs的比色适配体传感器(图3),用于Pb2+的选择性检测。在没有Pb2+的情况下,适配体在静电作用下与聚乙烯亚胺结合,导致聚乙烯亚胺的数量不足以诱导AuNPs的聚集,溶液为酒红色。加入Pb2+后,适配体的构像发生变化,形成G-4/Pb2+ 复合物,游离的带正电荷的聚乙烯亚胺会诱导AuNPs聚集,溶液颜色由酒红色变为蓝色。该传感器的线性范围为0~10 nmol/L,检出限为702 pmol/L,并已成功应用于大鼠血清和自来水中Pb2+的检测。此外,研究表明,银染色的增强效应很大程度上取决于AuNPs的数量和分散状态[48-49]。当AuNPs分散时,每个AuNPs都暴露在银增强溶液中,导致AuNPs的表面积大得多,从而催化在单位时间内减少更多的银离子,溶液颜色较深。然而,当AuNPs聚集时,只有外部的AuNPs暴露在外,因此催化的银离子减少,溶液颜色较浅。基于这一现象,CHEN等[50]构建了用于Hg2+检测的比色适配体传感器,在Hg2+存在时,适配体功能化的AuNPs由于T-Hg2+-T复合物的形成而聚集在一起,导致在着色过程中暴露银离子的AuNPs表面积大大降低,因此,溶液的颜色较浅。当不存在Hg2+时,适配体功能化的AuNPs分散暴露于银增强溶液中,此时溶液颜色较深。该比色传感器的线性范围为1~500 nmol/L,且对干扰离子(Cd2+、Ag+、Cu2+等)表现出良好的特异性。与其他分析方法相比,基于纳米材料的比色适配体传感器无需复杂的设备,可以直接通过肉眼观察到的颜色变化来检测重金属,更有利于实现样品的原位实时快速筛查,但其检测的灵敏度较低,且容易受到样品基质的干扰。

图3 基于聚乙烯亚胺和AuNPs的比色适配体传感器, 用于Pb2+的检测[47]
Fig.3 Schematic diagram of colorimetric aptasensor based on polyethyleneimine and AuNPs for Pb2+ detection[47]
2.4 基于纳米材料的SERS适配体传感器
SERS是一种强大的振动光谱技术,可通过放大由局部表面等离子体激发而产生的电磁场,对低浓度分析物进行快速、无损和痕量化学检测[51-52]。近年来,将纳米材料应用于SERS适配体传感器中可极大地提高检测灵敏度,已成为适配体传感领域一个重要的研究方向。
DU等[53]提出了一种便携式高灵敏SERS适配体传感器,4,4-联吡啶(4,4-bipyridine,DPY)分子有2个对称形式的吡啶环,这两个富含电子的氮原子可以结合到Au@Ag纳米颗粒的银壳上,当溶液中存在Hg2+时,DPY会优先与Hg2+结合并从Au@Ag纳米颗粒上释放出来,从而淬灭DPY的SERS信号。该SERS适配体传感器的线性范围为1.0×10-14~1.0×10-10 mol/L,检出限为1.0×10-14 mol/L,在牛奶、橙汁和湖水中的加标回收率为98.33%~107.77%。具有可回收利用、每次测试只需要非常少量的样本(20 μL)、耗时短(在4 min内即可完成检测)、成本低廉等优点。LU等[54]开发了基于T-Hg2+-T碱基对和SiO2@Au核壳结构的SERS适配体传感器,用于水溶液中Hg2+的超灵敏和选择性测定。如图4所示,在Au-S共价键作用下将富含T的适配体固定在SiO2@Au核壳纳米颗粒的表面上,加入Hg2+后,Hg2+可以特异性的结合适配体上的T碱基形成T-Hg2+-T碱基对,使得固定SiO2@Au核壳表面上的适配体方向由平行变为垂直,拉曼强度比I(660 cm-1)/I(736 cm-1)随着Hg2+浓度的增加而增加。该基于纳米材料的SERS适配体传感器的线性范围为1×10-8~1×10-3 mol/L,检出限低至10 nmol/L,且对Zn2+、Cu2+、Cd2+、Pb2+等干扰离子表现出良好的选择性。基于纳米材料的SERS适配体传感器可以实现重金属离子的高选择性、便携式和超灵敏检测,但一般需要外部拉曼标记,这必然会增加检测系统的成本和复杂性。

图4 用于Hg2+测定的无标记SERS适配体传感器 示意图[54]
Fig.4 Schematic representation of the label-free SERS aptasensor detection method for Hg2+ detection[54]
3 结语
纳米材料具有独特的光学、电子和催化性质,是用于固定化分子识别元件-适配体的有效材料。结合纳米材料的适配体传感器在重金属分析检测中具有快速、灵敏度高和选择性强等优势,在重金属检测领域具有很强的发展潜质。然而,目前文献报道的重金属适配体主要集中在Pb2+、Hg2+、Cd2+、Ag+、As3+上,仍有许多重金属缺乏适配体,未来需进行大量的适配体筛选工作;在重金属分析检测中,多数研究的适配体只针对一种靶标物,未来应加强多种靶标物的同时、高效、准确检测;此外,多种结合纳米材料的适配体传感器还未能实现现场复杂样品的实时检测,未来应加强高灵敏重金属传感器及小型便携式商业快检设备、产品的研发。
[1] 于寒松, 隋佳辰, 代佳宇, 等.核酸适配体技术在食品重金属检测中的应用研究进展[J].食品科学, 2015, 36(15):228-233.
YU H S, SUI J C, DAI J Y, et al.Advances in the application of aptamers to detect heavy metals in foods[J].Food Science, 2015, 36(15):228-233.
[2] SHARMA B, SINGH S, SIDDIQI N J.Biomedical implications of heavy metals induced imbalances in redox systems[J].Biomed Resarch Interational, 2015, 2014(1):1-26.
[3] RODOLFO F M, ISABEL R, ISABEL G P, et al.Evaluation of different digestion systems for determination of trace mercury in seaweeds by cold vapour atomic fluorescence spectrometry[J].Journal of Food Composition & Analysis, 2015, 38:7-12.
[4] BUA D G, ANNUARIO G, ALBERGAMO A, et al.Heavy metals in aromatic spices by inductively coupled plasma-mass spectrometry[J].Food Additives & Contaminants Part B, 2016, 9(3):210-216.
[5] ZHAO J H, YAN X, ZHOU T Y, et al.Multi-throughput dynamic microwave-assisted leaching coupled with inductively coupled plasma atomic emission spectrometry for heavy metal analysis in soil[J].Journal of Analytical Atomic Spectrometry, 2015, 30(9):1 920-1 926.
[6] QIN Y Y, ZHANG Z H, LI L, et al.Inductively coupled plasma orthogonal acceleration time-of-flight mass spectrometry (ICP-oa-TOF-MS) analysis of heavy metal content in Indocalamus tesselatus samples[J].Food Chemistry, 2013, 141(3):2 154-2 157.
[7] WANG L Y, PENG X L, FU H J, et al.Recent advances in the development of electrochemical aptasensors for detection of heavy metals in food[J].Biosensors & Bioelectronics, 2020, 147:111 777.
[8] LI M, GOU H L, AL-OGAIDI I, et al.Nanostructured sensors for detection of heavy metals:A review[J].Acs Sustainable Chemistry & Engineering, 2013, 1(7):713-723.
[9] SUI J C, YU H S, DAI J Y, et al.Application of aptamer biosensor technology to detect heavy metal lead in food[J].Journal of Chinese Institute of Food Science & Technology, 2017, 17(8):203-209.
[10] LI J W, FANG X H, TAN W H.Molecular aptamer beacons for real-time protein recognition[J].Biochemical & Biophysical Research Communications, 2002, 292(1):31-40.
[11] YANG Y, LI W, SHEN P, et al.Aptamer fluorescence signal recovery screening for multiplex mycotoxins in cereal samples based on photonic crystal microsphere suspension array[J].Sensors and Actuators B:Chemical, 2017, 248:351-358.
[12] WU Y G, ZHAN S S, XING H B, et al.Nanoparticles assembled by aptamers and crystal violet for arsenic(III)detection in aqueous solution based on a resonance Rayleigh scattering spectral assay[J].Nanoscale, 2012, 4(21):1-9.
[13] GOUD K, REDDY K, SATYANARAYANA M, et al.A review on recent developments in optical and electrochemical aptamer-based assays for mycotoxins using advanced nanomaterials[J].Microchimica Acta, 2020, 187(29):1-32.
[14] GUSCHLBAUER W, CHANTOT J, THIELE D.Four-stranded nucleic acid structures 25 years later:From guanosine gels to telomer DNA[J].Journal of Biomolecular Structure & Dynamics, 1990, 8(3):491-511.
[15] SMIRNOV I, SHAFER R H.Lead is unusually effective in sequence-specific folding of DNA[J].Journal of Molecular Biology, 2000, 296(1):1-5.
[16] GUPTA S D, SHELKE S A, LI N S, et al.Spinach RNA aptamer detects lead (II) with high selectivity[J].Chemical Communications, 2015, 51 (43):9 034-9 037.
[17] LIN Z Z, CHEN Y, LI X H, et al.Pb2+ induced DNA conformational switch from hairpin to G-quadruplex:electrochemical detection of Pb2+[J].Analyst, 2011, 136(11):2 367-2 372.
[18] LI F, FENG Y, ZHAO C, et al.Crystal violet as a G-quadruplex-selective probe for sensitive amperometric sensing of lead[J].Chemical Communications, 2011,47(43):11 909-11 911.
[19] LONG F, ZHU A, WANG H C.Optofluidics-based DNA structure-competitive aptasensor for rapid on-site detection of lead(II) in an aquatic environment[J].Analytica Chimica Acta, 2014, 849:43-49.
[20] LAN L Y, YAO Y, PING J F, et al.Recent progress in nanomaterial-based optical aptamer assay for the detection of food chemical contaminants[J].ACS Applied Materials & Interfaces, 2017, 9(28):23 287-23 301.
[21] DAIRAKU T, FURUITA K, SATO H, et al.Direct detection of the mercury-nitrogen bond in the thymine-HgII-thymine base-pair with 199Hg NMR spectroscopy[J].Chemical Communications, 2015, 51(40):8 488-8 491.
[22] TUREL I, KLJUN J.Interactions of metal ions with DNA, its constituents and derivatives, which may be relevant for antcancer research[J].Current Topics in Medicinal Chemistry, 2011, 11(21):2 661-2 687.
[23] HE J L, LIU G G, LI Z W, et al.Studies on the thymine-mercury- thymine base pairing in parallel and anti-parallel DNA duplexes[J].New Journal of Chemistry, 2015, 39(11):8 752-8 762.
[24] MIYAKE Y, TOGASHI H, TASHIRO M, et al.Mercury(II)-mediated formation of thymine-Hg-II-thymine base pairs in DNA duplexes[J].Journal of the American Chemical Society, 2006, 128(7):2 172-2 173.
[25] ONO A, CAO S, TOGASHI H, et al.Specific interactions between silver(I) ions and cytosine-cytosine pairs in DNA duplexes[J].Chemical Communications, 2008, 44(39):4 825-4 827.
[26] ZHENG Y, YANG C, YANG F, et al.Real-time study of interactions between cytosine-cytosine pairs in DNA oligonucleotides and silver ions using dual polarization interferometry[J].Analytical Chemistry, 2014, 86(8):3 849-3 855.
[27] WU D, WANG Y G, ZHANG Y, et al.Facile fabrication of an electrochemical aptasensor based on magnetic electrode by using streptavidin modified magnetic beads for sensitive and specific detection of Hg2+[J].Biosensors & Bioelectronics, 2016, 82:9-13.
[28] XI H Y, CUI M J, LI W, et al.Colorimetric detection of Ag+ based on C-Ag+-C binding as a bridge between gold nanoparticles[J].Sensors & Actuators B:Chemical, 2017, 250:641-646.
[29] WU Y G, ZHAN S S, WANG L M, et al.Selection of a DNA aptamer for cadmium detection based on cationic polymer mediated aggregation of gold nanoparticles[J].The Analyst, 2014, 139(6):1 550-1 561.
[30] KIM M, UM H J, BANG S B, et al.Arsenic removal from vietnamese groundwater using the arsenic-binding DNA aptamer[J].Environmental Science & Technology, 2009, 43(24):9 335-9 340.
[31] WU Y G, ZHAN S S, WANG F, et al.Cationic polymers and aptamers mediated aggregation of gold nanoparticles for the colorimetric detection of arsenic(III) in aqueous solution[J].Chemical Communications, 2012, 48(37):4 459-4 461.
[32] WU Y G, WANG F, ZHAN S S, et al.Regulation of hemin peroxidase catalytic activity by arsenic-binding aptamers for the colorimetric detection of arsenic(III)[J].RSC Advances, 2013, 3(48):25 614-25 619.
[33] 郭婷, 林淑凤, 马良, 等.基于磁性纳米材料和适配体的荧光传感器检测牛奶中黄曲霉毒素M1[J].食品与发酵工业, 2019, 45(5):218-223.
GUO T, LIN S F, MA L, et al.A fluorescent biosensor based on magnetic nanoparticles and aptamer for detecting AFM1 in milk[J].Food and Fermentation Industries, 2019, 45(5):218-223.
[34] XU Y W, ZHANG W, SHI J Y, et al.Impedimetric aptasensor based on highly porous gold for sensitive detection of acetamiprid in fruits and vegetables[J].Food Chemistry, 2020, 322:126 762.
[35] ZHANG Z H, JI H F, SONG Y P, et al.Fe(III)-based metal-organic framework-derived core-shell nanostructure:Sensitive electrochemical platform for high trace determination of heavy metal ions[J].Biosensors & Bioelectronics, 2017, 94:358-364.
[36] MIAO P, LIU L, LI Y, et al.A novel electrochemical method to detect mercury (II) ions[J].Electrochemistry Communications, 2009, 11(10):1 904-1 907.
[37] GU H D, YANG Y Y, CHEN F, et al.Electrochemical detection of arsenic contamination based on hybridization chain reaction and RecJ f exonuclease-mediated amplification[J].Chemical Engineering Journal, 2018, 353:305-310.
[38] ZHANG Y Y, ZHANG C, MA R, et al.An ultra-sensitive au nanoparticles functionalized DNA biosensor for electrochemical sensing of mercury ions[J].Materials Science & Engineering C, 2017, 75:175-181.
[39] ENSAFI A A, AKBARIAN F, HEYDARI S E, et al.A novel aptasensor based on 3D-reduced graphene oxide modified gold nanoparticles for determination of arsenite[J].Biosensors & Bioelectronics, 2018, 122(30):25-31.
[40] SONG X L, FU B C, LAN Y F, et al.Label-free fluorescent aptasensor berberine-based strategy for ultrasensitive detection of Hg2+ ion[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2018, 204:301-307.
[41] SUN C Y, SUN R, CHEN Y Q, et al.Utilization of aptamer-functionalized magnetic beads for highly accurate fluorescent detection of mercury (II) in environment and food[J].Sensors & Actuators B Chemical, 2018, 255(1):775-780.
[42] ZHAO S Q, XIAO Y S, LU J C, et al.A fluorescent nanosensor based on graphene quantum dots-aptamer probe and graphene oxide platform for detection of lead (II) ion[J].Biosensors & Bioelectronics, 2015, 68:225-231.
[43] WU C S, KHAING O, FAN X.Highly sensitive multiplexed heavy metal detection using quantum-dot-labeled DNAzymes[J].Acs Nano, 2010, 4(10):5 897-5 904.
[44] 王嫦嫦, 马良, 刘微, 等.基于先进材料的适配体传感器在真菌毒素快速检测中的研究进展[J].食品科学, 2020, 41(3):305-313.
WANG C C, MA L, LIU W, et al.Advances in aptasensors based on smart materials for rapid detection of mycotoxins[J].Food Science, 2020, 41(3):305-313.
[45] FARZIN L, SHAMSIPUR M, SHEIBANI S.A review:Aptamer-based analytical strategies using the nanomaterials for environmental and human monitoring of toxic heavy metals[J].Talanta, 2017, 174(1):619-627.
[46] LAN L Y, YAO Y, PING J F, et al.Recent progress in nanomaterial-based optical aptamer assay for the detection of food chemical contaminants[J].ACS Applied Materials & Interfaces, 2017, 9(28):23 287-23 301.
[47] TAGHDISI S M, DANESH N M, LAVAEE P, et al.An aptasensor for selective, sensitive and fast detection of lead(Ⅱ) based on polyethyleneimine and gold nanoparticles[J].Environmental Toxicology and Pharmacology, 2015, 39(3):1 206-1 211.
[48] LI L H, FENG D X, FANG X, et al.Visual sensing of Hg2+ using unmodified Au@Ag core-shell nanoparticles[J].Journal of Nanostructure in Chemistry, 2014, 4:117-120.
[49] ZHANG Z, CHEN C L, ZHAO X S.A simple and sensitive biosensor based on silver enhancement of aptamer-gold nanoparticle aggregation[J].Electroanalysis, 2009, 21(21):1 316-1 320.
[50] CHEN B B, WANG Z B, HU D X, et al.Determination of nanomolar levels of mercury(II) by exploiting the silver stain enhancement of the aggregation of aptamer-functionalized gold nanoparticles[J].Analytical Letters, 2014, 47(5):795-806.
[51] SHARMA B, FRONTIERA R R, HENRY A I, et al.SERS:Materials, applications, and the future[J]. Materials Today,2012, 15(1-2):16-25.
[52] GUO S J, DONG S J.Metal nanomaterial-based self-assembly:Development, electrochemical sensing and SERS applications[J].Journal of Materials Chemistry, 2011, 21(42):16 704-16 716.
[53] DU Y X, LIU R L, LIU B H, et al.Surface-enhanced raman scattering chip for femtomolar detection of mercuric ion (II) by ligand exchange[J].Analytical Chemistry, 2013, 85(6):3 160-3 165.
[54] LU Y L, ZHONG J, YAO G H, et al.A label-free SERS approach to quantitative and selective detection of mercury (Ⅱ) based on DNA aptamer-modified SiO2@Au core/shell nanoparticles[J].Sensors and Actuators, 2018, 258:365-372.