糖尿病(diabetes mellitus,DM)是以高血糖水平为特征的代谢紊乱性疾病,由胰岛素抵抗或/和分泌缺乏引起[1],按病因主要分为I型(胰岛素依赖型)、II型(非胰岛素依赖型)、特殊类型(胰岛β细胞功能遗传性缺陷等)和妊娠期糖尿病4个类型。中国是全球糖尿病患者最多的国家,以Ⅱ型糖尿病(type 2 diabetes mellitus,T2DM)为主(占糖尿病患者90%以上)[2]。近年来,全球糖尿病患病率急剧上升,截至2017年,国际糖尿病联盟公布全球患糖尿病人数高达4.51亿,且接近50%的患者没有确诊[3]。如果不加以治疗,持续的糖尿病会导致多种并发症如心脏病、心血管疾病、肾衰竭等[4],已成为世界第八大死因[5],其高患病率对社会经济发展具有重要影响,各国迫切希望根治糖尿病。然而,由于其发病机理复杂,临床药物如阿卡波糖、二甲双胍等控制病情的同时会带来许多毒副作用,如腹泻、腹胀等。考虑到糖尿病治疗的长期性,应认真考虑临床药物所带来的这些负面效应,研究更高效安全的新型治疗药物和治疗方案。
天然植物多糖作为植物体内极其重要的生物大分子,毒副作用小,具有诸多药理活性,例如降血糖、抗氧化、抗肿瘤、免疫调节等。且富饶的植物资源为高附加值植物多糖产品的深入开发和利用奠定了深厚的物质基础[6]。因此,天然植物多糖作为缓解糖尿病的新型药物,其研究与开发具有极好的前景。近年来,国内外学者不断的从不同植物中分离出具有降血糖活性的多糖类,利用动物和细胞模型,深入研究验证其降血糖机制。肖瑞希等[7]对降血糖植物多糖的种类和作用机制进行了综述,但没有涉及糖尿病发病机理。本文在简述T2DM发病因素的同时,综述了多种天然植物多糖在T2DM治疗中的降血糖机制及相关研究现状,以期为治疗T2DM的植物多糖产品研发、T2DM的日常预防及相关治疗等提供理论参考。
1 Ⅱ型糖尿病的发病因素
T2DM作为一种可预防的、复杂的代谢紊乱疾病,初步研究发现T2DM是由遗传和表观环境因素共同作用引起的[8],但具体的致病机理目前仍不清楚。
1.1 遗传因素
T2DM具有强遗传性,有明显的家族史。有研究指出,可引起T2DM遗传的因素主要有胰岛素抵抗(insulin resistance,IR)的遗传缺陷和β细胞的遗传缺陷。具体发病机理可能是:(1)在T2DM患病期间,产生多基因调控异常,甚至引起胰岛素受体基因突变,从而导致胰岛素数目及结构异常,生物活性降低甚至完全丧失[9],进而导致IR,再进一步遗传影响下一代。(2)T2DM患者通常β细胞受损,不能正常分泌胰岛素,难以维持血糖平衡。同时,T2DM具有许多微效易感基因,如TCF7L2基因,其与T2DM的遗传易感性相关。而TCF7L2活性降低会导致β细胞凋亡[10],影响胰岛素的分泌。
1.2 表观环境因素
表观环境因素与T2DM密切相关。主要有以下7种:
(1)肥胖:肥胖是T2DM的独立危险因素,研究指出80%的T2DM患者都患有不同程度的肥胖[11]。肥胖者体内有大量脂肪代谢发生,释放大量游离脂肪酸(free fatty acid,FFA),分泌多种炎症因子TNFɑ、IL-6、IL-1β、IL-8。炎症因子降低了胰岛素受体底物-1(insulin receptor substrate,IRS-1)的酪氨酸磷酸化水平,诱发IR[12]。
(2)老龄化:老年人机体衰老,β细胞功能下降,葡萄糖耐量与年龄负相关,增加IR,诱导形成T2DM[13]。
(3)应激:过大的心理压力使皮质醇分泌过量,从而降低葡萄糖摄取量,交感神经兴奋会削弱β细胞的功能,减少胰岛素分泌。长期的高压和抑郁使机体处于炎症状态,加大了患T2DM的风险[14]。
(4)饮食因素:T2DM的病发多是由于机体中过多的炎症因子、氧化因子长期累积引起的代谢紊乱。油炸食品等高氧化因子食物和食用盐过量摄入或可增加T2DM患病风险[15]。
(5)葡萄糖毒性和脂毒性:葡萄糖毒性即慢性高血糖常引起慢性微血管并合症,导致细胞免疫能力受损及周期异常,使胰岛素分泌损伤。葡萄糖毒性多是通过多种机制损伤β细胞,如氧化应激、炎症、β细胞去分化等[16]。脂毒性是脂肪代谢中脂肪变性、脂肪生成和磷脂沉积等产生的毒副作用,多引起FFA浓度升高加重IR,并使β细胞受损。脂肪组织中,具有抗炎作用的瘦素、脂联素减少,炎症因子[核转录因子κB(nuclear transcription factor-κB,NF-κB)、TNFα、IL-1β和IL-6]增加[17]。
(6)氧化应激:高血糖和高FFA水平导致活性氧簇(reactive oxygen species,ROS)过量产生,使β细胞中胰岛素合成和分泌减少。炎症因子分泌增加,导致β细胞功能下降和IR。
(7)内质网应激:增加胰岛素合成需求会导致β细胞内质网应激,激活炎性通路,导致IRS-1中丝氨酸磷酸化,减少胰岛素的合成与分泌,促进β细胞凋亡,引发IR[12]。
2 植物多糖对T2DM的降血糖作用
植物多糖是一类由相同/不同的醛糖/酮糖的糖苷键连接缩合而成的结构复杂的高分子化合物[1],高度稳定、安全且无毒,大量研究报道植物多糖具有降血糖活性,LI等[18]从北方还阳参中提取分离得到3种酸性多糖均对KK-Ay小鼠的血糖水平具有调节作用,可用于T2DM的治疗。丁婷等[19]证明桃胶多糖对糖尿病小鼠有降血糖作用,且高剂量时与阳性药效果相当。尽管不同植物多糖降血糖机制存在差异,并且可能存在多种机制(图1),但其主要是促进胰岛素分泌、抑制胰岛细胞凋亡[20]、增强胰岛素敏感性、降低胰岛素抵抗[21]、调节相关酶活性[22]、抗炎[23]、提高抗氧化应激能力[24]、调节相关信号通路[25]、调节肠道菌群[26]等方面发挥作用,可作为抗糖尿病潜在药物。
2.1 促进胰岛素分泌,抑制胰岛细胞凋亡
胰岛素是由β细胞分泌产生并释放到血液中的激素,与胰岛α细胞分泌的胰高血糖素共同控制血糖平衡、调节葡萄糖稳态,通过促进肝脏、肌肉及脂肪等周围靶组织细胞对葡萄糖的摄取和利用、肝糖原合成及改善糖代谢而降低餐后血糖水平[27]。保护并改善β细胞活性、抑制胰岛细胞凋亡进而有效促进胰岛素分泌,发挥降血糖的作用。黄芪多糖(astragalus polysaccharide,APS)[20]改善T2DM大鼠的糖脂代谢可能是通过保护β细胞并增加其数量,进而促进胰岛素的分泌。同时APS也可通过激活磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)/蛋白激酶B(protein kinase B,AKT)信号通路,上调胰高血糖素样肽1(glucagon-like peptide 1,GLP-1)受体、胰腺十二指肠同源盒因子1(pancreatic and duodenal homeobox 1,PDX-1)、抗凋亡蛋白B淋巴细胞瘤-2(blymphocyte tumor-2,Bcl-2)的表达[28];下调促凋亡蛋白Bcl-2相关的X蛋白(Bcl2-Associated X,Bax)的表达,进而抑制小鼠胰岛β细胞系β-TC6细胞凋亡,达到降血糖的目的。研究发现胰高血糖素样肽1(glucagon-like peptide 1,GLP-1)可多机制地保护胰岛细胞,对T2DM有着重要的影响,杨光[29]提出多花黄精多糖(Polygonatum cyrtonema Hua polysaccharides,PCP)可促进GLP-1分泌来改善糖尿病。
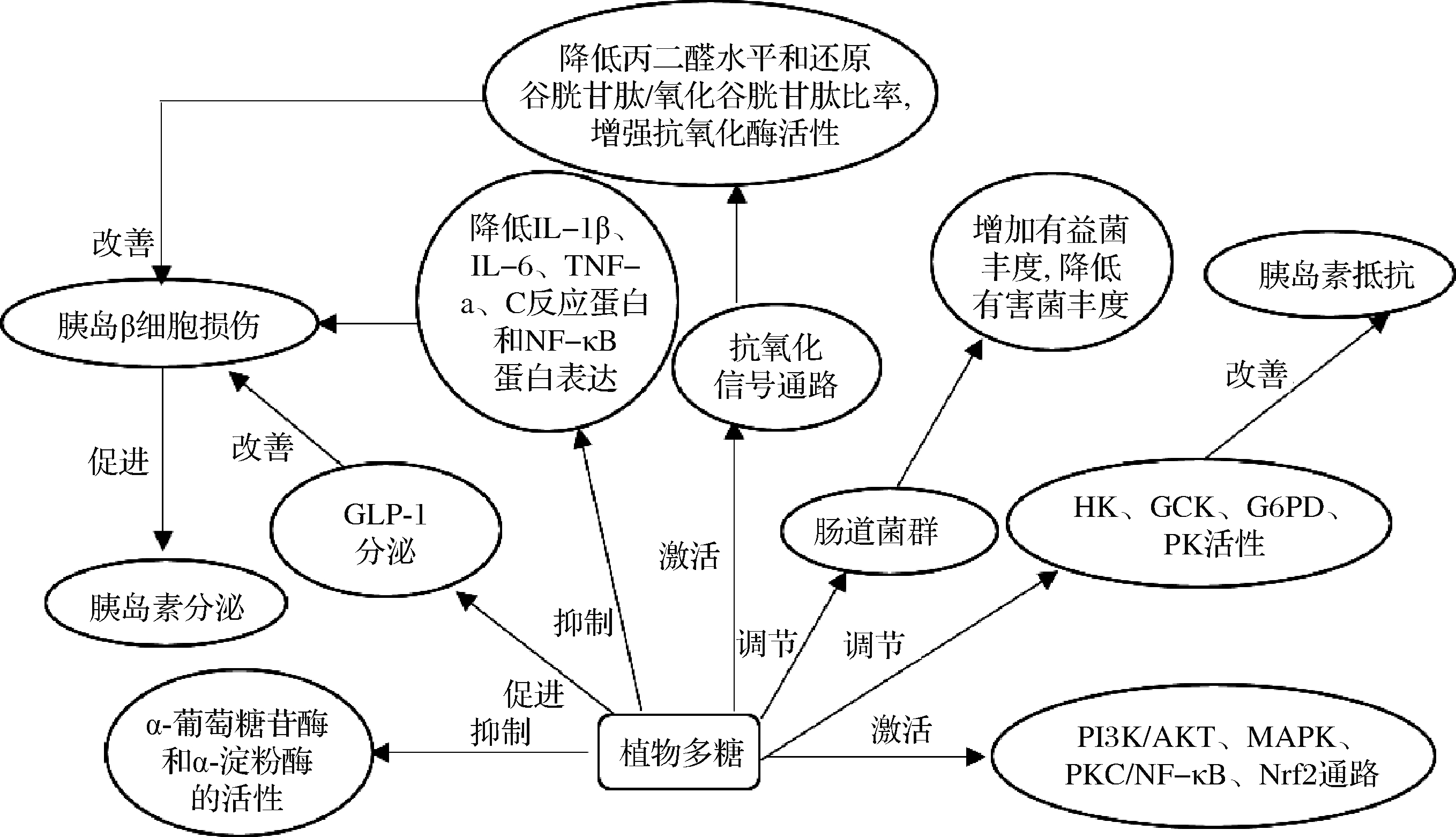
图1 植物多糖降血糖机制
Fig.1 Hypoglycemic mechanism of plant polysaccharide
2.2 增强胰岛素敏感性,降低胰岛素抵抗
IR是指各种因素使机体胰岛素的敏感性降低,增强胰岛素敏感性是调节血糖平衡的重要途径[27]。IR患者易患多种代谢紊乱性危险疾病,如T2DM、高血压、血脂异常等。IR与较高的炎症和脂质代谢改变相关[9]。已有研究证实胰岛素抵抗指数水平与血清甘油三酯(triglyceride,TG)及空腹血糖正相关,与高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)负相关[30],调节TG和HDL-C水平可以改善IR。CHEN等[31]报道灰树花多糖主要通过激活IRS-1、PI3K和葡萄糖转运蛋白4(glucose transporter 4,GLUT4),抑制转导通路c-jun氨基末端激酶(c-Jun N-terminal kinase,JNK)来降血糖。研究发现血红铆钉菇子实体多糖对瘦素缺陷小鼠的降血糖作用通过激活腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)通路来增加自噬作用,增加过氧化物酶体增殖剂激活受体α氧(peroxisome proliferators-activated receptor α,PPARα)和肉碱棕榈酰转移酶1A(carnitine palmitoyltransferase-1A,CPT-1A)表达来增强脂解作用,从而抑制肝脏脂质沉积,提高胰岛素敏感性[21]。
2.3 调节相关酶活性
2.3.1 抑制α-葡萄糖苷酶和α-淀粉酶的活性
T2DM患者体内的细胞会产生IR,导致胰岛素信号通路的干扰,以及脂肪和肌肉等组织的葡萄糖摄入受损,它们被α-淀粉酶和α-葡萄糖苷酶迅速降解,导致餐后血糖水平迅速升高[32]。因此,控制糖尿病的一种方法是通过天然产物竞争性抑制关键消化酶(α-淀粉酶和α-葡萄糖苷酶)来延缓消化道中碳水化合物的吸收和消化[33],降低餐后高血糖。南非海藻中提取的岩藻多糖对α-淀粉酶和α-葡萄糖苷酶活性产生一定抑制作用,有效地控制血糖,对于T2DM的治疗有着巨大潜力[34]。SHAO等[22]将牛蒡根多糖以水热法合成了碳纳米颗粒(carbon nanoparticles,CPNs),证明了CPNs能抑制α-葡萄糖苷酶活性,进而降低高脂饮食和链脲佐菌素(streptozotocin,STZ)诱导的糖尿病小鼠的血糖。
2.3.2 调节肝脏葡萄糖代谢相关酶,改善糖代谢
葡萄糖代谢紊乱是导致T2DM的主要原因之一。葡萄糖是α-淀粉酶从淀粉中水解获得的,会导致血糖升高[35]。己糖激酶(hexokinase,HK)、葡萄糖激酶(glucokinase,GCK)、葡萄糖6-磷酸酶(glucose 6-phosphatase,G6PD)、丙酮酸激酶(pyruvate kinase,PK)等酶是糖代谢关键酶。HK和GCK是糖代谢中的关键酶,催化葡萄糖转化为6-磷酸葡萄糖,促使肝糖原的合成。G6PD是肝脏糖异生的关键酶,催化6-磷酸葡萄糖转化为葡萄糖[19]。PK是糖酵解关键限速酶。大量数据证明T2DM患者体内葡萄糖激酶活性低,导致血糖稳态失衡,植物多糖可以通过调节相关酶活性改善糖代谢,进而控制血糖含量。桑叶多糖通过增加肝糖原含量和肝脏GCK活性显著改善了糖尿病大鼠的肝脏脂质代谢和糖代谢功能,改善IR[36]。
2.4 抗炎作用
研究表明植物多糖可以通过抑制炎症因子的表达来抗炎,从而防止β细胞功能受损,进而降低血糖水平[7]。QIAO等[37]发现五味子酸性多糖改善IR的机制为抑制炎症作用,即降低IL-1β、IL-6、TNF-α、C反应蛋白和NF-κB水平及其在肝组织中的mRNA表达,抑制磷酸化JNK和NF-κB蛋白的表达,显著增加了磷酸化胰岛素受体底物-1、磷酸化磷脂酰肌醇3激酶和磷酸化蛋白激酶B蛋白的表达。
2.5 提高抗氧化应激能力
糖尿病患者体内会产生大量ROS,胰岛细胞抗氧化应激能力低,不能维持氧化还原平衡,导致β细胞损伤、脂质和葡萄糖的代谢异常,长期的高脂饮食加重了抗氧化系统的负担。ZHANG等[23]报道轮叶党参多糖通过激活抗氧化信号通路改善了高脂饮食诱导的IR,改善蛋白激酶B(protein kinase B,PKB)/AKT的磷酸化受损和Ser307处IRS-1的高磷酸化,显著降低丙二醛水平和谷胱甘肽/氧化谷胱甘肽比率,增强抗氧化酶的表达,并激活核转录因子NF-E2相关因子2(nuclear factor erythroid 2 related factor 2,Nrf2)信号通路。燕麦β-葡聚糖复合物改善糖尿病可能通过提高糖尿病大鼠的机体抗氧化能力,清除体内自由基,预防和减少糖尿病并发症的发生[24]。铁皮石斛粗多糖通过显著提高四氧嘧啶模型小鼠肝脏和胰腺的抗氧化能力(总抗氧化能力、超氧化物歧化酶、过氧化氢酶),修复了肝脏和胰腺氧化损伤[38]。CHEN等[39]采用灰兜巴粗多糖和纯化多糖进行体外和动物试验,证明多糖通过抗氧化应激、抑制α-葡萄糖苷酶活性和改善IR降低血糖,且低分子质量纯化多糖降血糖活性显著高于粗多糖,表明多糖结构会影响活性,可通过分离纯化来提高多糖抗氧化和降血糖活性。
2.6 调节相关信号通路
胰岛素作用于细胞膜表面的胰岛素受体后主要通过PI3K/AKT途径及丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)途径来控制细胞生理活动。上调PI3K/AKT途径中关键分子的mRNA及相关信号蛋白的表达有助于改善β细胞功能,调节血糖水平[40]。SU等[25]报道乌头多糖对高脂饮食诱导糖尿病小鼠降血糖的潜在机理为增加胰岛素敏感性,改善葡萄糖耐受性,抑制血清和胰岛素靶组织中的炎症因子表达,抑制NF-κB细胞通路的激活来降低IRS-1的丝氨酸磷酸化,从而通过PI3K/AKT信号通路恢复葡萄糖的利用。猴头菇多糖体内降血糖试验发现其降血糖机制主要通过PI3K/AKT信号通路,积极介导糖原合成[41]。
MAPK转导通路包括细胞外信号调节激酶(extracellular signal regulated kinase 1/2,ERK1/2)、JNK 1/2/3、p38和ERK5通路,介导细胞增殖、分化、凋亡、炎症及免疫等一系列活动[42]。研究发现多种细胞因子及应激刺激都可通过一条或多条MAPK信号转导通路诱导β细胞凋亡,因此植物多糖可以通过调节MAPK信号通路,抑制β细胞凋亡。刺糖多糖能上调小鼠巨噬细胞p38、NF-κB、p65、ERK1/2蛋白的磷酸化水平,从而激活MAPK和NF-κB信号通路,提高免疫力,抑制糖尿病发生[43]。
蛋白激酶C(protein kinase C,PKC)作为一种多功能酶在基因表达和调控中起作用。作为诱导因子,高葡萄糖可促进PKC活化,从而激活NF-κB通路,导致炎症和糖尿病大鼠脂质代谢异常[44]。LI等[45]报道牛蒡多糖通过PKC/NF-κB路径调节糖尿病大鼠的脂质代谢,降低总胆固醇、TG、低密度脂蛋白胆固醇含量。
Nrf2在抗氧化应激与抗炎中具有重要作用,能抑制IR。缺失Nrf2时,会导致胰岛β细胞损伤。太子参多糖通过激活Nrf2信号通路减轻氧化应激反应,抑制肝脏炎性信号激活,并提高肠道有益菌群丰度来改善IR[46]。
2.7 调节肠道菌群
大量研究发现肠道菌群可能通过参与胆汁酸代谢、短链脂肪酸代谢、炎症反应等途径影响了机体的代谢[47]。肠道菌群失调导致IR,植物多糖可以通过调节肠道菌群来降血糖。罗布麻叶多糖通过增加Odoribacter属、厌氧支原体属、副萨特菌属和Muribaculum属的丰度,减少肠球菌属、克雷伯氏菌属和气球菌属的丰度来逆转糖尿病小鼠的肠道菌群失调[26]。SHANG等[48]以中高低剂量的冬虫夏草纯化多糖(Cordyceps militaris polysaccharides,CBPS-II)喂养糖尿病小鼠,证实CBPS-II具有调节糖尿病引起的能量代谢、肠道菌群和脂质代谢紊乱的作用。血清中的几种代谢产物被鉴定为潜在的生物标志物,为糖尿病的早期诊断和治疗提供了有用的信息。WANG等[49]研究发现自发性T2DM小鼠口服刺梨多糖能达到降血糖和降血脂的作用,其机制主要为可显著下调与糖异生和脂肪合成有关的G6PD、脂肪酸合成酶、乙酰辅酶A羟化酶1、固醇调节元件结合蛋白-1c和过氧化物酶体增殖物激活受体γ mRNA的高表达水平,降低糖尿病小鼠肠道中厚壁菌门/拟杆菌门的比值,提高了糖尿病小鼠肠道中有益菌的丰度,降低有害菌的丰度。
3 总结与展望
糖尿病是一种复杂的慢性疾病,长期的糖尿病会引发多种并发症,威胁人体健康。至今尚未完全清楚T2DM的发病机理,也没有彻底根治的药物,目前临床降糖药物胰岛素增敏剂和糖苷酶抑制剂类的长期使用会带来一定的毒副作用。植物多糖优越的生物功能将在医药领域有着极大的发展前景,其多靶点、多层面的降血糖机制有待深入研究,这些研究将为多糖新药的开发提供理论依据。
植物多糖分离、纯化工作繁琐,结构复杂,多糖的研究水平远落后于其药理价值。主要有以下问题亟待解决:(1)多糖的结构决定活性,而现阶段高纯度、高均一性多糖提取困难,多糖结构的研究大多停留在一级结构,导致构效研究缺乏,且主要集中在粗多糖降血糖机制的研究上。(2)不同提取方法得到的多糖降血糖活性存在差异,鲜少有对同种植物不同提取方法得到的多糖进行活性对比研究。(3)植物多糖大多存在多水平、多途径的降血糖机制,目前对降血糖机制的研究仍不够透彻。(4)进行动物试验时,对量效关系的研究较缺乏。(5)药理临床试验较为缺乏。(6)有关植物多糖对糖尿病并发症的研究不足。
因此未来应深入研究多糖高级结构,提高其生物活性,完善纯化多糖降血糖多机制的研究,验证动物试验和临床试验之间结果是否一致,进一步研究多糖对糖尿病并发症的影响,同时,研发高效低成本提取植物多糖的技术,以便开发出新型长效天然植物多糖降血糖药物,为糖尿病患者带来新转机。
[1] 汪磊. 刺梨多糖的分离纯化、降血糖作用及其对肠道微生态的影响[D].广州:华南理工大学, 2019.
WANG L.Isolation, purification and hypoglycemic activity of polysaccharides from Rosa roxburghii Tratt fruit and their effect on gut microflora[D].Guangzhou:South China University of Technology, 2019.
[2] 中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2017年版)[J].中国实用内科杂志, 2018, 38(4):292-344.
Chinese Diabetes Society.Guidelines for the prevention and control of type 2 diabetes in China (2017 edition)[J].Chinese Journal of Practical Internal Medicine, 2018, 38(4):292-344.
[3] CHO N H, SHAW J E, KARURANGA S, et al.IDF Diabetes Atlas:Global estimates of diabetes prevalence for 2017 and projections for 2045[J].Diabetes Research and Clinical Practice, 2018, 138:271-281.
[4] CHEN H, NIE Q, HU J, et al.Hypoglycemic and hypolipidemic effects of glucomannan extracted from konjac on type 2 diabetic rats[J].Journal of Agricultural and Food Chemistry, 2019, 67(18):5 278-5 288.
[5] ZHOU M G, WANG H D, ZENG X Y, et al.Mortality, morbidity, and risk factors in China and its provinces, 1990-2017:A systematic analysis for the global burden of disease study 2017[J].The Lancet, 2019, 394(10 204):1 145-1 158.
[6] 孟庆龙, 金莎, 刘雅婧, 等.植物多糖药理功效研究进展[J].食品工业科技, 2020, 41(11):335-341.
MENG Q L, JIN S, LIU Y J, et al.Research progress in pharmacological efficacy of plant polysaccharides[J].Food Industry Technology, 2020, 41(11):335-341.
[7] 肖瑞希, 陈华国, 周欣.植物多糖降血糖作用及机制研究进展[J].食品科学, 2019, 40(11):254-260.
XIAO R X, CHEN H G, ZHOU X.Recent progress in understanding of hypoglycemic effect and underlying mechanism of plant polysaccharides[J].Food Science, 2019, 40(11):254-260.
[8] DURRUTY P,MARIA S,SANHUEZA L.Pathogenesis of Type 2 Diabetes Mellitus[M].London:IntechOpen, 2019:1-18.
[9] 张旭东, 张雷.胰岛素抵抗与2型糖尿病[J].解剖科学进展, 2008,14(1):92-95.
ZHANG X D, ZHANG L.Relationship of type 2 diabetes mellitus with insulin resistance[J].Progress of Anatomical Sciences, 2008,14(1):92-95.
[10] ZHOU Y D, ZHANG E M, CHRISTINE B, et al.Survival of pancreatic beta cells is partly controlled by a TCF7L2-p53-p53INP1-dependent pathway[J].Human Molecular Genetics, 2012, 21(1):196-207.
[11] MALONE J I, HANSEN B C.Does obesity cause type 2 diabetes mellitus (T2DM)? Or is it the opposite?[J].Pediatric Diabetes, 2019, 20(1):5-9.
[12] 杨永青, 杨明庆.肥胖诱发胰岛素抵抗的炎性机制[J].中国生物化学与分子生物学报, 2012, 28(8):692-699.
YANG Y Q, YANG M Q.Inflammatory mechanisms in obesity-induced insulin resistance[J].Chinese Journal of Biochemistry and Molecular Biology, 2012, 28(8):692-699.
[13] 彭伟霞, 俞茂华.老年糖尿病[J].国外医学(内科学分册), 2004(7):296-299.
PENG W X, YU M H.Senile diabetes[J].International Journal of Internal Medicine, 2004(7):296-299.
[14] SCHMITZ N, DESCHENES S S, BURNS R J, et al.Depression and risk of type 2 diabetes:The potential role of metabolic factors[J].Molecular Psychiatry, 2016, 21(12):1 726-1 732.
[15] LINA R, RYTAS O.Adding salt to meals as a risk factor of type 2 diabetes mellitus:A case-control study[J].Nutrients, 2017, 9(1):67.
[16] 丁静云, 梁真.葡萄糖毒性对胰岛β细胞功能影响的研究进展[J].深圳中西医结合杂志, 2015, 25(17):197-199.
DING J Y, LIANG Z.Recent studies of glucotoxicity of pancreas islet β cell function[J].Shenzhen Journal of Integrated Traditional Chinese and Western Medicine, 2015, 25(17):197-199.
[17] 周和超, 黄贵心.脂毒性与胰岛素抵抗的相关研究进展[J].国外医学(老年医学分册), 2007(1):28-32.
ZHOU H C, HUANG G X.Research progress on the relationship between lipotoxicity and insulin resistance[J].International Journal of Geriatrics, 2007(1):28-32.
[18] LI Y, LI S, HE S L, et al. Structural analysis and antidiabetic activity study of three acidic-type polysaccharides from Crepis crocea (Lam.) Babc[J].Natural Product Research, 2020(22):1-6.
[19] 丁婷, 杨建华, 路新卫, 等.桃胶粗多糖对糖尿病小鼠免疫调节和血糖影响初探[J].食品工业, 2009, 30(6):7-9.
DING T, YANG J H, LU X W, et al.Investigation on the effect of blood-glucose level and immunity in diabetic mice by taking peach resin[J].The Food Industry, 2009, 30(6):7-9.
[20] 唐思梦, 杨泽民, 陈伟强, 等.黄芪多糖保护胰岛β细胞改善大鼠2型糖尿病[J].第二军医大学学报, 2017, 38(4):482-487.
TANG S M, YANG Z M,CHEN W Q, et al.Astragalus polysaccharide improves type 2 diabetes mellitus in rats by protecting islet β cells[J].Academic Journal of Second Military Medical University, 2017, 38(4):482-487.
[21] YANG S, QU Y, ZHANG H, et al.Hypoglycemic effects of polysaccharides from Gomphidiaceae rutilus fruiting bodies and their mechanisms[J].Food & Function, 2020, 11(1):424-434.
[22] SHAO T, YUAN P, ZHU L, et al.Carbon nanoparticles inhibit A-glucosidase activity and induce a hypoglycemic effect in diabetic mice[J].Molecules, 2019, 24(18):3 257-3 266.
[23] ZHANG Y, WANG H, ZHANG L, et al.Codonopsis lanceolata polysaccharide CLPS alleviates high fat/high sucrose diet-induced insulin resistance via anti-oxidative stress[J].International Journal of Biological Macromolecules, 2020, 145:944-949.
[24] 刘振宇, 邹圣灿.燕麦β-葡聚糖复合物改善II型糖尿病大鼠症状及作用机制研究[J].轻工科技, 2020, 36(5):107-110.
LIU Z Y, ZOU S C.Oat β-glucan complex improves the symptoms of type 2 diabetes mellitus rats and its mechanism of action[J].Light Industry Science and Technology, 2020, 36(5):107-110.
[25] SU J, LIU X, LI H, et al.Hypoglycaemic effect and mechanism of an RG-II type polysaccharide purified from Aconitum coreanum in diet-induced obese mice[J].International Journal of Biological Macromolecules, 2020, 149:359-370.
[26] YUAN Y, ZHOU J, ZHENG Y, et al.Beneficial effects of polysaccharide-rich extracts from Apocynum venetum leaves on hypoglycemic and gut microbiota in type 2 diabetic mice[J].Biomed Pharmacother, 2020, 127:110 182.
[27] 李爱云, 杨京, 张昕宇, 等.小檗碱治疗2型糖尿病降血糖机制的研究进展[J].中国实验方剂学杂志, 2019, 25(22):219-226.
LI A Y, YANG J, ZHANG X Y, et al.Research progress on effect of hypoglycemic mechanism of berberine in treatment of type 2 diabetes mellitus[J].Chinese Journal of Experimental Traditional Medical Formulae, 2019, 25(22):219-226.
[28] 高攀攀, 李盼盼, 蔡晓萌.黄芪多糖通过PI3K/Akt途径抑制小鼠胰岛βTC-6细胞凋亡的机制研究[J].营养学报, 2019, 41(3):265-269.
GAO P P, LI P P, CAI X M.Inhibition of apoptosis though PI3K/Akt pathway by βTC-6 cells astragalus polysaccharides in pancreatic[J].Acta Nutrimenta Sinica, 2019, 41(3):265-269.
[29] 杨光. 多花黄精多糖对GLP-1分泌与表达的调节及其分子机制研究[D].合肥:合肥工业大学, 2018.
YANG G.The effect of Polygonatum cyrtonema Hua polysaccharides (PCP) on the expression and secretion of GLP-1 and its molecular mechanism[D].Hefei:Hefei University of Technology, 2018.
[30] 李跃松, 王静, 潘凌峰, 等.胰岛素抵抗与血尿酸、空腹血糖和血脂代谢关系的分析[J].现代预防医学, 2012, 39(22):5 951-5 953;5 959.
LI Y S, WANG J, PAN L F, et al.Study on the association among insulin resistance, serum uric acid, fasting blood glucose and lipids metabolism[J].Modern Preventive Medicine, 2012, 39(22):5 951-5 953;5 959.
[31] CHEN Y, LIU D, WANG D, et al. Hypoglycemic activity and gut microbiota regulation of a novel polysaccharide from Grifola frondosa in type 2 diabetic mice[J].Food and Chemical Toxicology, 2019, 126:295-302.
[32] SHAN X, LIU X, HAO J, et al. In vitro and in vivo hypoglycemic effects of brown algal fucoidans[J].Int J Biol Macromol, 2016, 82:249-255.
[33] TASLIMI P, GULCIN I.Antidiabetic potential:In vitro inhibition effects of some natural phenolic compounds on α-glycosidase and α-amylase enzymes[J].Journal of Biochemical and Molecular Toxicology, 2017, 31(10):e21 956.
[34] DAUB C D, MABATE B, MALGAS S, et al.Fucoidan from Ecklonia maxima is a powerful inhibitor of the diabetes-related enzyme, alpha-glucosidase[J].International Journal of Biological Macromolecules, 2020, 151:412-420.
[35] HUANG Z, LIN F, ZHU X, et al.An exopolysaccharide from Lactobacillus plantarum H31 in pickled cabbage inhibits pancreas alpha-amylase and regulating metabolic markers in HepG2 cells by AMPK/PI3K/Akt pathway[J].International Journal of Biological Macromolecules, 2020, 143:775-784.
[36] 路国兵, 任春久, 崔为正, 等.桑叶多糖MLPⅡ对糖尿病模型大鼠肝脏胰岛素抵抗的改善作用[J].蚕业科学, 2012, 38(1):116-121.
LU G B, REN C J, CUI W Z, et al.Improvement effect of polysaccharide MLPⅡ from mulberry leaves on hepatic insulin resistance in diabetic model rat[J].Science of Sericulture, 2012, 38(1):116-121.
[37] QIAO Z, DU X, ZHUANG W, et al.Schisandra chinensis acidic polysaccharide improves the insulin resistance in type 2 diabetic rats by inhibiting inflammation[J].Journal of Medicinal Food, 2020, 23(4):358-366.
[38] 王云威, 王景雪.铁皮石斛多糖对2型糖尿病小鼠降糖降脂的作用[J].食品科学, 2020,41(21):127-132.
WANG Y W, WANG J X.Effect of Dendrobium officinale polysaccharide on hypoglycemic and lipid-lowering effects in type 2 diabetic mice[J].Food Science, 2020,41(21):127-132.
[39] CHEN J, LI L, ZHOU X, et al. Preliminary characterization and antioxidant and hypoglycemic activities in vivo of polysaccharides from Huidouba[J].Food & Function, 2018, 9(12):6 337-6 348.
[40] 宋紫临, 吴丽丽, 秦灵灵, 等.PI3K/AKT信号通路与糖尿病的研究进展[J].世界科学技术-中医药现代化, 2019, 21(6):1 264-1 269.
SONG Z L, WU L L, QIN L L, et al.Research progress of PI3K/AKT signaling pathway and diabetes mellitus[J].Modernization of Traditional Chinese Medicine and Materia Medica-World Science and Technology, 2019, 21(6):1 264-1 269.
[41] CAI W D, DING Z C, WANG Y Y, et al.Hypoglycemic benefit and potential mechanism of a polysaccharide from Hericium erinaceus in streptozotoxin-induced diabetic rats[J].Process Biochemistry, 2020, 88:180-188.
[42] PETI W, PAGE R.Molecular basis of MAP kinase regulation[J].Protein Science, 2013, 22(12):1 698-1 710.
[43] 向阳, 杨晨晨, 韩曾娇, 等.刺糖多糖对小鼠腹腔巨噬细胞核转录因子、丝裂原活化蛋白激酶及氨基末端激酶信号通路相关基因和蛋白表达的影响[J].新乡医学院学报, 2019, 36(8):706-714.
XIANG Y, YANG C C, HAN C J, et al.Effect of polysaccharide from Saccharum alhagi on the expression of nuclear transcription factor-κB, mitogen-activated protein kinase and c-Jun N-terminal kinase signal pathway related genes and proteins in peritoneal macrophages of mice[J].Journal of Xinxiang Medical University, 2019, 36(8):706-714.
[44] SHUKLA R, BANERJEE S, TRIPATHI Y B.Pueraria tuberosa extract inhibits iNOS and IL-6 through suppression of PKC-alpha and NF-κB pathway in diabetes-induced nephropathy[J].The Journal of pharmacy and pharmacology, 2018, 70(8):1 102-1 112.
[45] LI X, ZHAO Z, KUANG P, et al. Regulation of lipid metabolism in diabetic rats by Arctium lappa L.polysaccharide through the PKC/NF-kappaB pathway[J].International Journal of Biological Macromolecules, 2019, 136:115-122.
[46] 王琪. 太子参多糖通过Nrf2分子途径改善肝脏胰岛素抵抗机制研究[D].西宁:青海大学, 2015.
WANG Q.Mechanism of Radix pseudostellariae polysaccharide through the Nrf2 pathway to improve hepatic insulin resistance[D].Xining:Qinghai University, 2015.
[47] 贺云, 杨丽霞, 邱连利.从肠道微生态角度探讨2型糖尿病的发病机制以及治疗措施[J].中国实验方剂学杂志, 2020, 26(15):229-234.
HE Y, YANG L X, QIU L L.Discussion on pathogenesis and treatment of type 2 diabetes from perspective of intestinal microecology[J].Chinese Journal of Experimental Traditional Medical Formulae, 2020, 26(15):229-234.
[48] SHANG X L, PAN L C, TANG Y, et al.1H NMR-based metabonomics of the hypoglycemic effect of polysaccharides from Cordyceps militaris on streptozotocin-induced diabetes in mice[J].Natural Product Research, 2020, 34(10):1 366-1 372.
[49] WANG L, LI C, HUANG Q, et al.Polysaccharide from Rosa roxburghii Tratt fruit attenuates hyperglycemia and hyperlipidemia and regulates colon microbiota in diabetic db/db mice[J].Journal of Agricultural and Food Chemistry, 2020, 68(1):147-159.