植物黏液质是存在植物薄壁组织的黏液细胞内的结构复杂的多糖和蛋白的复合物[1],具有抗炎、抗菌、有助于伤口愈合[2]等功效,在水中溶解形成网状胶质结构,具有独特的流变特性[3],可用于制备蔬菜水果保鲜的可食性膜[4]或保鲜乳液[5]。山药中含有大量黏液,主要含有多糖、蛋白质和氨基酸[6],具有清除自由基和抗氧化作用[7]、抗高血压[8]、调节肠道功能[9]、增强免疫[10] 等多重功效,并且具有较好的乳化性质和良好的稳定性[6]。
随着生活节奏的加快,鲜切果蔬因其方便、健康、新鲜的特点,市场需求量迅速增加,而鲜切马铃薯是鲜切果蔬产业中重要的产品。然而,鲜切马铃薯在贮藏过程中容易发生表面褐变,影响产品的外观、营养和食用安全,并缩短产品货架期,制约了马铃薯加工业的发展[11]。因此,在马铃薯工业加工中防止马铃薯表面褐变、提高鲜切马铃薯色泽和品质具有重要的理论意义和商业价值[12-13]。近年来,可食性植物乳液涂膜的研究为鲜切果蔬的保鲜提供了一种新的思路,如仙人掌黏液[14]、马齿苋提取物[15]、生姜提取液[16]等都被用于鲜切马铃薯的保鲜。铁棍山药是山药中的一种优良品种,近年来深受消费者喜爱,其加工产品也日益增加。为了挖掘铁棍山药加工废料的再利用价值,本文从铁棍山药中分离提取得到了山药黏液作为基质进行鲜切马铃薯的涂膜保鲜研究。为了进一步增强膜的性能,提高保鲜效果,将山药黏液与增塑剂山梨醇及VC复配制备保鲜乳液,通过对马铃薯在贮藏过程中色差值、失重率、还原糖积累等指标对山药黏液复合乳液的制备进行优化;最后,通过多酚氧化酶(polyphenol oxidase,PPO)、过氧化物酶(peroxidase,POD)、苯丙氨酸解氨酶(phenylalnine ammonialyase,PAL)活力以及总酚含量和丙二醛(malondialdehyde,MDA)含量等指标,探讨山药黏液复配乳液对鲜切马铃薯的抗褐变作用机制,为挖掘铁棍山药的附加值和开发天然可食性食品保鲜剂提供参考。
1 材料与方法
1.1 材料与试剂
铁棍山药,购于南京苏果超市,产地河南焦作。
无水乙醇、葡萄糖、3,5-二硝基水杨酸、氢氧化钠、酒石酸钾钠、苯酚、丙三醇、无水亚硫酸钠、亚硫酸钠、山梨醇、D-抗坏血酸、冰醋酸、无水醋酸钠、邻苯二酚、愈创木酚、过氧化氢、硼酸、四硼酸钠、L-苯丙氨酸、没食子酸、碳酸钠、福林酚、三氯乙酸、石英砂、2-硫代巴比妥酸等,均为分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
Milli-Q Academic超纯水系统,美国Millipore公司;Allegra 64R高速冷冻离心机,美国贝克曼公司;GM 200刀式研磨仪,德国RETSCH(莱驰)公司;ltra Scan Pro1166 色度仪,美国 Hunter Lab 公司;Nano-ZS90纳米粒度及ZETA电位仪,英国马尔文公司;U-3900 紫外分光光度计,日本日立集团;FD-STD冷冻干燥机,美国Labconco公司。
1.3 实验方法
1.3.1 山药黏液的提取
山药黏液质的提取参照ANDRADE等[17]的方法。将铁棍山药洗净后去皮切块,以10 g/L的 Na2SO3浸泡1 h进行护色处理后研磨打浆。在料水比1∶1, 温度50 ℃、pH 8的条件下浸提1 h。浸提后的滤液在5 000 r/min条件下离心10 min,上清液经真空冷冻干燥后得到白色粉末,参考GB/T 5009.34—2003《食品中亚硫酸盐的测定法》对山药黏液冻干粉中的Na2SO3含量进行测定,其残留量为0.68 mg/kg,pH为7.82。冻干粉置于干燥器中保存待用。
1.3.2 山药黏液保鲜乳液的制备与对鲜切马铃薯的涂膜处理
山药黏液保鲜乳液的制备:参照DICK等[18]的方法,将丙三醇的添加量设为0.5%(体积分数),具体制备方法如下:取一定量的山药乳液,溶于超纯水中,并加入0.5%(体积分数)丙三醇,配制0.5%、1%、1.5%、2%(体积分数)的山药黏液;以失重率和色差为考核指标得到最优山药黏液浓度的乳液(A);随后选用最优山药黏液浓度与0.05%、0.25%、0.75%、1%、2%(质量分数)山梨醇溶液复配;再将优化后乳液(B)的配方分别与0.01%、0.02%、0.03%、0.04%(质量分数)的VC复配,通过相关指标的测定确定鲜切马铃薯保鲜乳液的最佳复配比。
保鲜处理:将马铃薯清洗后,削皮,切成2 cm×2 cm×0.5 cm的块状。随机选取鲜切马铃薯片进行分组,并选取其中一组作为对照组,以去离子水处理;其余组别分别采用相应的山药黏液保鲜乳液进行涂膜处理。处理后将马铃薯放入大托盘内,并用保鲜膜封住托盘表面,在常温(25 ℃)下放置6 d,每天取样测定各项指标。
1.3.3 测定指标与方法
(1)色度
利用色度仪,每24 h取样分别测其色度变化,每个试验条件均重复3次,取平均值作为实验结果,结果以L值表示。
(2)失重率
采用称量法,每24 h取样称重,每个处理组每次随机取3片,计算失重率,取平均值作为实验结果。
(3)还原糖
马铃薯样品20 g,加85%(体积分数)乙醇50 mL,在组织捣碎机中捣碎,于80 ℃水浴中提取20 min,然后离心10 min,取1 mL稀释100倍后加入3,5-二硝基水杨酸(DNS)工作液1 mL,水浴加热至沸腾5 min后用蒸馏水稀释10倍,在530 nm波长下测定其吸光度值。以葡萄糖标准溶液绘制标准曲线,计算鲜切马铃薯中还原糖含量。
(4)多酚氧化酶活性
采用ZAMBRANO-ZARAGOZA等[19]的研究方法,将2 g切碎的鲜切马铃薯片与5 mL乙酸-乙酸钠缓冲液(0.1 mol/L,pH 5.5)混合并且快速研磨成匀浆后,在10 000×g,4 ℃条件下离心20 min后,取100 μL上清液,4 mL乙酸-乙酸钠缓冲液(0.05 mol/L,pH 5.5)与1 mL邻苯二酚溶液(0.05 mol/L)快速混合,立即在420 nm下测量吸光度值。PPO酶活以鲜重表示。新鲜样品重量的PPO活性的表达为U/g。
(5)过氧化物酶活性
参照LIU等[13]的方法,具体如下:将2 g切碎的鲜切马铃薯片与5 mL乙酸-乙酸钠缓冲液(0.1 mol/L,pH 5.5)混合并且快速研磨成匀浆后,在10 000×g,4 ℃条件下离心20 min,将0.5 mL上清液和5 mL愈创木酚溶液(0.025 mol/L)混合,并迅速加入0.2 mL H2O2溶液(0.5 mol/L),然后立即在470 nm下测量吸光度值。新鲜样品重量的POD活性表达为U/g。
(6)苯丙氨酸解氨酶活性
采用ASSIS等[20]测定PAL活性,具体如下:将1 g切碎的新鲜马铃薯片和5 mL硼酸缓冲液(pH 8.8,0.05 mol/L)研磨成匀浆,将混合物在10 000×g,4 ℃ 条件下离心20 min,将3 mL硼酸缓冲液(pH 8.8,0.05 mol/L)和0.5 mL L-苯丙氨酸(0.02 mol/L)混合并提前在37 ℃水浴10 min后,将0.5 mL上清液快速加入,立即在290 nm处测量初始吸光度值。将混合物在37 ℃下水浴60 min,再次测量290 nm 处的吸光度值。新鲜样品重量的PAL活性表达为U/(g·h)。
(7)总酚含量
参考PICCOLELLA等[21]的方法测定总酚含量,具体如下:将2 g切碎的鲜切马铃薯片和5 mL 60%乙醇研磨成匀浆,将混合物以10 000×g,4 ℃离心20 min。然后将0.25 mL上清液、5 mL蒸馏水、0.80 mL 200 g/L的 Na2CO3溶液和0.25 mL福林酚试剂在25 mL 容量瓶中充分混合。避光反应30 min后,在760 nm处测量吸光度值。总酚含量以每克样品中所含的没食子酸当量表示,单位为mg/g。
(8)丙二醛含量
参考LIU等[13]的研究方法进行MDA含量的测定,具体如下:将2 g新鲜的马铃薯,4 mL 10%(体积分数)三氯乙酸混合,并和少许石英砂一起研磨成匀浆,在10 000×g,4 ℃离心20 min。将3 mL上清液和3 mL 2-硫代巴比妥酸溶液(0.6%,质量分数)混合。然后将混合物煮沸15 min,冷却至室温后,将混合物以10 000×g,4 ℃离心15 min。在450、532和600 nm处测量上清液的吸光度。新鲜样品的MDA含量表示为。
1.3.4 山药保鲜乳液的粒径与电位测定/表征
保鲜乳液采用Zeta电位纳米粒径仪测定乳液的粒径分布和Zeta电位,测定温度为25 ℃,分散剂为蒸馏水。每24 h测定1次,每个试验条件重复3次,结果取平均值。
1.4 数据分析
采用Origin 2018进行数据处理;IBM SPSS 9的多重比较法进行差异显著性分析。当P<0.05表示具有显著性差异。
2 结果与分析
2.1 铁棍山药黏液复配乳液的优化
2.1.1 山药黏液浓度对鲜切马铃薯保鲜效果的影响
配制不同浓度的山药黏液,分别选用0.5%、1%、1.5%和2%的山药黏液进行涂膜保鲜,以色度值和失重率进行保鲜效果的初步判定,结果如图1所示。由图1-A可知,随着时间的变化,鲜切马铃薯的L值呈现降低的趋势,并且在贮藏的前3天L值下降较快,但是降低趋势较缓。空白对照组的鲜切马铃薯,L值下降的趋势比较明显,褐变程度较大,在保鲜第6天L降低至45.01。而经过山药涂膜处理后,随着保存时间的加长,鲜切马铃薯的L值也有所下降,但是其下降趋势与空白对照组相比显著减缓,而经过1%山药黏液处理的实验组的色度值的变化程度最小,与对照组具有显著差异(P<0.05),说明铁棍山药黏液能够有效延缓马铃薯的褐变速度。
鲜切马铃薯在贮藏过程中水分和营养物质含量会不断下降造成失水,从而导致果实萎缩、失去光泽、衰老腐败。由图1-B可知,在贮藏过程中,鲜切马铃薯的失重率都呈现上升的趋势,而相同的贮藏时间内,山药黏液处理组鲜切马铃薯的失重率始终低于空白组,在第6天所有处理组的失重率均显著低于空白对照组(P<0.05),而1%山药黏液处理后其失重率增加的最为缓慢。
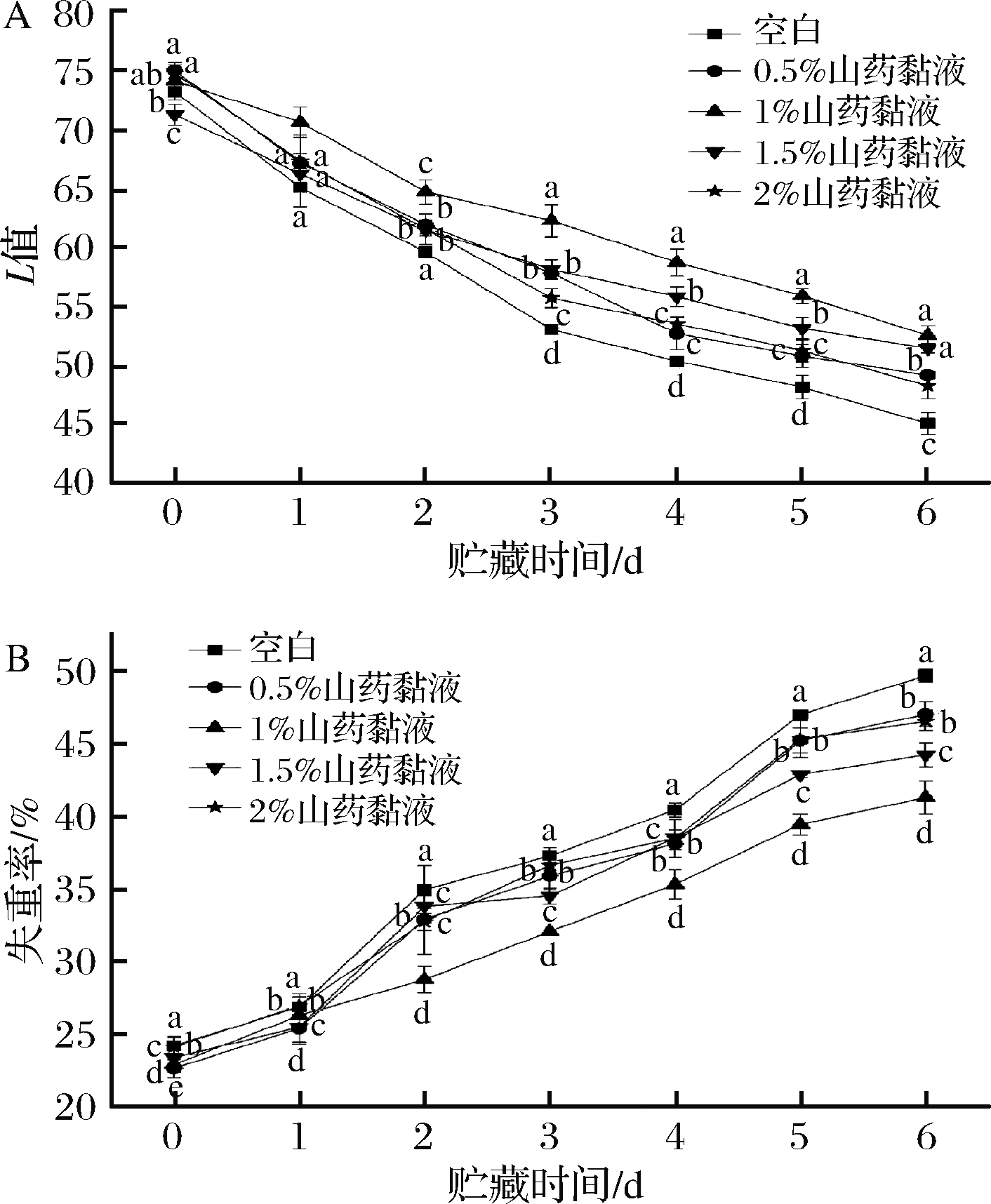
A-色差值;B-失重率
图1 山药黏液对鲜切马铃薯的色差值和失重率的影响
Fig.1 Effects of yam viscosity on the color difference and weight loss rate of fresh-cut potatoes
注:不同字母表示同一取样时间数据差异的显著性,相同字母 表示差异不显著,不同字母表示差异显著(P<0.05)(下同)
从色度值和失重率2个指标可以看出,高浓度的山药黏液对鲜切马铃薯保鲜效果低于1%山药黏液,推测色度值和重量的变化可能与细胞的脱水速度不同相关,1%山药黏液的浓度更接近马铃薯细胞液的浓度,涂覆后马铃薯表面细胞脱水速度较慢,色度值变化也较慢,因此具有较好的保鲜效果;而高浓度的山药黏液由于渗透压的影响导致细胞水分快速流失,马铃薯片表面迅速裂缩并失去光泽,因此其保鲜效果弱于1%山药黏液处理组。
2.1.2 山药黏液质与山梨醇复配乳液比例对鲜切马铃薯保鲜效果的影响
山梨醇是一种经济、安全的食品添加剂,可以嵌入高聚物内部,通过同基材大分子间形成化学键及降低分子间作用力来增加聚合物链的移动性和成膜基材的柔韧性,避免膜产生大孔和裂缝,从而增强保鲜作用[22-23]。如图2所示,在贮藏过程中,所有马铃薯L值均呈现下降趋势,加入0.75%山梨醇的山药黏液涂膜的马铃薯L值下降最慢(图2-A)。此外,各实验组的失重率随着贮藏时间的延长而呈上升趋势,山药黏液中加入0.25%以上浓度的山梨醇能够显著降低鲜切马铃薯的失重率(与1%山药黏液处理组相比,P<0.05),其中经加入0.75%山梨醇的复配乳液涂膜的马铃薯失重率最低,其保鲜效果最佳(图2-B)。
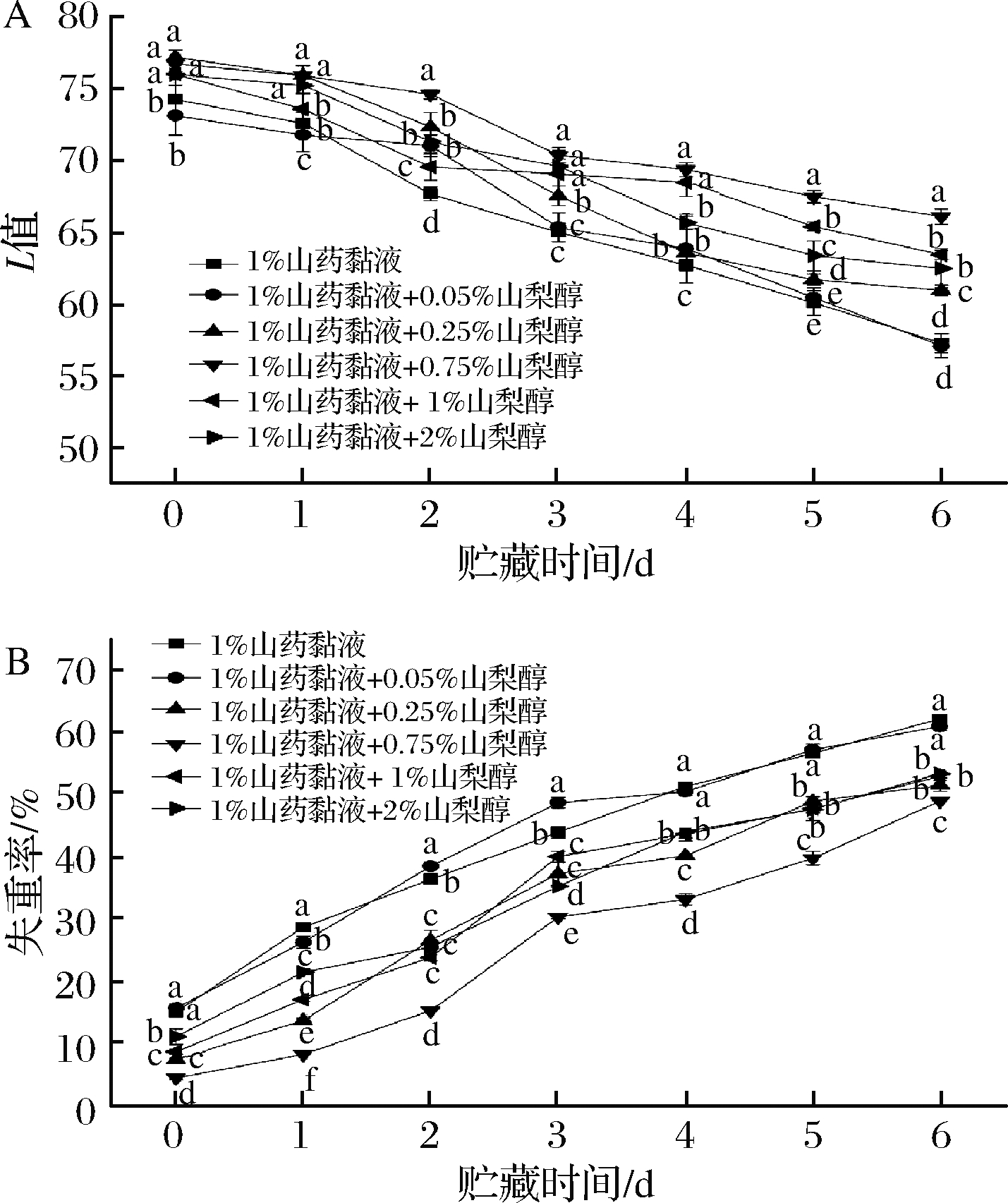
A-色差值;B-失重率
图2 山梨醇添加量对鲜切马铃薯的色差值 和失重率的影响
Fig.2 Effects of sorbitol addition on the color difference and weight loss rate of fresh-cut potatoes
2.1.3 VC添加量对鲜切马铃薯的保鲜效果的影响
VC具有较强的抗氧化性,常用于食品保鲜涂膜的添加剂。基于上述实验结果,采用1%山药黏液和0.75%山梨醇的复配乳液为基础,分别加入0.01%、0.02%、0.03%和0.04% VC后对鲜切马铃薯进行涂膜保鲜,结果如图3所示。贮藏过程中,加入0.02%经过VC的山药复合乳液处理的鲜切马铃薯褐变趋势减缓最明显,贮藏6 d L值显著高于不加VC组(P<0.05)(图3-A)。而添加0.02% VC山药乳液的鲜切马铃薯的失重率也显著降低(P<0.05),其保鲜效果最佳(图3-B)。
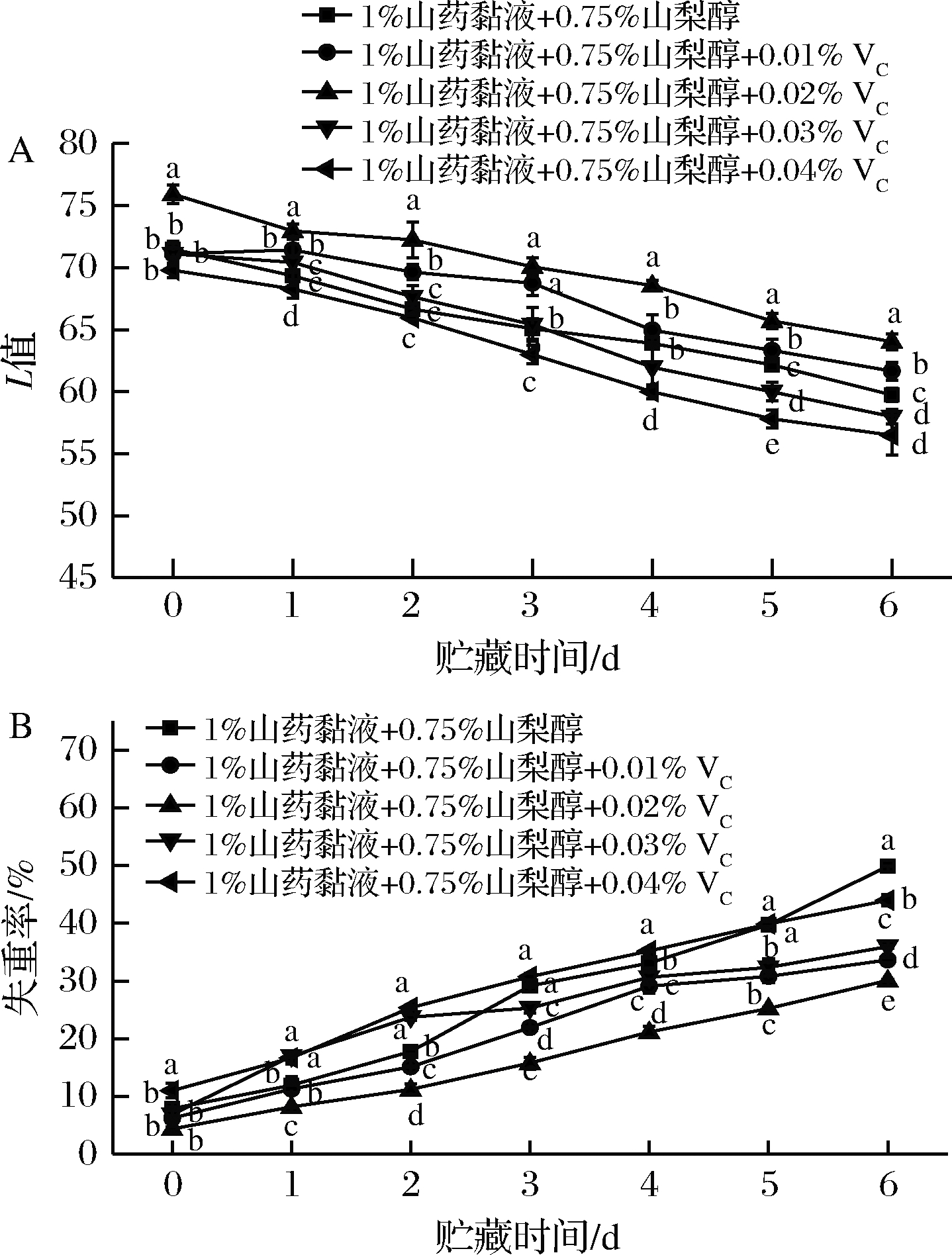

A-色差值;B-失重率;C-保鲜效果图
图3 VC添加量对鲜切马铃薯的色差值和失重率的影响
Fig.3 Effects of VC addition on the color difference and weight loss rate of fresh-cut potatoes
2.2 不同山药保鲜乳液的稳定性分析
在前面实验的基础上,通过Zeta 电位的测定和粒径的变化,对1%山药黏液、1%山药黏液+0.75%山梨醇及1%山药黏液+0.75%山梨醇+0.02%VC山药复合乳液的稳定性进行研究,结果如表1所示。
Zeta电位是乳剂稳定性的指标,如果Zeta电位的绝对值大于30,则胶体被认为是稳定的[24]。表1 给出了不同配比山药黏液复合液在室温下放置6 d的Zeta电位变化,从表1可以看出,所有乳液的初始Zeta电位值超过|±40|,在常温贮藏6 d时依然大于|±30|,表明山药黏液乳液具有较好的稳定性。对不同成分复合山药黏液在室温下放置6 d的粒径大小进行测定,发现1%山药黏液+0.75%山梨醇+0.02%VC复配制备得到的乳液液滴粒径最小,且其电位值在储藏期间变化程度最小,表明其具有较好的稳定性。
2.3 山药黏液复合乳液对鲜切马铃薯中PPO、POD、PAL活力及总酚含量的影响
为了进一步探究山药黏液复合乳液对鲜切马铃薯的保鲜效果,选择上述最优配比的复合乳液(即1%山药黏液+0.75%山梨醇+0.02%VC复配乳液)对鲜切马铃薯进行涂膜处理,进一步测定其对PPO、POD、PAL活力及总酚含量的影响,结果见图4。
表1 不同保鲜乳液在保鲜期间Zeta电位和粒径的变化
Table 1 Zeta-potential and droplet diameter of emulsions made from yam mucilage

贮藏时间/dZeta电位/mV粒径/μm1%山药黏液1%山药黏液+0.75%山梨醇1%山药黏液+0.75%山梨醇+0.02%VC1%山药黏液1%山药黏液+0.75%山梨醇1%山药黏液+0.75%山梨醇+0.02%VC0-41.1±0.23-40.2±0.67-43.1±0.061.02±0.010.89±0.040.75±0.032-33.5±0.13-39.8±0.04-42.6±0.031.16±0.010.89±0.010.75±0.024-32.7±0.13-34.2±0.34-39.5±0.011.19±0.020.88±0.010.75±0.056-30.4±0.15-33.2±0.25-38.9±0.011.20±0.020.88±0.060.75±0.04
由图4-A可知,随着贮藏时间的延长,空白对照组和山药复配液处理的鲜切马铃薯的PPO活性均呈现增加的趋势,但是山药复配液处理组从处理后第一天开始,PPO活性始终低于对照组。贮存第6天,山药复配液处理组的PPO活性显著低于对照组(P<0.05),说明山药复配液对鲜切马铃薯中PPO活性的增长具有显著抑制作用。
从图4-B可以看出,鲜切马铃薯中POD活性随贮藏时间的延长逐渐上升,但山药复配液处理组的POD活性显著低于空白对照组(P<0.05),贮藏6 d后,空白对照组和山药黏液处理组的POD活性分别为7.50和5.77 U/g,具有显著性差异(P<0.05),表明山药复配液有效减缓了鲜切马铃薯中POD活性的增加。
在贮藏期间,PAL活性呈现先上升后下降的趋势(图4-C)。在贮藏第0天时,山药复配液处理组与空白对照组无显著性差异,在第1天和第2天,对照组与处理组的PAL活力均逐渐增加,并且在第2天达到最大值,从第3天开始,PAL活性开始呈降低趋势,第6天达到最低值。总体来说,从贮藏1天后,山药复配液处理组的PAL活性始终显著低于空白对照组(P<0.05),说明山药复配液能有效抑制PAL酶的活性增长。
贮藏期间鲜切马铃薯的总酚含量也呈现先增加后降低的趋势(图4-D)。贮藏0 d和1 d时,山药复配液处理组与空白对照组的总酚含量无显著性差异,从第2天开始,处理组的总酚含量显著低于空白对照组(P<0.05)。在贮藏第4天时,总酚含量达到最大值,而在后续的贮藏过程中逐渐下降。在贮藏期间,经山药复配液处理的马铃薯的总酚含量始终显著低于空白对照组(P<0.05)。
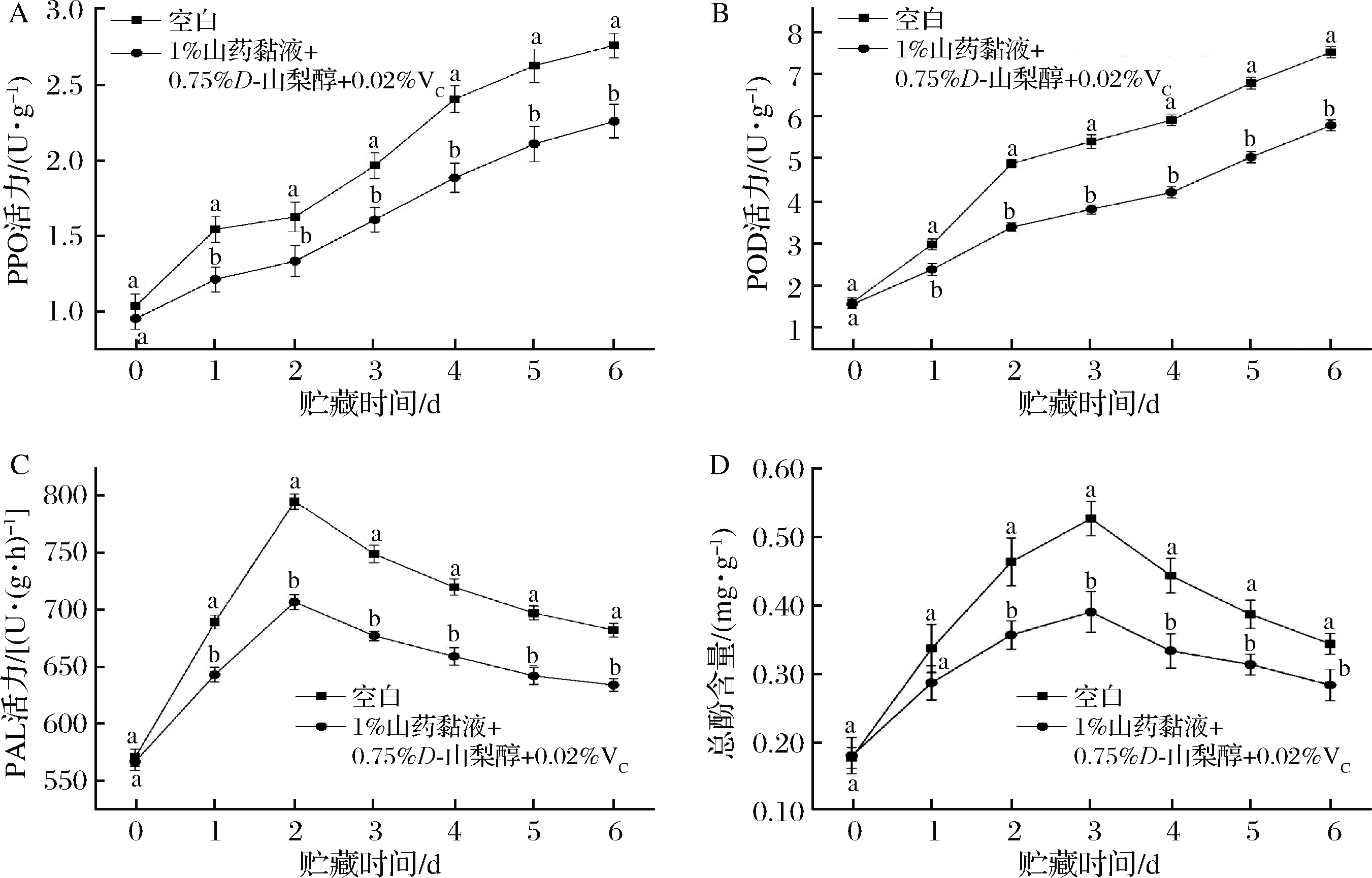
A-PPO活力;B-POD活力;C-PAL活力;D-总酚含量
图4 山药黏液复合乳液对鲜切马铃薯PPO、POD、PAL活力及总酚含量的影响
Fig.4 Effects of emulsion on PPO activity, POD activity, PAL activity and total phenol content in fresh-cut potatoes
总的来说,1%山药黏液+0.75%山梨醇+0.02%VC复配乳液涂膜处理鲜切马铃薯,能够有效降低马铃薯片中的PPO、POD和PAL活力,并且降低总酚和MDA含量,减缓褐变速率,维持马铃薯切片表面较好的色泽品质。PPO是导致鲜切马铃薯发生褐变的最主要的酶。在氧气存在的情况下,PPO将多酚类物质催化氧化为不稳定的醌,醌可以进一步聚合生成黑色物质,或络合蛋白质、氨基酸或酚类物质生成黑色色素,从而引起褐变的发生[25]。在本文的研究中,山药复配液能够减缓鲜切马铃薯中PPO活性的增长,胡泳华等[16]发现生姜提取液能有效控制鲜切马铃薯中PPO的活性,延缓马铃薯的褐变;郑科旺等[26]制备了壳聚糖乳液与柠檬精油、肉桂精油的复合涂膜能有效抑制鲜切山药中的PPO活性,使其保持较高的品质,维持较好的色泽,这些都与本研究结果一致。POD可以氧化植物体内的酚类和胺类化合物以及烃类氧化产物,具有消除过氧化氢和酚类胺类毒性的双重作用。POD与PPO在氧化酚类物质方面起着协同作用[27],本文经山药黏液处理后,POD活性的增加受到抑制,从而能够有效减缓褐变的发生。PAL是植物体内重要的防御酶,在植物受到机械损害时PAL会导致防御反应的发生,引导并参与合成多酚和木质素,从而增强植物细胞壁的强度并对病原菌有致死作用。多酚类化合物是酶促褐变的底物,其含量与褐变程度呈正相关。在本研究中,PAL和总酚含量都呈现先上升后下降的趋势,这可能是由于切片时的机械损伤导致PAL活力增加,而PAL能够诱导苯丙类化合物向酚类化合物的转化,导致总酚积累量增加[28]。从第4天开始的总酚含量下降可能是由于从第3天开始PAL酶活降低,PAL酶引导合成总酚的速率低于PPO酶对总酚的消耗速率所导致的。
2.4 山药黏液复合乳液对鲜切马铃薯中MDA含量的影响
MDA是膜脂过氧化最重要的产物之一,MDA含量能够体现膜系统的损伤程度[29]。酚类化合物的氧化与细胞膜完整性的破坏相关,马铃薯在切片后细胞膜表面受到破坏,其创面容易发生快速褐变。如图5所示,鲜切马铃薯的MDA含量在整个贮藏期间都呈上升趋势,但经山药复配液处理的实验组始终低于对照组(P<0.05),在贮藏第6天时,空白对照组的MDA含量较山药黏液处理组高15%,说明涂膜后马铃薯细胞膜的损伤程度降低,有助于减缓马铃薯的褐变速度,这与王雅等[30]的研究结果一致。
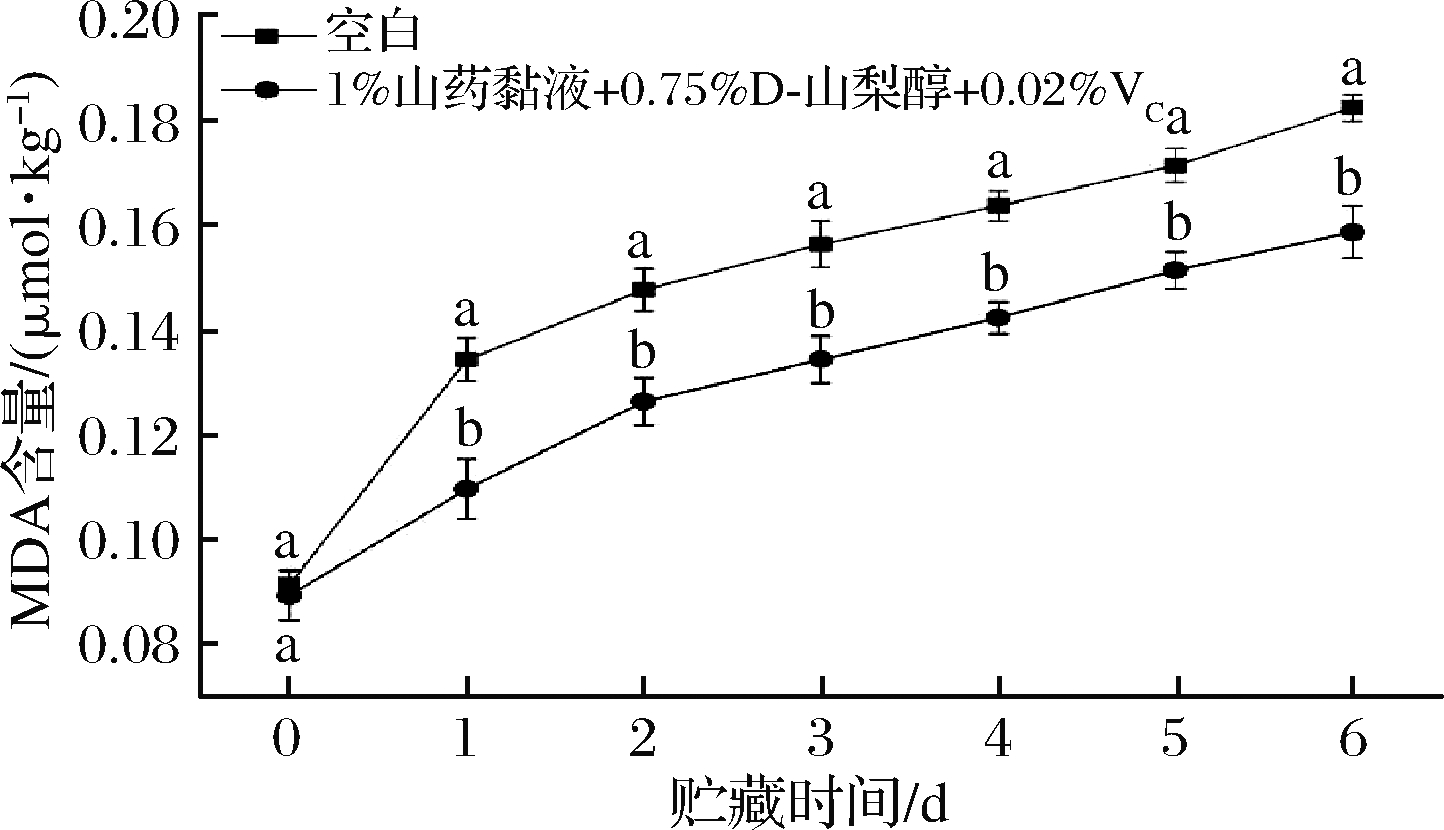
图5 山药黏液复合乳液对鲜切马铃薯MDA含量的影响
Fig.5 Effects of emulsion on MDA content in fresh-cut potatoes
2.5 山药黏液复合乳液对鲜切马铃薯中还原糖含量的影响
还原糖含量是新鲜马铃薯加工贮藏的重要指标,在保鲜过程中应尽量降低还原糖的积累量。对还原糖含量的测定分析结果如图6所示。由图6可知,在空白对照组中,随着保存时间的增加,还原糖含量急剧升高,在贮藏第6天时,空白组的还原糖含量达到12.22%。而经过最优配比的山药黏液复合乳液处理的鲜切马铃薯中,还原糖含量的上升较缓慢,在保鲜第6天时,其还原糖含量只有6.25%,显著低于空白对照组的13.89%(P<0.05)。由此可知,复合乳液能够有效抑制马铃薯切片在保鲜过程中还原糖的积累,从而保持较高的营养品质。
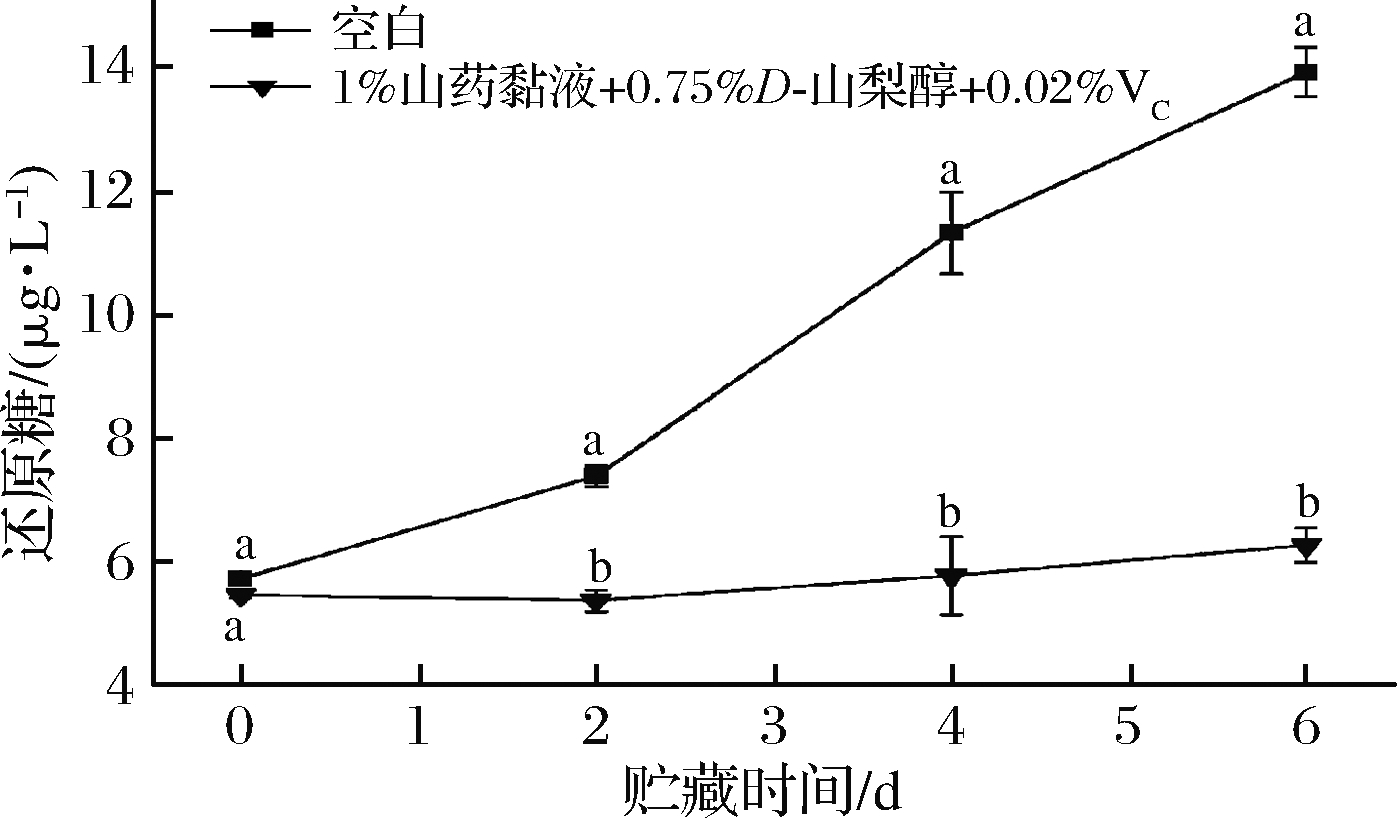
图6 山药黏液复合乳液对鲜切马铃薯还原糖含量的影响
Fig.6 Effects of emulsion on reducing sugar content in fresh-cut potatoes
3 结论
采用水提法提取了铁棍山药黏液,并与山梨醇和VC复配制备鲜切马铃薯保鲜乳液。结果表明,山药黏液与0.75% D-山梨醇及0.02%VC复配后的乳液涂膜鲜切马铃薯时,其保鲜效果最佳。在室温下贮藏6 d,能够有效降低鲜切马铃薯的失重率,减少还原糖的积累,显著抑制马铃薯片中的PPO、POD和PAL活力,减少总酚含量和MDA含量的累积,减缓褐变速率,维持马铃薯切片表面较好的色泽品质。稳定性研究表明该乳液具有较好的稳定性和分散性。该研究结果表明铁棍山药黏液质在果蔬的保鲜中具有潜在的应用价值。
[1] TOMODA M, KANEKO S, OHMORI C, et al.Plant mucilages.XIV.Isolation and characterization of a mucous polysaccharide, “Lilium-La-glucomannan” from the bulbs of Lilium lancifolium[J].Chemical & Pharmaceutical Bulletin, 1976, 24(2):430-436.
[2] TANTIWATCHAROTHAI S, PRACHAYAWARAKORN J.Characterization of an antibacterial wound dressing from basil seed (Ocimum basilicum L.) mucilage-ZnO nanocomposite[J].International Journal of Biological Macromolecules, 2019, 135:133-140.
[3] SIMS I M, SMITH A M, MORRIS G A, et al.Structural and rheological studies of a polysaccharide mucilage from lacebark leaves (Hoheria populnea A.Cunn.)[J].International Journal of Biological Macromolecules, 2018, 111:839-847.
[4] OLIVEIRA N L, RODRIGUES A A, OLIVEIRA N I C, et al.Development and characterization of biodegradable films based on Pereskia aculeata Miller mucilage[J].Industrial Crops and Products, 2019, 130:499-510.
[5] LUO M, CAO Y, WANG W, et al.Sustained-release antimicrobial gelatin film:Effect of chia mucilage on physicochemical and antimicrobial properties[J].Food Hydrocolloids, 2019, 87:783-791.
[6] MA F, ZHANG Y, YAO Y, et al.Chemical components and emulsification properties of mucilage from Dioscorea opposita Thunb[J].Food Chemistry, 2017, 228:315-322.
[7] YANG W, WANG Y, LI X, et al.Purification and structural characterization of Chinese yam polysaccharide and its activities[J].Carbohydrate Polymers, 2015, 117:1 021-1 027.
[8] NAGAI T, SUZUKI N, KAI N, et al.Functional properties of autolysate and enzymatic hydrolysates from yam tsukuneimo (Dioscorea opposita Thunb) tuber mucilage tororo:antioxidative activity and antihypertensive activity[J].Journal of Food Science & Technology, 2014, 51(12):3 838-3 845.
[9] ZHANG N, LIANG T, JIN Q, et al.Chinese yam (Dioscorea opposita Thunb.) alleviates antibiotic-associated diarrhea, modifies intestinal microbiota, and increases the level of short chain fatty acids in mice[J].Food Research International, 2019, 122:191-198.
[10] CHENG Z, HUA M, TAO J, et al.The protective effects of Chinese yam polysaccharide against obesity induced insulin resistance[J].Journal of Functional Foods, 2019, 55:238-247.
[11] LIU X, WANG T, LU W Z, et al.Effect of high oxygen pretreatment of whole tuber on anti-browning of freshcut potato slices during storage[J].Food Chemistry, 2019, 301:125 287.
[12] LI L, BAI J, WU M, et al.Studies on browning inhibition technology and mechanisms of fresh-cut potato[J].Journal of Food Processing and Preservation, 2017,41(6):e13 263.
[13] LIU X, LU Y, YANG Q, et al.Cod peptides inhibit browning in fresh-cut potato slices:A potential anti-browning agent of random peptides for regulating food properties[J].Postharvest Biology and Technology, 2018, 146:36-42.
[14] WU S J.Extending shelf-life of fresh-cut potato with cactus Opuntia dillenii polysaccharide-based edible coatings[J].International Journal of Biological Macromolecules, 2019, 130:640-644.
[15] LIU X, YANG Q, LU Y Z, et al.Effect of purslane (Portulaca oleracea L.) extract on anti-browning of fresh-cut potato slices during storage[J].Food Chemistry, 2019, 283:445-453.
[16] 胡泳华, 孙铂雅, 石宝旋, 等.生姜提取液对鲜切马铃薯贮藏品质的影响[J].食品工业科技, 2020, 41(1):247-251.
HU Y H, SUN B Y, SHI B X, et al.Effects of giner extracts on the storage quality of fresh-cut potatoes[J].Science and Technology of Food Industry, 2020, 41(1):247-251.
[17] ANDRADE L A, NUNES C A, PEREIRA J.Relationship between the chemical components of taro rhizome mucilage and its emulsifying property[J].Food Chemistry, 2015, 178:331-338.
[18] DICK M, MARIA H C T, GOMAA A, et al.Edible film production from chia seed mucilage:Effect of glycerol concentration on its physicochemical and mechanical properties[J].Carbohydrate Polymers, 2015, 130:198-205.
[19] ZAMBRANO-ZARAGOZA M L, GUTIéRREZ-CORTEZ E, DEL REAL A, et al.Fresh-cut Red Delicious apples coating using tocopherol/mucilage nanoemulsion:Effect of coating on polyphenol oxidase and pectin methylesterase activities[J].Food Research International, 2014, 62:974-983.
[20] ASSIS J S, MALDONADO R, MU OZ T, et al.Effect of high carbon dioxide concentration on PAL activity and phenolic contents in ripening cherimoya fruit[J].Postharvest Biology & Technology, 2001, 23(1):33-39.
OZ T, et al.Effect of high carbon dioxide concentration on PAL activity and phenolic contents in ripening cherimoya fruit[J].Postharvest Biology & Technology, 2001, 23(1):33-39.
[21] PICCOLELLA S, FIORENTINO A, PACIFICO S, et al.Antioxidant properties of sour cherries (Prunus cerasus L.):Role of colorless phytochemicals from the methanolic extract of ripe fruits[J].Journal of Agrcultural and Food Chem, 2008, 56(6):1 928-1 935.
[22] GAO C, POLLET E, AVÉROUS L.Innovative plasticized alginate obtained by thermo-mechanical mixing:Effect of different biobased polyols systems[J].Carbohydrate Polymers, 2017, 157;669-676.
[23] 汪经邦, 谢晶.多糖类可食性膜在水产品保鲜中的研究进展[J].食品与发酵工业, 2020,46(23):269-278.
WANG J B, XIE J.Progress in edible films prepared with polysaccharides in preservation of aquatic products[J].Food and Fermentation Industries, 2020,46(23):269-278.
[24] 施小迪, 郭顺堂.稀释介质种类对豆乳蛋白胶体粒子zeta电位测定效果的影响(英文)[J].农业工程学报, 2016, 32(7):270-275.
SHI X D, GUO S T.Effect of diluent type on analysis of zeta potential of colloid particles of soymilk protein[J].Transactions of the Chinese Society of Agricultural Engineering, 2016, 32(7):270-275.
[25] GAO H, CHAI H, CHENG N, et al.Effects of 24-epibrassinolide on enzymatic browning and antioxidant activity of fresh-cut lotus root slices[J].Food Chem, 2017, 217:45-51.
[26] 郑科旺, 付梅芳, 朱洁倩, 等.壳聚糖精油复合涂膜对鲜切山药保鲜的应用[J].食品科技, 2017, 42(5):26-30.
ZHENG K W, FU M F, ZHU J Q, et al.Effect of chitosan coating incorporated with essential oils on preservation of fresh-cut common Yam Rhizome[J].Food Science and Technology, 2017, 42(5):26-30.
[27] CHEN Z, ZHU C, ZHANG Y, et al.Effects of aqueous chlorine dioxide treatment on enzymatic browning and shelf-life of fresh-cut asparagus lettuce (Lactuca sativa L.)[J].Postharvest Biology and Technology, 2010, 58(3):232-238.
[28] KIM D H, KIM H B, CHUNG H S, et al.Browning control of fresh-cut lettuce by phytoncide treatment[J].Food Chemistry, 2014, 159:188-192.
[29] XING Y, LI X, XU Q, et al.Effects of chitosan coating enriched with cinnamon oil on qualitative properties of sweet pepper (Capsicum annuum L.)[J].Food Chemistry, 2011, 124(4):1 443-1 450.
[30] 王雅, 邹红梅, 刘聪美, 等.乙醇冷藏处理对鲜切马铃薯酶促褐变的抑制及其机理研究[J].中国食品添加剂, 2019, 30(4):80-85.
WANG Y, ZOU H M, LIU C M, et al.Mechanism of ethanol refrigeration treatment on inhibition of fresh-cut potatoes enzymatic browning[J].China Food Additives, 2019, 30(4):80-85.