兔肉具有高蛋白低脂肪的特点,符合现代消费者对健康饮食的追求,受到越来越多消费者的青睐[1]。我国是世界上兔肉生产和消费大国,据联合国粮农组织统计,2018年我国兔肉产量占世界兔肉产量60%以上,且兔肉的消费量在最近十年内迅速增长[2]。
兔肉的色泽、风味、质构等品质在贮藏期间会发生改变,这些品质与兔肉蛋白质及脂质氧化密切相关[3]。兔肉脂肪含量低,然而由于脂肪酸不饱和程度高,因此极易被氧化,容易导致肉的风味、色泽、质地和营养价值发生恶化,影响消费者对肉品的接受程度[4]。蛋白质作为肉的主要成分之一,对兔肉的品质具有重要影响,而肌原纤维蛋白(myofibril protein,MP)含量占兔肉蛋白质的60%左右,其结构及性质的变化对肉品质的影响占主导作用[5]。大量的研究表明,在肉品这个复杂的体系中,蛋白质氧化与脂质氧化相互促进[6-7]。过氧化物作为脂质氧化主要的初级代谢产物[8],对蛋白氧化具有重要影响[9]。李学鹏等[10]用不同浓度的2,2-偶氮二(2-甲基丙基咪)二盐酸盐[2,2′-azobis(2-amidinopropane) dihydrochloride,AAPH]热降解产生烷过氧自由基对草鱼肌原纤维蛋白进行氧化处理,结果显示烷过氧自由基能显著影响草鱼肌原纤维蛋白的热聚集,影响其凝胶性质。尤翔宇等[11]用不同浓度的AAPH热降解产生烷过氧自由基对米糠蛋白进行氧化处理,结果表明过氧自由基氧化可引起米糠蛋白生成聚集体,影响肌原纤维蛋白的溶解度、乳化性、起泡性、持水持油力等。此外还有AAPH热解产生烷过氧自由基对猪肉肌原纤维蛋白[12]、酪蛋白[13]、大豆蛋白[14]影响的研究,但目前关于烷过氧自由基对兔肉肌原纤维蛋白结构与功能特性影响的研究相对较少。
为了对兔肉品质进行调控,探究脂肪氧化对蛋白质氧化的影响,通过诱导AAPH热降解产生烷过氧自由基,并以不同的浓度作用于兔肉MP,研究不同氧化程度下兔肉肌原纤维蛋白结构及性质的变化,以期为深入研究肉类产品中脂质氧化和蛋白质氧化的相关性提供理论基础,并为兔肉加工过程中的氧化控制、品质调控提供一定的参考价值,为全面提升兔肉精深加工技术提供理论指导。
1 材料与方法
1.1 材料与试剂
兔肉品种为伊拉配套系商品代(兔质量:2.3 ~2.6 kg),来自重庆阿兴记原种兔养殖基地。按商业规范模式屠宰,去皮、去头、去内脏后,放入冷藏箱(约为6 ℃),在5 h内运回实验室。置于4 ℃的条件下排酸24 h后,分割出背最长肌,用保鲜袋密封,然后放置在-20 ℃冰箱中贮藏。氢氧化钠、硫酸铜、酒石酸钾钠、牛血清蛋白、AAPH,磷酸氢二钠、磷酸二氢钠、氯化钠、氯化镁、乙二胺四乙酸二钠(EDTA-2 Na)、叠氮化钠(NaN3)、2,4-二硝基苯肼、盐酸胍、2-硝基苯甲酸、尿素、溴酚蓝、盐酸、十二烷基磺酸钠、考马斯亮蓝、醋酸、甲醇,均为分析纯,成都市科龙化工试剂厂;实验用水为超纯水。
1.2 仪器与设备
电子分析天平,赛多利斯科学仪器有限公司;5810型高冷冻速离心机,德国Eppendorf公司;UV-1700紫外-可见分光光度计,日本岛津仪器有限公司;超低温冰箱,青岛海尔集团;XHF-D内切式匀浆机,宁波新芝生物科技股份有限公司;DSC 4000差示扫描量热,美国Perkin Elmer公司;ZEN3690马尔文激光粒度分析仪,英国马尔文仪器公司;DSC 4000拉曼光谱仪,美国赛默飞世尔科技公司;日立F-2500荧光分光光度计,日本日立公司。
1.3 实验方法
1.3.1 肌原纤维蛋白提取
肌原纤维蛋白的提取参照PARK等[15]的方法。兔肉背最长肌在4 ℃条件下解冻24 h,然后用绞肉机搅碎。将搅碎的兔肉与20 mmol/L磷酸缓冲液(pH 7.2,其中包含0.1 mol/L NaCl、1 mmol/L MgCl2和1 mmol/L EDTA-2 Na)按1∶4(g∶mL)混合,然后以10 000 r/min转速均质1 min,均质液在8 000 r/min、4 ℃离心15 min。去除上清液,加入提取液,并重复上述均质和离心步骤3次。之后加入20 mmol/L磷酸缓冲液(pH 6.25,其中包含0.1 mol/L NaCl),并按上述条件均质、离心处理。移除上清液后,加入100 mL磷酸盐缓冲液(pH 6.0)并匀浆。将均质液用 4层纱布过滤。随后在8 000 r/min、4 ℃条件下离心15 min,沉淀为肌原纤维蛋白样品。
1.3.2 反应体系制备
用磷酸盐缓冲液(20 mmol/L,pH 6.0,含有0.5 mg/mL NaN3)溶解肌原纤维蛋白,然后加入不同浓度的AAPH溶液,使蛋白质浓度最终浓度为20 mg/mL,溶液中AAPH的最终浓度为0、1、5、10、15和20 mmol/L。将得到的混合溶液分别装入广口试剂瓶,将试剂瓶放入恒温摇床中,在37 ℃条件下避光反应18 h。反应结束后将样本溶液离心(4 ℃、15 min、8 000 r/min)。然后用超纯水洗涤沉淀物2次,在上述条件下离心除去残余的AAPH。
1.3.3 肌原纤维蛋白化学与结构变化测定
1.3.3.1 氨基酸侧链修饰
羰基测定:羰基的测定参照CHEN等[16]的方法。在370 nm波长处测定吸光度,巯基含量根据摩尔消光系数计算求得,计算方法如公式(1)所示:
羰基含量![]()
(1)
式中:A370为370 nm波长处的吸光度;c代表蛋白质质量浓度,mg/mL。
总巯基测定:参考GAN等[17]的方法测定蛋白质总巯基含量。在412 nm波长处测定吸光度,巯基含量根据摩尔消光系数计算求得,计算方法如公式(2)所示:
巯基含量![]()
(2)
式中:A412为412 nm波长处的吸光度;c代表蛋白质质量浓度,mg/mL。
游离氨测定:参考LYU等[18]的研究方法进行测定。将200 mg邻苯二甲醛溶于2 mL无水乙醇,随后将溶液转移至128 mL Na2B4O7缓冲液中(100 mmol/L,pH 9.75,含有β-巯基乙醇0.5 mL、10% SDS溶液12.5 mL),随后用蒸馏水将溶液定容至250 mL,得到邻苯二甲醛(ortho-phthalaldehyde,OPA)溶液。将1 mg/mL 的肌原纤维蛋白溶液按照体积比1∶6与OPA溶液混合,35 ℃反应2 min后,于340 nm测定吸光度,以甘氨酸作标准曲线计算MP中游离氨含量。
1.3.3.2 肌原纤维蛋白二级结构测定
拉曼光谱测定:肌原纤维蛋白二级结构的变化利用拉曼光谱进行测定。用磷酸盐缓冲液(20 mmol/L,pH 6.0)将反应后的肌原纤维蛋白样本浓度调至20 mg/mL,然后利用拉曼光谱仪测定,光谱测定范围500~3 000 cm-1,然后利用Peak fit软件在1 600~1 700 cm-1范围进行分峰拟合。
1.3.3.3 肌原纤维蛋白三级结构测定
内源性荧光:用磷酸盐缓冲液(20 mmol/L,pH 6.0)将肌原纤维蛋白溶液浓度稀释至0.5 mg/mL,用荧光分光光度计记录300~400 nm的光谱,激发波长为295 nm,扫描速度为1 500 nm/min。
表面疏水性:肌原纤维蛋白用磷酸盐缓冲液(20 mmol/L,pH 6.0)稀释至5 mg/mL。随后,取1 mL的稀释液与0.2 mL浓度为1 mg/mL的溴酚蓝(bromophenol blue,BPB)溶液混合。同时制备对照组样品,即取1 mL磷酸盐缓冲液加入0.2 mL的溴酚蓝溶液。所有样品在25 ℃的条件下振荡10 min后离心(5 000 r/min,15 min,4 ℃)。取0.4 mL上清液,加入3.6 mL磷酸盐缓冲液(20 mmol/L,pH 6.0)稀释,在595 nm测定吸光度。以肌原纤维蛋白与BPB结合量(μg)表示表面疏水性,计算如公式(3)所示:
BPB结合量![]()
(3)
式中:A1为对照组于595 nm处吸光度;A2为处理组于595 nm处吸光度。
肌原纤维蛋白热稳定性测定:通过差示扫描量热仪DSC 4000进行肌原纤维蛋白热稳定性测定。参照LYU等[18]的方法,用磷酸盐缓冲液(20 mmol/L,pH 6.0)将蛋白质溶液稀释至20 mg/mL,取60 μL稀释好的蛋白溶液加入铝坩埚,然后密封。然后以每分钟5 ℃的加热速率将温度从30 ℃加热到100 ℃,以空白坩埚为对照,利用Trios软件计算变性温度(Td)和焓变(ΔH)。
紫外吸收测定:用磷酸盐缓冲液(20 mmol/L,pH 6.0)将肌原纤维蛋白溶液浓度稀释至0.5 mg/mL。稀释后的肌原纤维蛋白用紫外分光光度计测定其在230~320 nm处的紫外吸收光谱。
1.3.3.4 肌原纤维蛋白溶解度测定
用磷酸盐缓冲液(20 mmol/L,pH 6.0)将肌原纤维蛋白稀释至5 mg/mL,在4 ℃,8 000 r/min条件下离心15 min,测定离心后上清液蛋白浓度,同时测定离心前蛋白浓度,溶解度计算如公式(4)所示:
溶解度![]()
(4)
1.3.3.5 Zeta电位测定
参照SHEN等[19]的方法,将肌原纤维蛋白溶液稀释至1 mg/mL, 将溶液注射到Zeta电位池(DTS1070),在25 ℃下测量。
1.3.3.6 肌原纤维蛋白色泽测定
将肌原纤维蛋白溶液离心(4 ℃,15 min,10 000 r/min),得到肌原纤维蛋白膏状固体,使用色度计(UltraScan PRO)进行测定,光源为D65,测量区域直径为10 mm,测量角为10度,在25 ℃条件下测量,记录L*,a*,b*值。
1.3.3.7 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gelelectrophoresis, SDS-PAGE)
参考JIA等[20]的方法并适当修改。用磷酸盐缓冲液(20 mmol/L,pH 6.0)将肌原纤维蛋白稀释至2 mg/mL,将MP溶液与Buffer按体积比1∶3混合,然后将混合液在沸水条件下加热5 min,离心(6 000 r/min、4 ℃、5 min),取上清液10 μL,Maker 5 μL,注射至5%浓缩胶、10%分离胶组成的凝胶中,在电压为60 V的条件下进行电泳测定。
1.4 数据分析
所用的实验单独重复3次,数据以平均值±标准差(SD)表示。采用Matlab(2016b)软件分析并作图,采用SPSS软件对数据进行统计分析。显著差异水平设置为P<0.05。
2 结果与分析
2.1 AAPH浓度对兔肉MP氨基酸侧链修饰的影响
2.1.1 AAPH浓度对兔肉MP羰基含量影响
蛋白质羰基化合物是蛋白质氧化的主要产物,AAPH的浓度对兔肉肌原纤维蛋白羰基含量的影响如图1所示,结果表明对照样本蛋白羰基含量为1.93 nmol/mg蛋白,与WANG等[21]在兔肉MP中测定的值一致,随着AAPH浓度的增加,MP羰基含量显著增加(P<0.05),当AAPH浓度达到10 mmol/L,与未氧化的蛋白相比,MP羰基含量增加超过2倍并达到4.15 nmol/mg蛋白。这是因为过氧自由基会攻击蛋白质侧链的精氨酸、赖氨酸、苏氨酸和脯氨酸,使侧链氨基酸氧化产生羰基化合物,从而使MP羰基含量增加[12]。此外,过氧自由基会攻击蛋白质的肽链,导致谷氨酰胺和天冬氨酸的直接氧化,进一步使肽链裂解,使羰基含量上升。
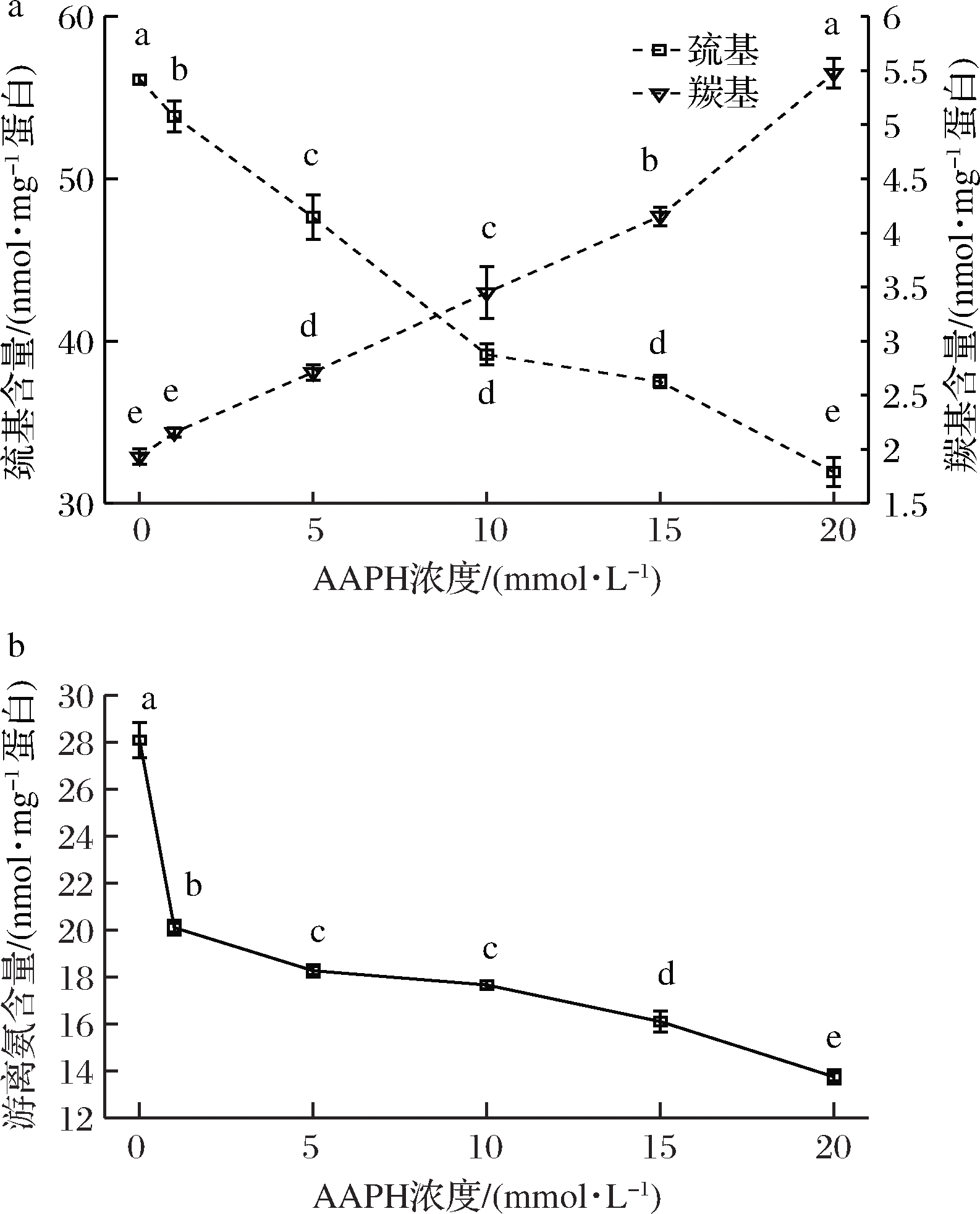
a-AAPH浓度对MP巯基和羰基含量的影响; b-AAPH浓度对MP游离氨含量的影响
图1 不同浓度的AAPH对MP氨基酸侧链修饰的影响
Fig.1 Effects of different concentrations of AAPH on the modification of MP amino acid side chain
2.1.2 AAPH浓度对兔肉肌原纤维蛋白总巯基含量影响
巯基是MP中最敏感、反应活性最高的基团,因此含硫氨基酸残基最容易受到氧化,如图1所示,巯基的变化与羰基的变化呈现相反的趋势。对照组巯基含量为56.10 nm/mg MP,随着AAPH浓度上升,巯基含量呈现显著的下降趋势(P<0.05),当AAPH浓度达到20 mmol/L,巯基含量为31.93 nm/mg MP,降低了43%。在氧化条件下,自由基能从半胱氨酸的巯基获得氢原子,产生的巯基自由基会进一步攻击其他的巯基,形成二硫键;或者进一步和其他基团反应,形成其他共价交联[22]。巯基是维持蛋白质结构一种重要的作用力,巯基含量的降低意味着蛋白质结构和功能发生改变。
2.1.3 AAPH浓度对MP游离氨含量的影响
氨基酸残基上的氨基对自由基具有高度反应性,容易被氧化转化为羰基。MP游离氨含量随AAPH浓度增加的变化如图1所示。随着AAPH浓度的上升,MP游离氨含量下降。此结果和羰基含量的上升相互对应。由于自由基对蛋白质进行氧化修饰,氨基酸残基氧化转化为羰基。同时由于氧化使蛋白三级和二级结构发生变化,隐藏在蛋白质内部的疏水性氨基酸残基得到暴露,被自由基进一步氧化,造成游离氨含量下降,羰基含量上升。
2.2 AAPH浓度对MP二级结构的影响
为了进一步说明AAPH对蛋白质结构的影响,研究测定MP的拉曼光谱,并对光谱进行分峰解析。不同浓度AAPH处理的MP的拉曼光谱如图2所示,MP样品特征吸收峰有800~900 cm-1,1 200~1 500 cm-1,1 600~1 700 cm-1和2 900~3 000 cm-1,其中酰氨Ⅰ区主要用来分析蛋白质二级结构。蛋白质的二级结构变化趋势如图3所示,随着AAPH浓度的升高,α-螺旋和β-转角呈现下降趋势,而无规则卷曲和β-折叠则呈增长趋势,ZHOU等[23]研究发现,不同氧化程度油脂对鱼肌原纤维蛋白结构有影响,油脂氧化程度越高,蛋白质的α-螺旋含量越低,这个结论与本研究所得到的结果一致。α-螺旋结构主要依靠蛋白质分子内的氢键维持,而自由基攻击蛋白质的氨基使得蛋白质分子内氢键减少,从而导致蛋白质去折叠化。此结果与游离氨、表面疏水性以及溶解度的变化相互印证。

图2 不同浓度的AAPH对MP拉曼光谱的影响
Fig.2 Effect of different concentrations of AAPH on MP Raman Spectra
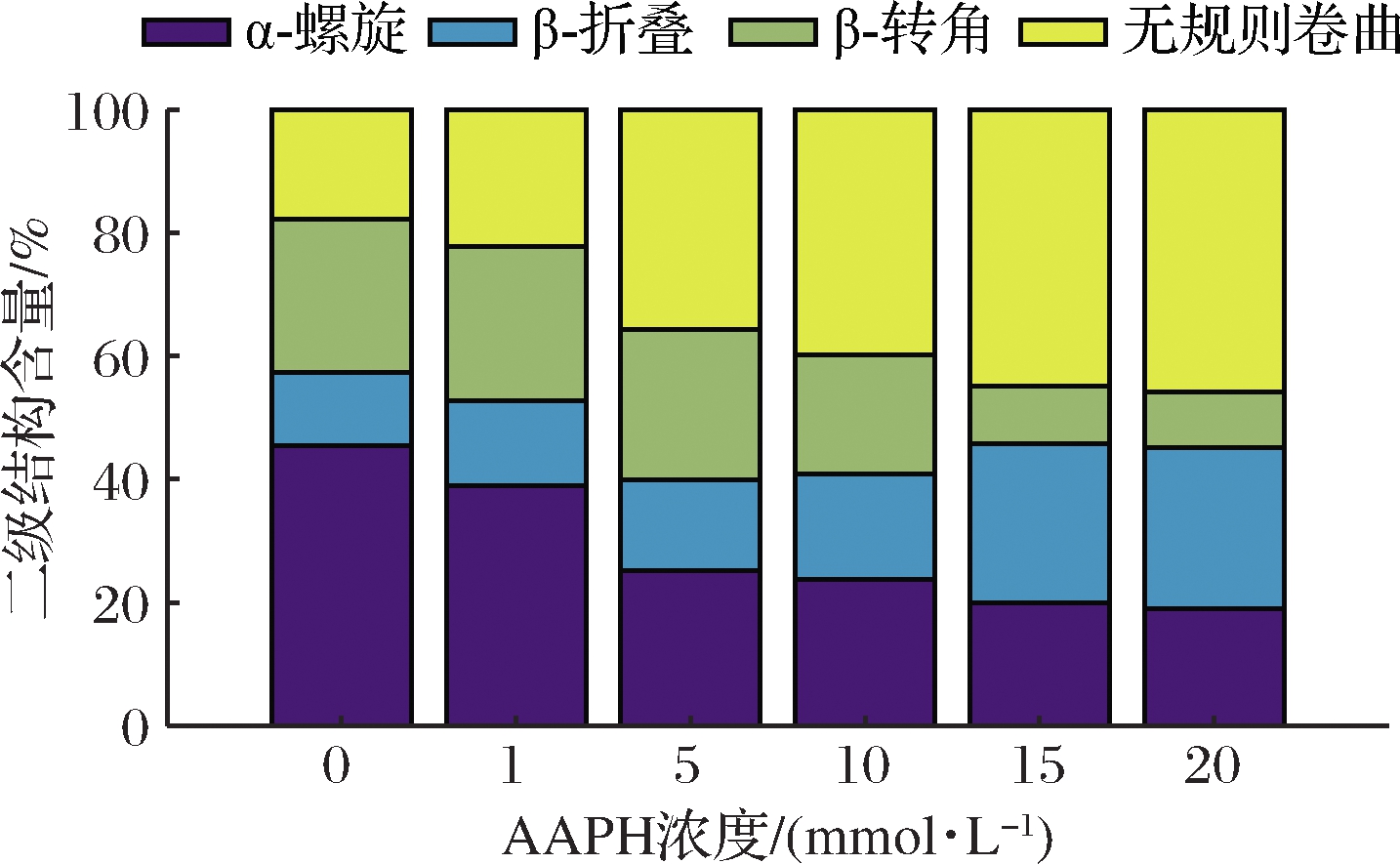
图3 不同浓度的AAPH对MP二级结构的影响
Fig.3 The effect of different concentrations of AAPH on the secondary structure of MP
2.3 AAPH浓度对MP三级结构的影响
2.3.1 AAPH浓度对MP表面疏水性的影响
维持蛋白质三级结构和蛋白质构象很重要的一种作用力是表面疏水作用力,表面疏水性的改变可以直接反映蛋白质结构的变化。由图4可以看出,表面疏水性随着AAPH的浓度增加呈显著上升趋势(P<0.05),并于20 mmol/L达到最高,比未氧化组升高了44%,这是因为在过氧自由基攻击下,蛋白质巯基被氧化,其二级结构发生改变,使蛋白质内部疏水性氨基酸暴露出来,最终导致蛋白质表面疏水性增加。NYAISABA等[24]的研究也表明,在自由基氧化条件下,鱿鱼肌原纤维蛋白会发生去折叠化,使表面疏水性增加,且表面疏水性与自由基浓度呈正相关,这与本研究结果一致。
2.3.2 AAPH浓度对MP紫外吸收光谱及内源性荧光的影响
芳香族氨基酸侧链具有紫外吸收特性,因此紫外光谱的变化可以反映蛋白质构象的改变。如图4所示,未添加AAPH的MP在280 nm左右有吸收峰,随着AAPH浓度的上升,吸收峰呈现降低趋势,而且AAPH浓度为20 mmol/L时,处于280 nm附近的峰消失。这一结果说明蛋白质中的芳香族氨基酸(酪氨酸、苯丙氨酸、色氨酸)被氧化。兔肉中色氨酸含量很高,而色氨酸极容易被氧化,WANG等[22]研究发现兔肉MP侧链色氨酸的氧化会导致紫外吸收峰的降低甚至消失,这与本研究结果一致。
为了进一步证明MP色氨酸发生氧化,对氧化后MP内源性荧光进行测定,蛋白质的荧光主要由色氨酸贡献。图4展示了不同浓度AAPH处理后MP荧光的变化,荧光光谱显示MP荧光在335 nm处有吸收峰,而且荧光强度随着AAPH浓度增加逐渐降低。色氨酸属于疏水性氨基酸,一般位于蛋白质内部,添加AAPH会导致色氨酸的荧光降低,这表明蛋白质结构展开,疏水性的色氨酸被暴露,从而被氧化。相关研究也表明在自由基攻击下,蛋白质发生去折叠化,疏水性增加,游离氨含量降低,羰基含量上升[25-26]。

a-AAPH浓度对MP表面疏水性的影响;b-AAPH浓度对MP紫外吸收光谱的影响;c-AAPH浓度对MP荧光光谱的影响
图4 不同浓度的AAPH对MP三级结构的影响
Fig.4 The effect of different concentrations of AAPH on the tertiary structure of MP
2.3.3 AAPH浓度对MP热稳定性的影响
蛋白质氧化会导致其结构和氨基酸的变化,这会引起MP成分中肌球蛋白和肌动蛋白热变性温度的变化。如表1所示,未氧化的MP具有两个变性温度57.91 ℃和78.08 ℃,分别对应肌球蛋白热变性温度Td1,和肌动蛋白热变性温度Td2,它们的焓变分别对应为ΔH1和ΔH2。随着AAPH浓度增加,变性温度和焓变呈现减小趋势,当AAPH浓度增加到10 mmol/L,肌球蛋白变性峰消失,而当AAPH浓度增加到15 mmol/L,肌动蛋白热变性峰消失。此结果说明氧化会导致蛋白质变性,且肌球蛋白比肌动蛋白更加容易氧化变性。这个结果与CHENG等[26]的结论一致。
表1 不同浓度的AAPH对MP热稳定性的影响
Table 1 The effect of different concentrations of AAPH on the thermal stability of MP
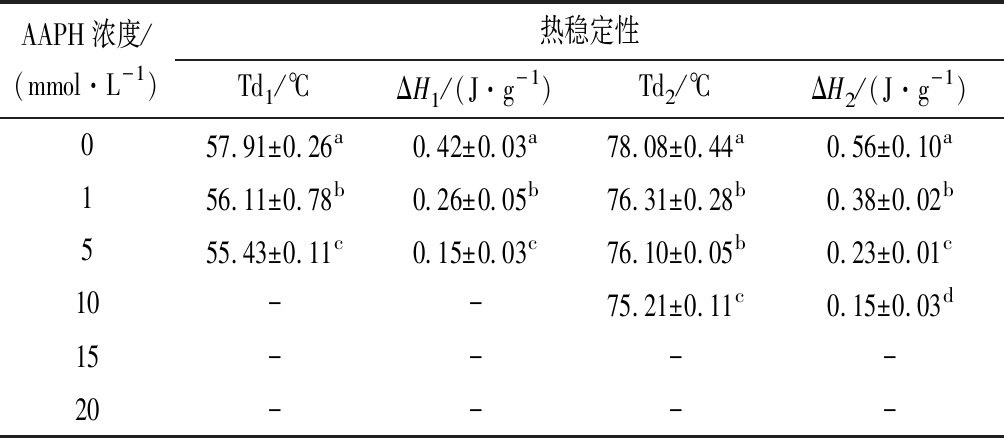
AAPH浓度/(mmol·L-1)热稳定性Td1/℃ΔH1/(J·g-1)Td2/℃ΔH2/(J·g-1)057.91±0.26a0.42±0.03a78.08±0.44a0.56±0.10a156.11±0.78b0.26±0.05b76.31±0.28b0.38±0.02b555.43±0.11c0.15±0.03c76.10±0.05b0.23±0.01c10--75.21±0.11c0.15±0.03d15----20----
注:“-”表示未检测出,不同的小写字母表示差异显著(P<0.05)
2.4 AAPH浓度对MP溶解度的影响
溶解度是MP氧化程度的一个重要参数,对蛋白质的功能特性有较大影响。MP溶解度随AAPH浓度增加的变化趋势如图5所示,随AAPH浓度的增加,MP溶解度逐渐下降,与AAPH浓度呈负相关。当AAPH浓度为0 mmol/L,MP的溶解度为10.14%。当AAPH浓度分别增加至1、5、10、15 和20 mmol/L,MP溶解度分别为8.58%,7.22%,6.43%,5.07%和4.1%。ZHOU等[27]研究发现米糠蛋白在过氧自由基氧化条件下,蛋白溶解度随着AAPH浓度增加而下降,与本研究的结果一致。溶解度的降低进一步说明蛋白质在自由基氧化条件下发生去折叠化,疏水性基团暴露,并产生交联,蛋白质分子聚集,此结果与羰基、巯基以及表面疏水性的变化趋势相对应。
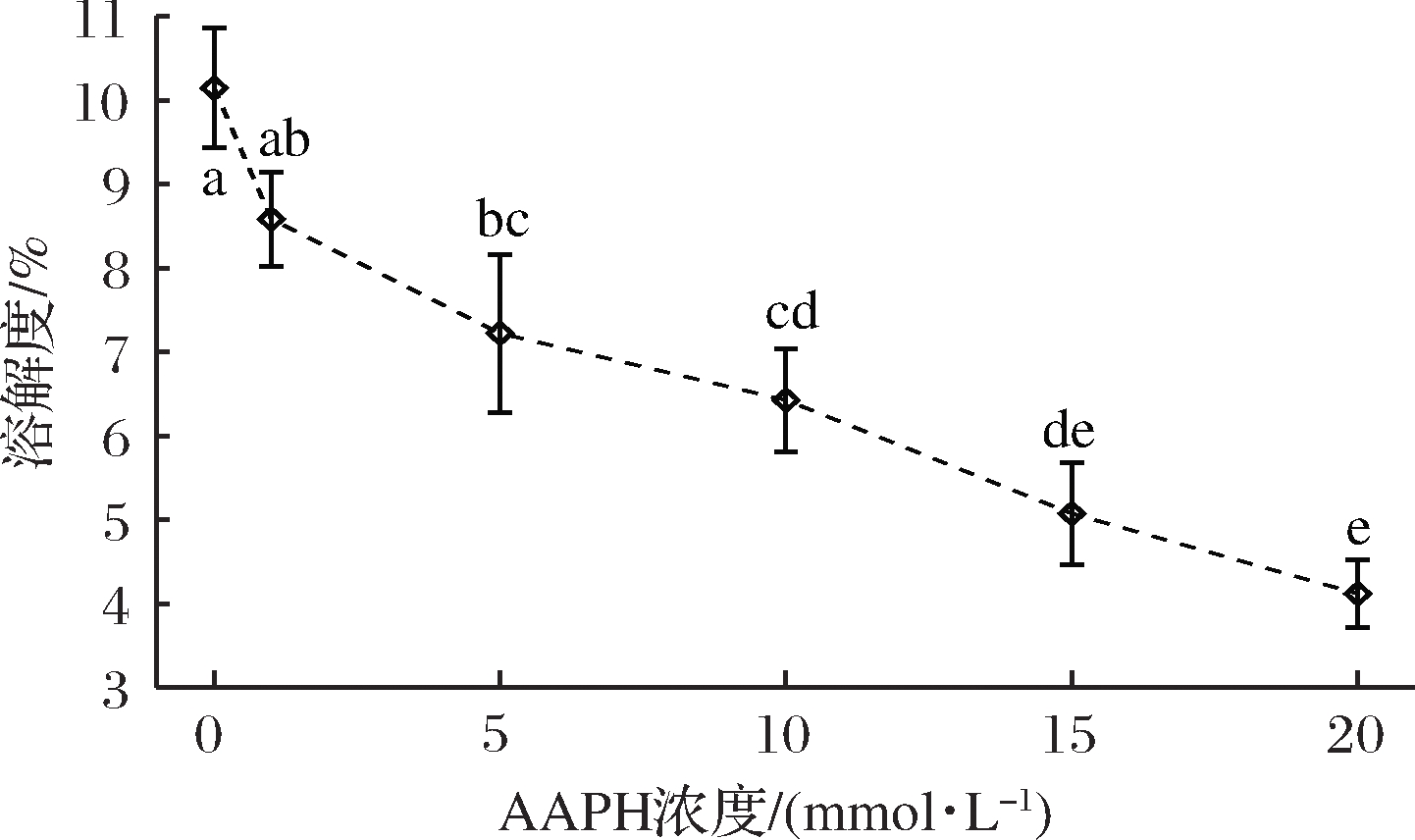
图5 不同浓度的AAPH对MP溶解度的影响
Fig.5 The effect of different concentrations of AAPH on the solubility of MP
2.5 AAPH浓度对MP Zeta电位的影响
图6展示了Zeta电位随着AAPH浓度增加的变化情况,肌原纤维蛋白的等电点大约为pH 4,因此MP在pH为6的缓冲溶液中带负电,未添加AAPH的肌原纤维蛋白的Zeta电位绝对值最大,而随着AAPH浓度的增加,电位绝对值逐渐下降。蛋白质带电荷主要是因为氨基酸带电荷,蛋白质在过氧自由基的攻击下,一些氨基酸被氧化使得电荷得到中和,导致蛋白质电荷绝对值降低,由于所带电荷绝对值的减少,蛋白质之间静电相互作用力减小,这也是蛋白质在氧化后溶解度降低的原因之一[28],此结果和游离氨基溶解度的变化相互印证。
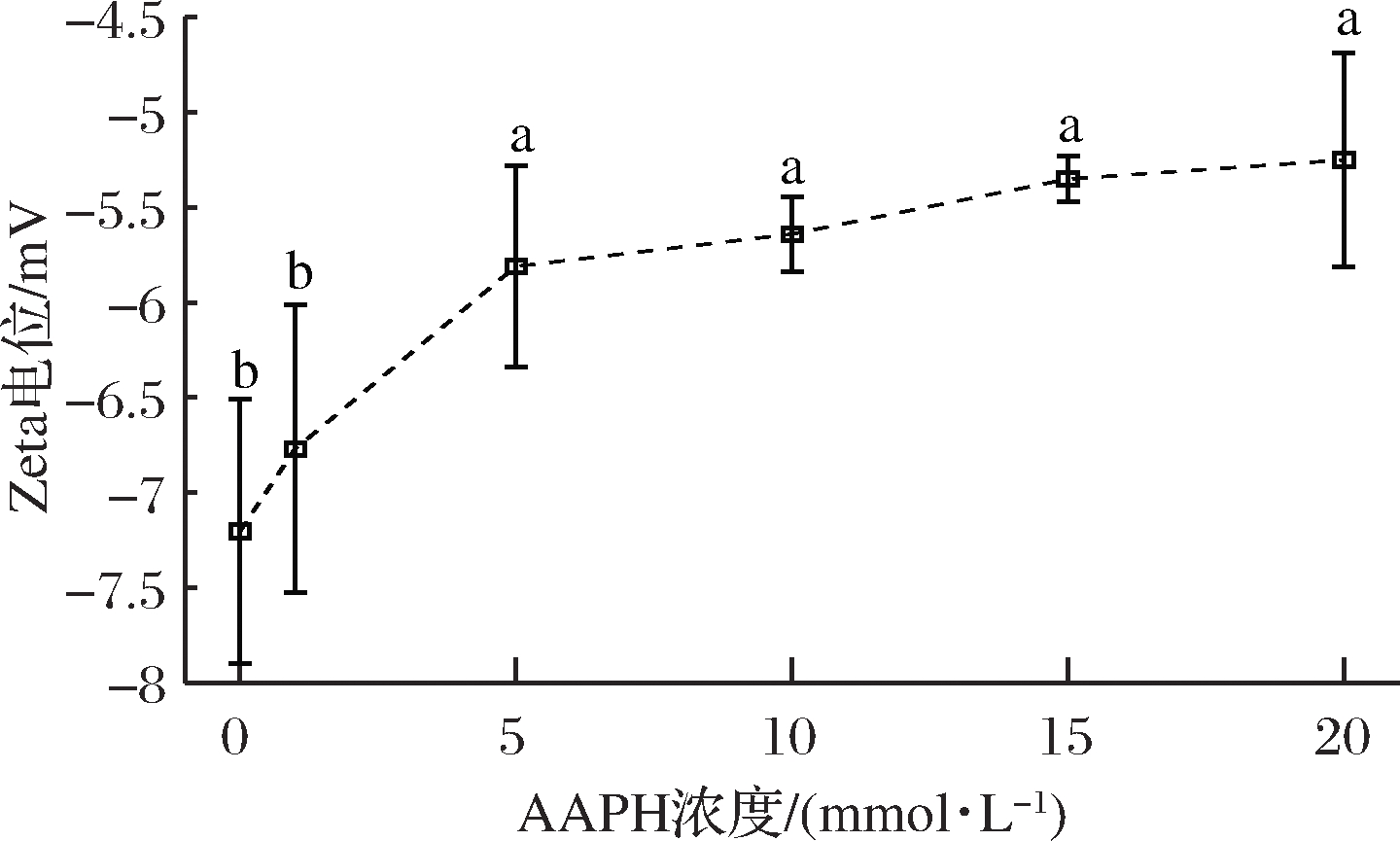
图6 不同浓度的AAPH对MP Zeta电位的影响
Fig.6 The effect of different concentrations of AAPH on MP Zeta potential
2.6 AAPH浓度对MP色差的影响
肉在氧化过程中,色泽会发生变化,这是由脂肪氧化和蛋白质氧化共同决定的。一般而言,氧化会导致肉的红度值a*下降,黄度值b*上升。a*下降主要是肌红蛋白氧化导致,而b*上升目前主要认为是脂肪氧化产物丙二醛导致。MP的色差变化如表2所示,随着AAPH浓度的增加,L*和b*呈现增加趋势,而a*则展示下降趋势。蛋白质是肉的主要成分,肌原纤维蛋白占总蛋白60%左右,因此肌原纤维蛋白的色差变化对肉的色差影响很大,此结论从机理上说
表2 不同浓度的AAPH对MP色差的影响
Table 2 The effect of different concentrations of AAPH on the color of MP
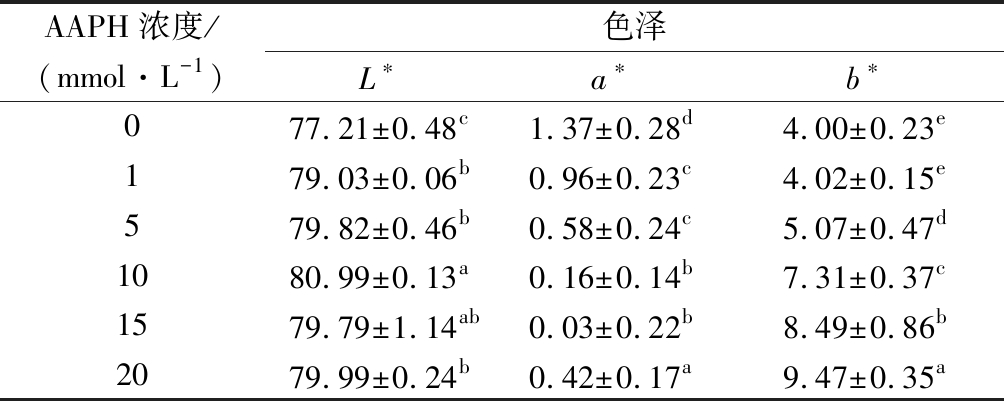
AAPH浓度/(mmol·L-1)色泽L∗a∗b∗077.21±0.48c1.37±0.28d4.00±0.23e179.03±0.06b0.96±0.23c4.02±0.15e579.82±0.46b0.58±0.24c5.07±0.47d1080.99±0.13a0.16±0.14b7.31±0.37c1579.79±1.14ab0.03±0.22b8.49±0.86b2079.99±0.24b0.42±0.17a9.47±0.35a
注:不同的小写字母表示差异显著(P<0.05)
明兔肉在贮藏过程中b*值的上升不仅是因为脂肪氧化产物丙二醛的产生,很大一部分的原因是肌原纤维蛋白的氧化,因此减少蛋白氧化可以控制肉的色泽劣变。
2.7 SDS-PAGE
SDS-PAGE被用来分析添加不同浓度AAPH后MP的交联以及分子质量的变化情况。图7展示了不同浓度的AAPH对MP凝胶电泳的影响,图7-a展示了添加β-巯基乙醇的电泳图,图7-b展示了未添加β-巯基乙醇的电泳图。从图7-b可以看出,在凝胶的顶部进样口有条带聚集而且随着AAPH浓度的上升,聚集条带加深,同时肌球蛋白重链和肌动蛋白条带随着AAPH浓度增加,逐渐变浅,这些结果表明在自由基氧化条件下,蛋白质发生交联聚集。FUENTES-LEMUS等[13]研究发现过氧自由基诱导酪蛋白氧化,导致酪蛋白聚集分子质量增加,同时通过高效液相色谱质谱检测到了二聚酪氨酸、二硫键聚合物以及其他聚合物,当在MP中添加β-巯基乙醇后,聚集在顶部的条带依然存在,这说明在氧化条件下蛋白质的交联不仅存在二硫键,还存在其他的共价交联。随着AAPH浓度增加,肌球蛋白重链和肌动蛋白条带逐渐变浅。

a-添加β-巯基乙醇;b-未添加β-巯基乙醇
图7 不同浓度的AAPH处理对MP凝胶电泳的影响
Fig.7 The influence of different concentrations of AAPH on MP gel electrophoresis
注:1、2、3、4、5、6分别表示AAPH浓度为0、1、5、 10、15、20 mmol/L
3 结论
采用不同浓度AAPH热解产生的过氧自由基对兔肉MP进行氧化,探讨不同浓度的过氧自由基对兔肉MP的影响。研究表明随着AAPH浓度的升高,蛋白的巯基含量、内源性荧光强度、溶解度、游离氨含量、热稳定性和α-螺旋含量呈下降趋势,而羰基含量、表面疏水性,L*值和b*值呈上升趋势。SDS-PAGE结果进一步表明,兔肉MP在过氧自由基氧化条件下,蛋白分子发生交联聚集。综上所述,脂质氧化的初级代谢产物过氧自由基能够显著促进蛋白质氧化,从而改变其性质,因此在肉品质调控中,可以通过控制脂肪氧化来调节蛋白质氧化,研究结果为兔肉后续加工中控制蛋白质氧化提供理论依据。
[1] ZOTTE A D, SZENDROE Z.The role of rabbit meat as functional food[J].Meat Science, 2011, 88(3):319-331.
[2] FAOSTAT.Livestock primary:The production quantity of rabbit meat and in China the world[EB/OL].[2020-09-30].http://www.fao.org/faostat/en/#data/QL.
[3] WANG Z M, HE Z F, GAN X, et al.Interrelationship among ferrous myoglobin, lipid and protein oxidations in rabbit meat during refrigerated and superchilled storage[J].Meat Science, 2018, 146:131-139.
[4] LAN Y, SHANG Y B, SONG Y, et al.Changes in the quality of superchilled rabbit meat stored at different temperatures[J].Meat Science, 2016, 117:173-181.
[5] JIA N, WANG L T, SHAO J H, et al.Changes in the structural and gel properties of pork myofibrillar protein induced by catechin modification[J].Meat Science, 2017, 127:45-50.
[6] ZAREIAN M, TYBUSSEK T, SILCOCK P, et al.Interrelationship among myoglobin forms, lipid oxidation and protein carbonyls in minced pork packaged under modified atmosphere[J].Food Packaging and Shelf Life, 2019, 20:1-8.
[7] WONGWICHIAN C, KLOMKLAO S, PANPIPAT W, et al.Interrelationship between myoglobin and lipid oxidations in oxeye scad (Selar boops) muscle during iced storage[J].Food Chemistry, 2015, 174:279-285.
[8] SADEGHINEJAD N, SARTESHNIZI R A, GAVLIGHI H A, et al.Pistachio green hull extract as a natural antioxidant in beef patties:Effect on lipid and protein oxidation, color deterioration, and microbial stability during chilled storage[J].LWT-Food Science and Technology, 2019, 102:393-402.
[9] MARIOTTI M, LEINISCH F, LEEMING D J, et al.Mass-spectrometry-based identification of cross-links in proteins exposed to photo-oxidation and peroxyl radicals using O-18 labeling and optimized tandem mass spectrometry fragmentation[J].Journal of Proteome Research, 2018, 17(6):2 017-2 027.
[10] 李学鹏, 刘慈坤, 王金厢, 等.烷过氧自由基氧化对草鱼肌原纤维蛋白热聚集行为的影响[J].食品科学, 2020, 41(17):9-16.
LI X P, LIU C K, WANG J X, et al.Effect of alkylperoxyl radical oxidation on heat-induced aggregation behavior of myofibrillar protein from grass carp (Ctenopharyngodon idellus)[J].Food Science, 2020, 41(17):9-16.
[11] 尤翔宇, 黄慧敏, 吴晓娟, 等.过氧自由基氧化对米糠蛋白结构和功能性质的影响[J].食品科学, 2019, 40(4):34-41.
YOU X Y, HUANG H M, WU X J, et al.Effects of oxidative modification by peroxyl radicals on the structural and functional properties of rice bran protein[J].Food Science, 2019, 40(4):34-41.
[12] ZHOU F B, ZHAO M M, ZHAO H F, et al.Effects of oxidative modification on gel properties of isolated porcine myofibrillar protein by peroxyl radicals[J].Meat Science, 2014, 96(4):1 432-1 439.
[13] FUENTES-LEMUS E, SILVA E, BARRIAS P, et al.Aggregation of α- and β- caseins induced by peroxyl radicals involves secondary reactions of carbonyl compounds as well as dityrosine and ditryptophan formation[J].Free Radical Biology and Medicine, 2018, 124:176-188.
[14] 邱天福. 烷过氧自由基氧化修饰对大豆蛋白结构和性质的影响[D].武汉:华中农业大学, 2013.
QIU T F.Effects of alkylperoxyl radical oxidation-modification on structure and properties of soy protein[D].Wuhan:Huazhong Agricultural University, 2013.
[15] PARK D, XIONG Y L, ALDERTON A L.Concentration effects of hydroxyl radical oxidizing systems on biochemical properties of porcine muscle myofibrillar protein[J].Food Chemistry, 2007, 101(3):1 239-1 246.
[16] CHEN Y T, XU A Q, YANG R, et al.Myofibrillar protein structure and gel properties of trichiurus haumela surimi subjected to high pressure or high pressure synergistic heat[J].Food and Bioprocess Technology, 2020, 13(4):589-598.
[17] GAN X, LI H, WANG Z, et al.Does protein oxidation affect proteolysis in low sodium Chinese traditional bacon processing[J].Meat Science, 2019, 150:14-22.
[18] LYU Y Q, CHEN L, WU H Z, et al.(-)-Epigallocatechin-3-gallate-mediated formation of myofibrillar protein emulsion gels under malondialdehyde-induced oxidative stress[J].Food Chemistry, 2019, 285:139-146.
[19] SHEN H, ZHAO M M, SUN W Z.Effect of pH on the interaction of porcine myofibrillar proteins with pyrazine compounds[J].Food Chemistry, 2019, 287:93-99.
[20] JIA N, ZHANG F X, LIU Q, et al.The beneficial effects of rutin on myofibrillar protein gel properties and related changes in protein conformation[J].Food Chemistry, 2019, 301:1-9.
[21] WANG Z F, HE Z F, ZHANG D, et al.Using oxidation kinetic models to predict the quality indices of rabbit meat under different storage temperatures[J].Meat Science, 2020, 162:1-8.
[22] WANG Z M, HE Z F, GAN X, et al.Effect of peroxyl radicals on the structure and gel properties of isolated rabbit meat myofibrillar proteins[J].International Journal of Food Science and Technology, 2018, 53(12):2 687-2 696.
[23] ZHOU X X,CHEN H, LYU F, et al.Physicochemical properties and microstructure of fish myofibrillar protein-lipid composite gels:Effects of fat type and concentration[J].Food Hydrocolloids, 2019, 90:433-442.
[24] NYAISABA B M, HATAB S, LIU X X, et al.Physicochemical changes of myofibrillar proteins of squid (Argentinus ilex) induced by hydroxyl radical generating system[J].Food Chemistry, 2019, 297:1-8.
[25] YANG J Y, XIONG Y L.Comparative time-course of lipid and myofibrillar protein oxidation in different biphasic systems under hydroxyl radical stress[J].Food Chemistry, 2018, 243:231-238.
[26] CHENG W Q, ZHENG X Y, YANG M.Hydrogen peroxide induced protein oxidation during storage and lyophilization process[J].Journal of Pharmaceutical Sciences, 2016, 105(6):1 837-1 842.
[27] ZHOU L Y, ZHANG Y, ZHAO C B, et al.Structural and functional properties of rice bran protein oxidized by peroxyl radicals[J].International Journal of Food Properties, 2017, 20(s2):1 456-1 467.
[28] SHEN H, HUANG M Q, ZHAO M M, et al.Interactions of selected ketone flavours with porcine myofibrillar proteins:The role of molecular structure of flavour compounds[J].Food Chemistry, 2019, 298:1-7.