肠道微生物群是一个复杂的微生物生态系统,大约有1014个细菌组成,主要包括厚壁菌门、拟杆菌门、变形杆菌门和放线菌门[1-3]。肠道微生物群能够参与体内难消化碳水化合物等成分的代谢[4-5],同时能够与宿主肠道系统相互作用,保障黏液层结构的完整,阻止病原菌在宿主肠道内的定植[6]。肠道微生物群失衡可以引发炎症性肠病、癌症、肥胖和代谢综合征等慢性疾病[2]。因此,维持肠道微生物群的平衡与人体健康密切相关。然而,单纯摄入含有乳酸菌、双歧杆菌和乳球菌等益生菌制剂,一方面在体内停留时间较短,仅为14 d,没有发挥益生作用;另一方面肠道黏膜菌群对益生菌产生定植抵抗,引起肠道微生物群的失衡[7-8]。所以,合理膳食能够调节肠道微生物组成,维持肠道微生物群平衡[9]。
膳食纤维在小肠中难以消化和吸收,可以到达结肠,并与微生物群相互作用,能够促进有益菌生长,抑制有害菌繁殖,调节肠道微生物组成[10],具有预防肥胖、降低代谢综合征风险的作用[11-12]。多酚化合物的生物有效性和生物利用度较低,90%~95%在小肠中不能被消化和吸收,到达结肠后能够与肠道微生物相互作用,调节肠道微生物群,维持肠道微生物群落平衡[9]。研究表明,多酚化合物能够促进乳杆菌等有益菌生长,抑制致病菌生长[3],降低厚壁菌门(Phylum Firmicutes)和拟杆菌门(Phylum Bacteroidetes)的比例,修复肠道微生物失调,缓解高胆固醇血症[2,12],预防肥胖等慢性疾病[11]。
膳食纤维和多酚均能改变肠道微生物群的组成和结构,保持肠道微生物菌群的动态平衡,促进人体健康。青稞(Hordeum vulgare L.var.nudum hook.f.)作为云南省迪庆藏族自治州高原特色谷物[10],含有丰富的多酚和膳食纤维[13]。目前关于膳食纤维和多酚协同调节肠道微生物的研究鲜有报道,因此本研究提取青稞中不可溶膳食纤维-多酚(insoluble dietary fiber-phenolic compounds,IDF-PC)和可溶性膳食纤维-多酚(soluble dietary fiber-phenolic compounds,SDF-PC),利用体外结肠发酵,通过16S rRNA高通量测序,研究膳食纤维和多酚对肠道微生物的协同调节作用,以期为青稞促进机体健康和预防疾病提供科学依据,为青稞深加工提供新的思路。
1 材料与方法
1.1 材料与试剂
云黑青稞由云南省迪庆藏族自治州农科所提供。2-(N-吗啉)乙磺酸-水合物(MES monohydrate)、三(羟甲基)氨基甲烷(Tris-HCl),北京索莱宝科技有限公司;阿魏酸标准品、耐高温α-淀粉酶、碱性蛋白酶、糖化酶、磷酸氢二钠、磷酸二氢钠,上海晶纯生化科技股份有限公司;福林-酚试剂、猪α-淀粉酶、猪胃蛋白酶、猪胆汁盐、猪胰液素、猪黏液素,西格玛奥德里奇(上海)贸易有限公司;厌氧产气袋和去氧剂,三菱瓦斯化学株式会社;其他试剂均为分析纯。
1.2 仪器与设备
M-304不锈钢五谷杂粮磨粉机,广州雷迈机械设备有限公司;TGL20M离心机,湖南湘立科学仪器有限公司;RE-52AA旋转蒸发仪,上海亚荣生化仪器厂;UV-1800CP紫外分光光度计,上海美谱达仪器有限公司;HH-4数显恒温水浴锅,金坛市城西丽华实验仪器厂;ZD-85A双功能数显恒温振荡器,常州朗越仪器制造有限公司;L6J-12冷冻干燥机,郑州南北仪器设备有限公司。
1.3 实验方法
1.3.1 膳食纤维-多酚复合物的制备
参考LEE[14]和李永强等[15] 的方法。准确称取100 g青稞面粉(hulless barley powder,HBF),取1 500 mL MES-Tris缓冲液溶解,加入耐高温α-淀粉酶,酶解后,用NaOH调节pH值至10.5,加入碱性蛋白酶,反应后用HCl调节pH值至4.25,加入糖化酶酶解。酶解结束后,离心,棕色沉淀为IDF-PC,收集合并后冻干,于-80 ℃避光保存。离心后上清液加入乙醇溶液,静置过夜,离心后所得白色沉淀为SDF-PC,收集合并后冻干,于-80 ℃避光保存。
1.3.2 多酚化合物及膳食纤维含量测定
1.3.2.1 可溶性和不可溶键合多酚的提取
按LI等[16-18]的方法提取多酚化合物。分别称取HBF、IDF-PC、SDF-PC各2 g,加入70%(体积分数)丙酮溶液,室温超声提取,离心后得上清液,重复3次。合并上清液,30 ℃真空旋转蒸发至干,用甲醇溶解得可溶性多酚化合物。离心残渣加入NaOH,室温水解4 h,用盐酸调节pH值为2,离心,上清液用乙醚和乙酸乙酯萃取3次,合并有机相,真空旋转蒸发至干,用甲醇溶解得不可溶键合多酚化合物,于4 ℃下避光保存备用。
1.3.2.2 多酚含量测定
采用福林-酚试剂比色法[16-18]测定样品中可溶性和不可溶键合多酚含量。以阿魏酸制定标准曲线,为y=1.289x-0.003 (R2=0.998),所得结果用阿魏酸当量(ferulic acid equivalents,FAE)表示,结果表示为μmol FAE/g 干样(dry sample,DS)。样品总多酚含量为可溶性和不可溶键合多酚含量之和。
1.3.2.3 膳食纤维含量测定
据1.3.1中的方法制备膳食纤维多酚复合物,得到膳食纤维-多酚(dietary fibber-phenolic compounds,DC-PC),并计算HBF中膳食纤维含量。IDF-PC、SDF-PC中膳食纤维含量计算如公式(1)所示:
膳食纤维含量![]()
(1)
式中:m1,样品质量,g;m2,多酚质量,g。
1.3.3 体外结肠发酵
根据ANOMA等[17-19]方法制备胃肠残渣。分别称取一定量HBF,SDF-PC,IDF-PC,加入蒸馏水和NaCl溶液,于37 ℃水浴,定期振摇使样品温度达37 ℃。加入猪α-淀粉酶水浴消化后,利用HCl调节pH值至2,然后加入猪胃蛋白酶,暗处消化2 h,得到模拟胃消化产物悬浊液。用NaOH调节pH值至6.5,依次加入胆汁盐,猪胰液素,猪黏液素进行消化。然后样品离心得到上清液和残渣,残渣加入蒸馏水后再次离心,合并上清液,残渣冻干用于结肠发酵。
将粪便样品用磷酸缓冲溶液稀释并过滤,以过滤的浑浊液作为接种物。配制培养基,于121 ℃灭菌15 min,加入冻干的胃肠残渣和肠道微生物浑浊液,分别培养5、10、24、48 h。设置HBF、IDF-PC和SDF-PC 样品组,阿魏酸(ferulic acid,FA)对照组和空白组(blank,B)。HBF组为粪便+HBF+培养基;IDF-PC组为粪便+培养基+IDF-PC;SDF-PC组为粪便+培养基+SDF-PC;FA组为粪便+培养基+FA;B组为猪粪便。发酵结束后,离心后得到的残渣用于分析微生物多样性。
1.3.4 短链脂肪酸(short-chain fatty acids,SCFAs)分析
根据PARKAR等[20]的方法提取SCFAs并测定含量,结肠发酵样品离心后取上清液,加入NaCl、偏磷酸、CuSO4,涡旋混匀后,用乙醚提取,然后离心,将有机相转移到试管中。加入NaOH溶液,振摇提取10 min,离心后,水相移到玻璃瓶中,加入磷酸溶液混匀,用于液相分析。
用岛津高效液相色谱仪SPD-20A,岛津色谱柱(4.6 mm×250 mm,5 μm),在40 ℃下进行分离,进样量为20 μL,流速为1.0 mL/min,波长为214 nm,流动相:A为甲醇,C为磷酸氢二铵溶液(1.5 g加入600 mL超纯水溶解,用1 mol/L磷酸溶液调节pH值至2.78),条件为:0 min,A∶C(0∶100);7 min,A∶C(5∶95);15 min,A∶C(40∶60);24 min,A∶C(40∶60);25 min,A∶C(0∶100);35 min,A∶C(停止)。
1.3.5 微生物16S rRNA测序
16S rRNA测序委托上海美吉生物医药科技有限公司完成。DNA的提取根据OMEGA-soil DNA Kit试剂盒说明书的方法进行提取。利用NanoDrop2000检测DNA纯度,利用1%(质量分数)琼脂糖凝胶电泳检测DNA完整性。扩增样品中的16S rRNA基因V3~V4可变区,引物为:338F和806R。PCR(ABI GeneAmp® 9700型)采用TransGen AP221-02:TransStart Fastpfu DNA Polymerase,20 μL反应体系:5×FastPfu Buffer 4 μL,dNTPs(2.5 mmol/L)2 μL,Forward Primer(5 μmol/L)和Reverse Primer(5 μmol/L)各0.8 μL,FastPfu Polymerase 0.4 μL,BSA 0.2 μL,Template DNA 10 ng,ddH2O 11.79 μL。
PCR反应条件:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸45 s,27个循环;72 ℃后延伸10 min。采用2%(质量分数)琼脂糖凝胶电泳检测,使用AxyPrepDNA凝胶回收试剂盒(AXYGEN 公司)切胶回收PCR产物,用Tris-HCl洗脱。将PCR产物用QuantiFluorTM-ST蓝色荧光定量系统(Promega公司)进行检测定量,之后按照每个样本的测序量要求,进行相应比例的混合。进行Miseq文库构建,在Miseq PE300平台进行高通量测序。
1.3.6 肠道微生物生物信息学分析
Miseq测序得到的是双端序列数据,首先根据PE reads之间的overlap关系,将成对的reads拼接成1条序列,同时对reads的质量和merge的效果进行质控过滤,根据序列首尾两端的barcode和引物序列区分样品得到有效序列,并校正序列方向。使用Trimmomatic软件进行去杂,过滤read尾部质量值20以下的碱基。在97%的序列相似度水平上,使用Usearch(vsesion 7.1 http://drive5.com/uparse)软件对所有序列进行可操作分类单元(operational taxonomic unit,OTU)聚类分析。参考数据库为Silva (Release123 http://www.arb-silva.de)[21],利用RDP classifier贝叶斯算法[22]对97%相似水平的OTU代表序列进行分类学分析,通过对比Silva[23]数据库(Release119 http://www.arb-silva.de);在门水平和属水平统计各样本的群落组成。细菌群落组成采用直观的柱状图呈现,样品中分类水平未被命名的种类命名为“others”。用mothur软件计算样品的α多样性指数。
根据β多样性距离矩阵进行层次聚类分析,使用非加权组平均法(unweighted pair group method with arithmetic mean,UPGMA)算法构建树状结构。通过主坐标分析(principal co-ordinates analysis,PCoA)样本微生物群落组成差异性或相似性。
1.3.7 数据处理与分析
实验所得到的数据均以平均值±标准偏差表示。数据使用SPSS 22.0中的单因素方差进行分析,表中所有实验数据均以均值±标准差表示。数据显著性利用Tukey test(P<0.05)检验。
2 结果与分析
2.1 总多酚及膳食纤维含量
HBF、IDF-PC、SDF-PC中多酚和膳食纤维含量见表1,3种样品中总多酚含量和膳食纤维含量差异显著(P<0.05)。HBF与IDF-PC和SDF-PC相比,HBF总多酚含量最高,为26.90 μmol FAE/g DS,其次是IDF-PC、SDF-PC,分别为24.45、7.54 μmol FAE/g DS;3种样品中,SDF-PC膳食纤维含量最高,其次为HBF和IDF-PC,分别为99.85%、99.53%、30.76%。
表1 三种样品中总多酚含量和膳食纤维含量
Table 1 The total phenolic and dietary fiber content of three samples

样品总多酚含量/(μmol FAE·g-1 DS)膳食纤维含量/%HBF26.90±0.84c30.76±0.016aIDF-PC24.45±0.21b99.53±0.004bSDF-PC7.54±0.67a99.85±0.013c
注:每列不同小写字母表示差异显著(P<0.05)
2.2 16S rRNA分析微生物的组成
2.2.1 肠道微生物多样性分析
使用the Good′s coverage指数来分析样品的测序覆盖率,HBF、IDF-PC、SDF-PC样品组,空白组B和对照组FA的测序覆盖深度均大于99.56%,说明测序数据量合理。
α多样性分析主要通过丰度指数(Ace指数、Chao1指数)和多样性指数(Shannon指数、Simpson指数)来进行表征,结果见表2,4种样品经结肠发酵后,在前24 h,Ace和Chao1指数呈显著降低趋势(P<0.05),说明微生物的丰度均呈下降趋势,可能由于前24 h多酚对肠道微生物的抑制起主要作用,导致微生物数量下降;24 h后,Ace和Chao1指数变化不明显,说明微生物丰度差异不大,可能由于多酚和膳食纤维的协同调节作用,导致微生物生长趋于平衡。Shannon指数和Simpson指数呈先下降后上升趋势,可能由于发酵前期多酚对微生物的抑制起主导作用,导致微生物多样性指数降低,发酵后期膳食纤维促进了微生物的生长,导致微生物多样性指数升高。HBF、IDF-PC和SDF-PC发酵48 h后,Ace指数、Chao1指数和Shannon指数高于FA对照组,但Simpson指数变化无明显差异,说明膳食纤维多酚对肠道微生物的调节作用优于单一多酚。
HUANG等[24]通过体外实验,发现儿茶素、槲皮素和葛根素能够降低肠道微生物多样性,与本研究结果一致。WANG等[11]利用SDF喂养肥胖小鼠,增加了小鼠肠道微生物的α-多样性,本研究结果与其相反,可能是因为多酚和膳食纤维协同调节作用。
表2 不同样品的丰度和多样性
Table 2 Abundance and diversity of different samples
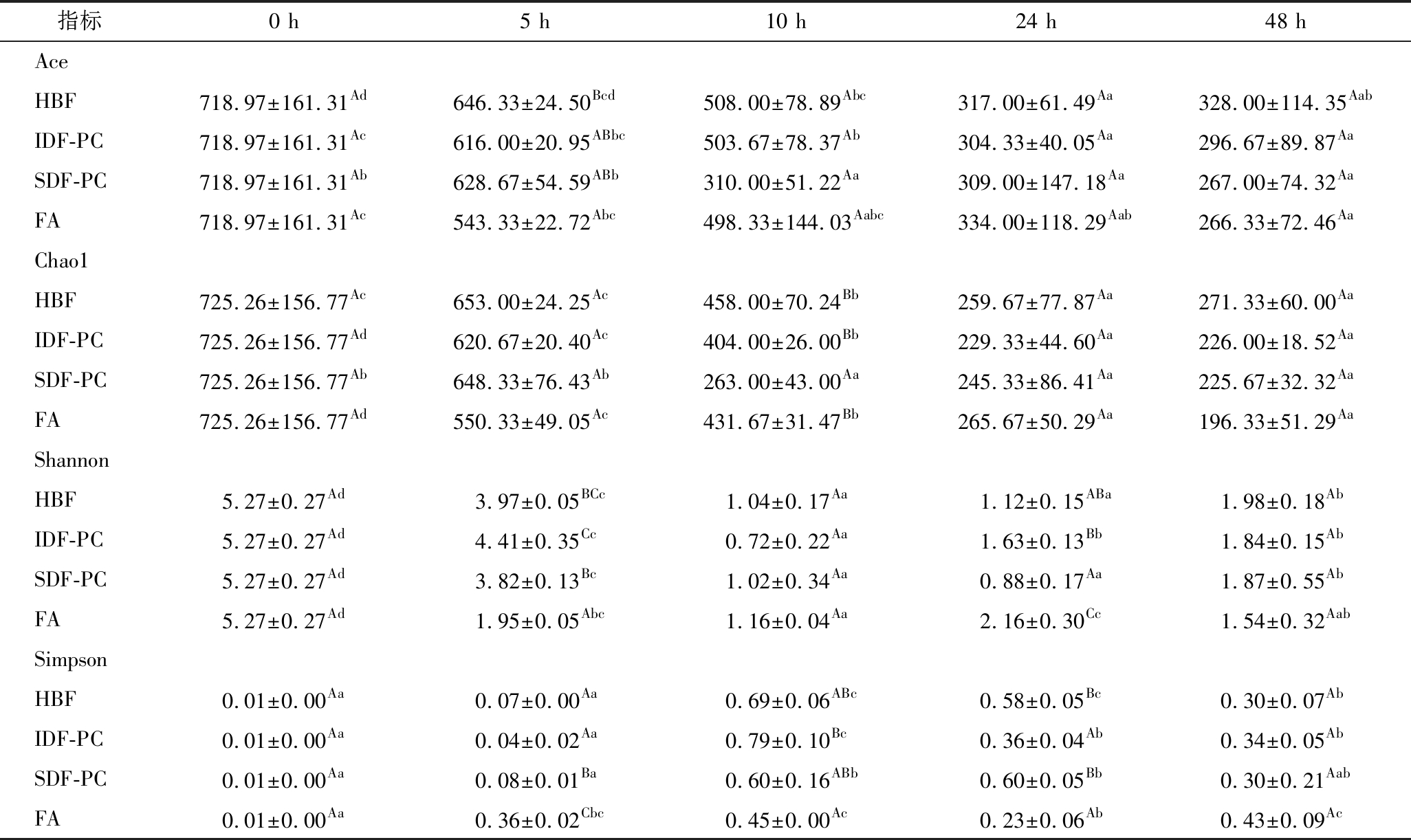
指标0 h5 h10 h24 h48 hAceHBF718.97±161.31Ad646.33±24.50Bcd508.00±78.89Abc317.00±61.49Aa328.00±114.35AabIDF-PC718.97±161.31Ac616.00±20.95ABbc503.67±78.37Ab304.33±40.05Aa296.67±89.87AaSDF-PC718.97±161.31Ab628.67±54.59ABb310.00±51.22Aa309.00±147.18Aa267.00±74.32AaFA718.97±161.31Ac543.33±22.72Abc498.33±144.03Aabc334.00±118.29Aab266.33±72.46AaChao1HBF725.26±156.77Ac653.00±24.25Ac458.00±70.24Bb259.67±77.87Aa271.33±60.00AaIDF-PC725.26±156.77Ad620.67±20.40Ac404.00±26.00Bb229.33±44.60Aa226.00±18.52AaSDF-PC725.26±156.77Ab648.33±76.43Ab263.00±43.00Aa245.33±86.41Aa225.67±32.32AaFA725.26±156.77Ad550.33±49.05Ac431.67±31.47Bb265.67±50.29Aa196.33±51.29AaShannonHBF5.27±0.27Ad3.97±0.05BCc1.04±0.17Aa1.12±0.15ABa1.98±0.18AbIDF-PC5.27±0.27Ad4.41±0.35Cc0.72±0.22Aa1.63±0.13Bb1.84±0.15AbSDF-PC5.27±0.27Ad3.82±0.13Bc1.02±0.34Aa0.88±0.17Aa1.87±0.55AbFA5.27±0.27Ad1.95±0.05Abc1.16±0.04Aa2.16±0.30Cc1.54±0.32AabSimpsonHBF0.01±0.00Aa0.07±0.00Aa0.69±0.06ABc0.58±0.05Bc0.30±0.07AbIDF-PC0.01±0.00Aa0.04±0.02Aa0.79±0.10Bc0.36±0.04Ab0.34±0.05AbSDF-PC0.01±0.00Aa0.08±0.01Ba0.60±0.16ABb0.60±0.05Bb0.30±0.21AabFA0.01±0.00Aa0.36±0.02Cbc0.45±0.00Ac0.23±0.06Ab0.43±0.09Ac
注:每列不同大写字母表示差异显著(P<0.05);每行不同小写字母表示差异显著(P<0.05)
β多样性主要利用PCoA进行研究,结果如图1所示,在5、10 h时,HBF和IDF-PC组相距较近,说明HBF和IDF-PC组的微生物组成较为相似。在24 h时,HBF和SDF-PC组样本混合在一起,说明此时HBF和SDF-PC组的微生物组成相似度较高,而IDF-PC和FA组则相互分开,与其他样本相似度较低。在48 h时,HBF、IDF-PC和FA组彼此之间分离,而SDF-PC间则较为分散,说明此时各组的微生物组成相似度较低。结肠发酵5 h时,不同样品之间清晰分离,说明此时样品对肠道微生物的调节作用最好。结合图3属水平微生物组成分析可知,3种样品对有益菌的调节作用优于FA,进一步说明了膳食纤维和多酚的协同调节作用优于单一多酚。
2.2.2 微生物群落结构分析
门水平微生物群落结构分析如图2所示,HBF、IDF-PC和SDF-PC样品组、B组和FA对照组中主要的优势菌门为厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、梭杆菌门(Fusobacteria)、放线菌门(Actinobacteria)等。LIU等[25]利用动物实验和体外结肠发酵实验研究多酚及膳食纤维对肠道微生物的调节作用,发现厚壁菌门和拟杆菌门为优势菌门,与本研究结果相似。
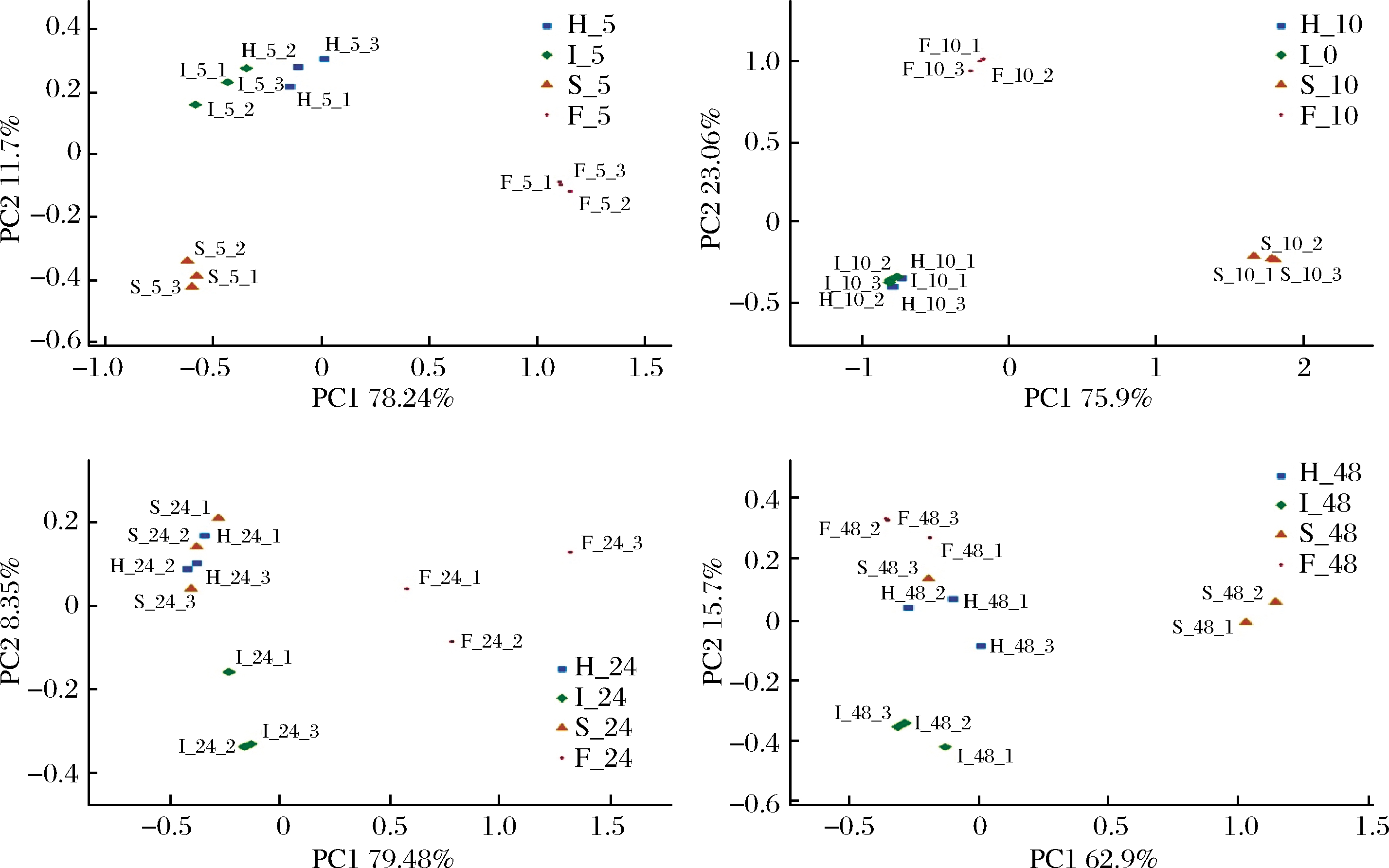
图1 基于OTU丰度的PCoA主坐标分析
Fig.1 PCoA based on OTU abundance
注:F-5、F-10、F-24、F-48、H-5、H-10、H-24、H-48,I-5、I-10、I-24、I-48,S-5、S-10、S-24、S-48分别表示FA,HBF,IDF-PC和SDF-PC发酵5、10、24、48 h
研究表明,厚壁菌门/拟杆菌门比例与体重呈正相关[13,26]。由图2可知,HBF、IDF-PC、SDF-PC样品组和FA对照组经结肠发酵后,肠道微生物菌门厚壁菌门/拟杆菌门的比例在5 h时分别为53.53%、82.39%、96.48%和116.11%;10 h时分别为35.57%、38.74%、33.86%和125.38%;24 h时分别为2.95%、6.26%、4.76%和0.75%;48 h时分别为1.04%、1.74%、3.93%和0.45%,说明随着发酵时间的增加均能够降低肠道微生物菌门厚壁菌门/拟杆菌门的比例。JIN等[27]发现利用葡萄籽提取物灌喂小鼠能够降低肠道微生物中厚壁菌门/拟杆菌门的比例,与本研究结果一致,说明膳食纤维和多酚能够降低厚壁菌门/拟杆菌门的比例,有助于预防肥胖,维持人体健康。

图2 门水平微生物组成
Fig.2 Composition of microbial community at phylum level
属水平微生物群落结构分析见图3和图4。由图3可知,空白组、样品组与对照组对微生物群落结构均具有一定的调节作用。与空白组相比,样品组与对照组在5、10、24、48 h均抑制了部分微生物的生长,包括考拉杆菌属(Phascolarctobacterium)、拟杆菌目S24-7(Bacteroidales-S24-7-group-norank)、颤螺菌属(Oscillospira)、毛螺菌属(Lachnospiraceae-unclassified)、理研菌属RC9(Rikenellaceae-RC9-gut-group)、颤杆菌属(Oscillibacter)、密螺旋体属2(Treponema-2)、拟杆菌目RF16(Bacteroidales-RF16-group-norank)、普雷沃氏菌科NK3B31(Prevotellaceae-NK3B31-group)和普雷沃氏菌科UCG-003(Prevotellaceae-UCG-003)。对照组在4个时间点对拟杆菌目S24-7、颤螺菌属、理研菌属RC9的抑制作用大于3种样品。研究发现,酚类化合物对有害肠道细菌有一定的抑制作用,对有益肠道细菌有一定促进作用[28]。本研究结果可能与酚类化合物的抑菌作用有关。HBF、SDF-PC和IDF-PC之间对微生物的抑制作用无明显差异,可能是3种样品中均含有膳食纤维和多酚,对微生物具有相似的调节作用[2,9]。
与空白组相比,样品组与对照组也促进了部分微生物的生长。在48 h内,样品组与对照组均促进了乳杆菌属(Lactobacillus)、瘤胃菌科UCG-005(Ruminococcaceae-UCG-005)、瘤胃菌科NK4A214 (Ruminococcaceae-NK4A214-group)、艾克曼菌属(Akkermansia)的生长。乳杆菌作为一种益生菌,能够改善肠道微生物平衡,缓解结肠易激综合征[29]。艾克曼菌属(Akkermansia)与高脂饮食诱发的代谢疾病呈负相关[1,29]。瘤胃菌科UCG-005和瘤胃菌科NK4A214能够降解膳食纤维产生短链脂肪酸,调整人体的脂质代谢[29]。与对照组相比,样品组能够明显促进乳杆菌属、瘤胃菌科UCG-005、瘤胃菌科NK4A214-和艾克曼菌属的生长,说明膳食纤维和多酚能够促进部分有益微生物的生长,且对微生物的协同调节作用优于单一多酚。研究发现,膳食纤维和多酚可以促进乳杆菌属、艾克曼菌属、瘤胃菌科UCG-005和瘤胃菌科NK4A214的生长[2,20],与本研究结果一致。在3种样品之间,HBF和IDF-PC对主要优势微生物具有相似的调节作用,SDF-PC对微生物的调节作用与HBF、IDF-PC差别较大,可能是3种样品中膳食纤维和多酚的含量与结构存在差异,导致了不同的微生物调节作用。

图3 属水平的微生物组成
Fig.3 Composotion of microbial community at genus level
图4为丰度前30的OTUs进行分层聚类制作的热图,图中色块颜色代表某一个属相对丰度的大小,每一行代表一种属水平的微生物名称,每一列代表一种样品,能够直观的反应每组之间属水平的微生物丰度变化。由图4可知,与空白组相比,对照组和样品组有不同的微生物图谱,均能够改变微生物群落组成,对肠道微生物具有一定的调节作用。
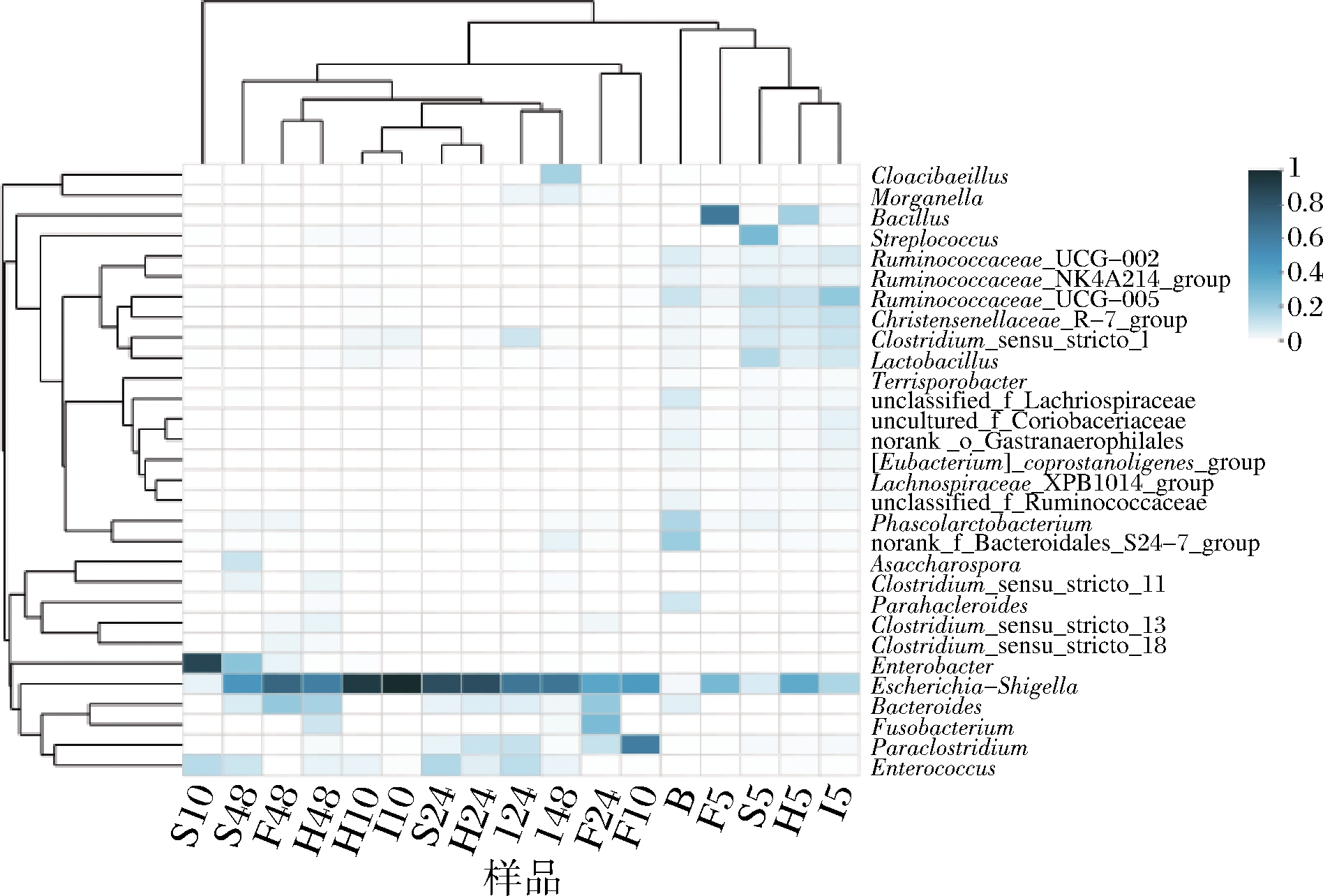
图4 微生物群落在属水平上的相对丰度
Fig.4 The relative abundance of the microorganism community at the taxa level of genus in groups
注:图中仅列出30个属
2.3 短链脂肪酸分析
SCFAs不仅能够为厌氧菌提供能量,促进其生长,还可以降低肠道环境的pH值,抑制有害菌的生长,调节肠道微生物平衡,从而改善肠道紊乱[30]。同时SCFAs也可以为肠上皮细胞提供营养物质,促进肠黏膜生长,维持肠黏膜屏障的完整性,进一步改善肠道功能,促进机体健康[30]。未被上消化道吸收的膳食纤维及多酚,可以在结肠中被肠道微生物群发酵,得到SCFAs,包括甲酸、乙酸、丙酸、丁酸和戊酸等[31],其中乙酸、丙酸、丁酸占SCFAs总量的95%以上,且乙酸是肠道中含量最多的SCFAs[32]。SCFAs的主要产生菌是厚壁菌门、拟杆菌门,为人类肠道中含量最丰富的2个门类[26,33]。厚壁菌门主要产生丁酸,拟杆菌门主要产生乙酸和丙酸[26]。研究表明,葡萄及葡萄酒多酚的摄入可以调节微生物产生SCFAs,促进乙酸、丙酸、丁酸含量增加[32]。
HBF、IDF-PC和SDF-PC经肠道微生物代谢后,产生的3种SCFAs见表3,在3种样品中乙酸是主要短链脂肪酸,显著高于丙酸和丁酸(P<0.05),含量分别为(0.29±0.21)、(0.15±0.05)和(0.14±0.10)mg/mL。HBF中乙酸和丁酸含量显著高于IDF-PC和SDF-PC(P<0.05),分别为(0.29±0.21)和(0.11±0.27)mg/mL,且HBF中的SCFAs含量高于SDF-PC和IDF-PC(P<0.05),为(0.44±0.2) mg/mL。本研究发现,经肠道微生物发酵后,HBF产生的总SCFAs含量最高,其次是IDF-PC和SDF-PC,与3种样品中多酚含量变化趋势相同(表1),可能是由于HBF中含有较高的多酚,能够调节肠道微生物,从而生成较多的SCFAs[16]。
表3 短链脂肪酸含量 单位:mg/mL
Table 3 The concentrations of short chain fatty acid
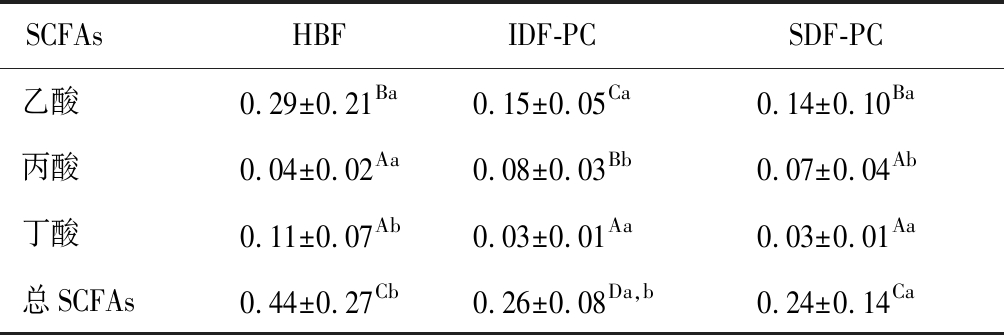
SCFAs HBFIDF-PCSDF-PC乙酸0.29±0.21Ba0.15±0.05Ca0.14±0.10Ba丙酸0.04±0.02Aa0.08±0.03Bb0.07±0.04Ab丁酸0.11±0.07Ab0.03±0.01Aa0.03±0.01Aa总SCFAs0.44±0.27Cb0.26±0.08Da,b0.24±0.14Ca
3 结论
本研究通过高通量测序方法研究了膳食纤维-多酚复合物在体外结肠发酵过程中对肠道微生物的协同调节作用。研究发现,HBF、IDF-PC和SDF-PC中均含有较丰富的膳食纤维和多酚。样品组与对照组相比,均能够增加肠道微生物的丰度和多样性,促进有益菌的生长。同时,能够降低厚壁菌门/拟杆菌门的比例,具有一定预防肥胖的作用。3种样品在肠道微生物的作用下,能够产生较多的SCFAs,其中乙酸含量最高,说明膳食纤维和多酚对肠道微生物具有较好的协同调节作用。本研究为青稞促进机体健康和预防疾病提供科学依据,也为青稞功能食品的开发提供了新思路。
[1] ZHAO L P, ZHANG F, DING X Y, et al.Gut bacteria selectively promoted by dietary fibers alleviate type 2 diabetes[J].Science, 2018, 359(6 380):1 151-1 156.
[2] ANA E.QUIR S S, RAM
S S, RAM N P,
N P, ![]() F A, et al.Impact of Fruit Dietary Dibers and Polyphenols on Modulation of the Human Fut Microbiota:Chemistry and Human Health[M].2th ed.Hoboken:John Wiley & Sons Ltd, 2017.
F A, et al.Impact of Fruit Dietary Dibers and Polyphenols on Modulation of the Human Fut Microbiota:Chemistry and Human Health[M].2th ed.Hoboken:John Wiley & Sons Ltd, 2017.
[3] DUDA-CHODAK A, TARKO T, SATORA P, et al.Interaction of dietary compounds, especially polyphenols, with the intestinal microbiota:A review[J].European Journal of Nutrition, 2015, 54(3):325-341.
[4] 杨华, 叶发银, 赵国华.膳食多酚与肠道微生物相互作用研究进展[J].食品科学, 2015, 36(3):223-227.
YANG H, YE F Y, ZHAO G H.Advances in interaction between gut microflora and dietary polyphenols[J].Food Science, 2015, 36(3):223-227.
[5] S YAGO-AYERDI S G,ZAMORA-GASGA V M,VENEMA K.Prebiotic effect of predigested mango peel on gut microbiota assessed in a dynamic in vitro model of the human colon (TIM-2)[J].Food Research International, 2019, 118:89-95.
YAGO-AYERDI S G,ZAMORA-GASGA V M,VENEMA K.Prebiotic effect of predigested mango peel on gut microbiota assessed in a dynamic in vitro model of the human colon (TIM-2)[J].Food Research International, 2019, 118:89-95.
[6] MARTENS E.Gut microbial degradation of complex carbohydrates in colonic health and disease[J].Environmental and Molecular Mutagenesis, 2015, 56:46-46.
[7] NIV Z, GILI Z, JOTHAM S, et al.Personalized gut mucosal colonization resistance to empiric probiotics is associated with unique host and microbiome features[J].Cell, 2018, 174(6):1 388-1 405.
[8] JOTHAM S, NIV Z, GILI Z, et al.Post-antibiotic gut mucosal microbiome reconstitution is impaired by probiotics and improved by autologous FMT[J].Cell, 2018, 174(6):1 406-1 423.
[9] ABBEELE P V D,DUYSBURGH C,JIANG T A, et al.A combination of xylooligosaccharides and a polyphenol blend affect microbial composition and activity in the distal colon exerting immunomodulating properties on human cells[J].Journal of Functional Foods, 2018, 47:163-171.
[10] PAOLA V, AURORA N, VINCENZO F.Cereal dietary fibre:A natural functional ingredient to deliver phenolic compounds into the gut[J].Trends in Food Science & Technology, 2008, 19(9):451-463.
[11] WANG H Y, HONG T, LI N, et al.Soluble dietary fiber improves energy homeostasis in obese mice by remodeling the gut microbiota[J].Biochem Biophys Res Commun, 2018, 498(1):146-151.
[12] DUE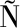 AS M,MU
AS M,MU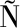 OZ-GONZ
OZ-GONZ LEZ I,CUEVA C, et al.A survey of modulation of gut microbiota by dietary polyphenols[J].BioMed Research International, 2015.DOI:10.11055/2015/850920.
LEZ I,CUEVA C, et al.A survey of modulation of gut microbiota by dietary polyphenols[J].BioMed Research International, 2015.DOI:10.11055/2015/850920.
[13] GONG L X, CAO W Y, GAO J, et al.Whole tibetan hull-less barley exhibit stronger effect on promoting growth of genus bifidobacterium than refined barley in vitro[J].Journal of Food Science, 2018, 83(4):1 116-1 124.
[14] LEE M H. Official methods of analysis of AOAC International (16th edn): Edited by Patricia A. Cunniff, AOAC International, 1995. $359.00 (North America)/$399.00 (elsewhere) (xxvi + 1899 pages) ISBN 0 935 584 54 4[J]. Trends in Food Science & Technology, 1995, 6(11):382.
[15] 李永强, 杨士花, 吴国星, 等.青稞膳食纤维-多酚复合物的制备方法:云南, CN104382020A[P].2015-03-04.
LI Y Q, YANG S H, WU G X, et al.Preparation of Highland Barley Dietary Fiber-polyphenol Complex:Yunnan, CN104382020A[P].2015-03-04.
[16] LI Q, YANG S H, LI Y Q, et al.Comparative evaluation of soluble and insoluble-bound phenolics and antioxidant activity of two chinese mistletoes[J].Molecules, 2018, 23(2):359.
[17] ANOMA C, FEREIDOON S.Bioaccessibility and antioxidant potential of millet grain phenolics as affected by simulated in vitro digestion and microbial fermentation[J].Journal of Functional Foods, 2012, 4(1):226-237.
[18] 邹青飞, 杨士花, 李永强, 等.体外结肠发酵对青稞膳食纤维中酚类化合物的含量及抗氧化活性的影响[J].食品科学, 2020, 41(2):94-100.
ZOU Q F, YANG S H, LI Y Q, et al.Effects of in vitro colonic fermentation on the content and antioxidant activity of phenolic compounds in dietary fiber of highland barley[J].Food Science, 2020, 41(2):94-100.
[19] AURA A M,H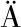 RKÖNEN H,FABRITIUS M, et al.Development of an in vitro enzymic digestion method for removal of starch and protein and assessment of its performance using rye and wheat breads[J].Journal of Cereal Science, 1999, 29(2):139-152.
RKÖNEN H,FABRITIUS M, et al.Development of an in vitro enzymic digestion method for removal of starch and protein and assessment of its performance using rye and wheat breads[J].Journal of Cereal Science, 1999, 29(2):139-152.
[20] PARKAR S G,TROWER T M,STEVENSON D E.Fecal microbial metabolism of polyphenols and its effects on human gut microbiota[J].Anaerobe, 2013, 23:12-19.
[21] QUAST C, PRUESSE E, YILMAZ P, et al.The SILVA ribosomal RNA gene database project:Improved data processing and web-based tools[J].Nucleic Acids Res, 2013, 41:590-596.
[22] WANG Q, GARRITY G M, TIEDJE J M, et al.Naive bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy[J].Appl Environ Microbiol, 2007, 73(16):5 261-5 267.
[23] SCHLOSS P D, GEVERS D, WESTCOTT S L.Reducing the effects of PCR amplification and sequencing artifacts on 16S RNA-based studies[J].Plos One, 2011, 6(12):e27 310.
[24] HUANG J C, CHEN L,XUE B, et al.Different flavonoids can shape unique gut microbiota profile in vitro[J].Journal of Food Ence, 2016, 81(9):2 273-2 279.
[25] LIU S, YU Q, HUANG H, et al.The effect of bound polyphenols on the fermentation and antioxidant properties of carrot dietary fiber in vivo and in vitro[J].Food & Function, 2020, 11(1):748-758.
[26] BISHEHSARI F,ENGEN P A,PREITE N Z, et al.Dietary fiber treatment corrects the composition of gut microbiota, promotes SCFA production, and suppresses colon carcinogenesis[J].Genes, 2018, 9(2):102.
[27] JIN G W, ASOU Y, ISHIYAMA K, et al.Proanthocyanidin-rich grape seed extract modulates intestinal microbiota in ovariectomized mice[J].Journal of Food Ence, 2018, 83(4):1 149-1 152.
[28] LEE H C, JENNER A M,LOW C S, et al.Effect of tea phenolics and their aromatic fecal bacterial metabolites on intestinal microbiota[J].Research in Microbiology, 2006, 157(9):876-884.
[29] 陆佳,方秀才.乳杆菌属治疗肠易激综合征的机制[J].胃肠病学和肝病学杂志, 2017, 26(2):218-221.
LU J, FANG X C.Mechanism of Lactobacillus in the treatment of irritable bowel syndrome[J].Chinese Journal of Gastroenterology and Hepatology, 2017, 26(2):218-221.
[30] CHENG Y X, WU T, CHU X Q, et al.Fermented blueberry pomace with antioxidant properties improves fecal microbiota community structure and short chain fatty acids production in an in vitro mode[J].LWT - Food Science and Technology, 2020, 125:109-118.
[31] SUN M M, WU W, LIU Z J, et al.Microbiota metabolite short chain fatty acids, GPCR, and inflammatory bowel diseases[J].Journal of Gastroenterology, 2017, 52(1):1-8.
[32] PETRA L, HARRY J.F.Formation of propionate and butyrate by the human colonic microbiota[J].Environmental Microbiology, 2017, 19(1):29-41.
[33] ZORRAQU N-PE
N-PE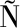 A I,S
A I,S NCHEZ-HERN
NCHEZ-HERN NDEZ E, PURAN B, et al.Current and future experimental approaches in the study of grape and wine polyphenols interacting gut microbiota[J].Journal of the Ence of Food and Agriculture, 2020, 100(10):3 789-3 802.
NDEZ E, PURAN B, et al.Current and future experimental approaches in the study of grape and wine polyphenols interacting gut microbiota[J].Journal of the Ence of Food and Agriculture, 2020, 100(10):3 789-3 802.