根据国际糖尿病联盟的报道,2015年有4.15亿糖尿病(diabetes mellities, DM)患者,其中有500万死于DM。据估计,全球有关于DM导致的健康支出总额为6 730亿元。而且到2045年,全球20~79岁患DM的人数将上升至6.29亿[1]。人体肠道内生活着大约1 000种细菌,其总质量大约为1.5 kg,其细胞总数量是人体自身细胞总数的10倍[2],是人体内基因数量的150倍之多[3]。
迄今为止,DM的发病机制还没有定论,它涉及到环境、遗传、饮食以及其他诸多因素。肠道微生物作为近年来的研究热点,据研究证明其与多种疾病的发生发展密切相关,如DM、营养不良、肿瘤、炎症性肠病等[4]。有相关研究分析了二型糖尿病(type 2 diabetes mellities, T2DM)患者的肠道菌群并将其与正常人的肠道菌群进行对比,结果发现,T2DM患者肠道内的肠道杆菌在不断增加,双歧杆菌及类杆菌的数量在不断减少,且存在肠道菌群失调[5]。一种来自肥胖病人的肠道细菌在无菌小鼠体内引起了严重的肥胖和胰岛素抵抗,为肠道菌群参与人体DM的发生发展提供了直接的实验证据[6]。因此认为肠道菌群在DM的发生发展中具有一定的作用。
蚕蛹蛋白作为一种优质的全价蛋白,其氨基酸配比合理,且必须氨基酸与非必须氨基酸的比值>0.6,优于世界卫生组织提出的全价蛋白的标准[7]。蚕蛹短肽蛋白源肠内营养混悬剂可能通过降低T2DM小鼠α-葡萄糖苷酶活性,显著增强己糖激酶、丙酮酸激酶的活性进而显著降低T2DM小鼠血糖值,缓解T2DM小鼠的肝肾肿大以及血脂代谢紊乱的状况[7]。人体实验表明乳清蛋白可以改善DM患者代谢紊乱,促进胰高血糖素样肽1和抑胃多肽分泌[8]。随着人们对于DM认识的不断深入,其防治策略已经从单纯的控制血糖转变为全面防治心血管疾病以及其他并发症的发生和发展,主要通过调控患者的饮食和生活方式以及实施肠内营养制剂支持等途径实现[9]。鉴于蚕蛹蛋白和乳清蛋白在调节T2DM代谢方面的优良特性,本实验参照特殊医学用途配方食品通则GB 29922—2013设计出2款不同蛋白源的DM病人专用的特殊医学用途配方食品,比较了不同蛋白源肠内营养混悬剂对高脂饮食加链脲佐菌素(streptozotocin,STZ)诱导的T2DM小鼠糖代谢和肠道菌群的影响,探究肠内营养混悬剂是否通过肠道菌群影响T2DM的发生和发展。
1 材料与方法
1.1 材料与仪器
1.1.1 材料
蚕蛹蛋白粉(85%),南通福尔生物制品有限公司;乳清蛋白粉(80%),汤臣倍健股份有限公司;维生素及矿物质混合粉,河南坚久实业有限公司;STZ, Sigma Chemical;水合氯醛、柠檬酸钠、柠檬酸、葡萄糖(分析纯),国药化学试剂有限公司。
1.1.2 实验动物购买及分组
60只SPF级雄性ICR小鼠(体重18~22 g),购于北京维通利华动物公司,分组情况如表1所示。
表1 实验动物分组及营养支持
Table 1 Animal grouping and nutritional support

组名营养支持STZ注射空白组(BG)正常饮食√阳性对照组(PG)雅培益力佳SR配方粉√蚕蛹蛋白结合乳清蛋白组(LCSSPG)蚕蛹蛋白结合乳清蛋白ENF√蚕蛹蛋白组(SPPG)蚕蛹蛋白ENF√对照组(CG)正常饮食X
1.1.3 仪器与设备
GA-3型血糖仪,三诺生物传感股份有限公司;QIAmp powerfecal DNA kit(50),上海联硕生物科技有限公司。
1.2 实验方法
1.2.1 蚕蛹蛋白源肠内营养混悬剂制备
使用了2种不同的蛋白质:蚕蛹蛋白和乳清蛋白。LCSSPG中蚕蛹蛋白和乳清蛋白各添加11.5%(质量分数,下同),在SPPG中添加23%的蚕蛹蛋白。各配方中还添加了5%鱼油粉,15%橄榄油粉,12%玉米淀粉,17.5%木薯淀粉,9%低聚糖果糖,5%异麦芽酮糖,0.2%香草香精,3.3%维生素和矿物质混合物,10%膳食纤维(菊粉)。所有原料均为食品级,并符合特殊医学用途配方食品通则(GB 29922—2013)的规定。
1.2.2 实验动物造模
60只雄性ICR小鼠经1周适应性喂养后随机分为5组,实验动物经口投喂情况见表1。实验期间,动物房保持温度(22±2) ℃,湿度(55±5)%,12 h光照/暗循环。除对照组外,其余组小鼠均给予8周高脂饮食诱导。小鼠禁食不禁水12 h后腹腔注射55 mg/kg STZ(将STZ溶于0.1 mol/L pH 4.5柠檬酸缓冲液中,按照空腹体重注射相应的STZ,在30 min内注射完毕[10])。对照组注射相同剂量的柠檬酸钠缓冲溶液。将空腹血糖值(fasting blood glucose, FBG)>11.1 mmol/L,随机血糖值>16.7 mmol/L的小鼠确定为T2DM。对各组小鼠造模后第3天、第7天以及第14天FBG进行测定,待其稳定后进行肠内营养治疗[10]。该动物研究遵循ARRIVE(动物研究:体内实验报告)指南,并得到上海海洋大学动物实验中心动物保护和使用委员会的批准。
1.2.3 口服葡萄糖耐量试验及血糖测定
每周日上午9点尾静脉采血测量空腹血糖,禁食6 h后测量FBG并于禁食前1天称量小鼠体重并记录。在小鼠喂养第2周、第10周(造模成功后)、第15周(治疗结束后)进行口服葡萄糖耐量(oral glucose tolreance test, OGTT)实验。将5组小鼠禁食不禁水12 h,测定小鼠灌胃2 g/kg体重葡萄糖后[11]0、30、60、120 min的血糖值,并计算葡萄糖耐量曲线下面积(area under curve number, AUC)。
1.2.4 小鼠粪便中肠道菌群的16S rRNA V3~V4区测序
在无菌条件下,于第2周、第10周、第15周每组固定取3只小鼠采用提尾刺激法采集粪便样品。将收集的样品置于无菌离心管中,称重后迅速液氮速冻并转移至-80 ℃冰箱保存待测[12]。用QIAmp powerfecal DNA kit(50)提取DNA,干冰运输至武汉华大基因科技有限公司进行16S rRNA V3~V4区测序。
1.2.5 统计方法
利用软件USEARCH(v7.0.1090)将拼接好的Tags聚类为操作分类单元(operational taxonomic units,OTU)。然后用R(v3.1.1) 的ade4包做主成分分析(principal components analysis,PCA),距离矩阵为unweighted unifrac 算法使用软件:用R(v3.2.1) 的mixOmics包做PLS-DA(partial least squares discrimination analysis)分析。用Kruskal-Wallis Test法比较组间关系。用RDP classifier 贝叶斯算法对OTU 代表序列进行分类学分析,并在界、门、纲、目、科和属水平统计各样本的群落组成。使用软件R(v3.4.1)绘制物种丰度柱状图,门水平画所有物种的柱状图, 从纲水平开始,将物种丰度在所有样品均低于0.5% 的物种全部合并成Others。用Graph Pad Prism 5软件对血糖值测定结果进行统计分析, 数据采用平均值±标准差表示, 其中P<0.05表示有显著性差异,P<0.01表示差异极显著。
2 结果与分析
2.1 不同蛋白源肠内营养混悬剂干预小鼠菌群结构β多样性分析
采用PCA分析小鼠肠道菌群β多样性,结果如图1所示。有研究表明,T2DM小鼠肠道菌群结构与正常小鼠存在显著性差异[13-14]。在基于OTU的单个样品水平上,第10周T2DM小鼠(SPPG8、LCSSPG8、PG8、BG8)和第1周CG1小鼠在PC1方向分开,说明PC1方向可能代表小鼠是否患有糖尿病。治疗后,SPPG小鼠肠道菌群最接近CG,LCSSPG和PG小鼠次之。PLS-DA分析结果显示,各治疗组(SPPG13、LCSSPG13和BGT13)治疗后小鼠肠道菌群居于CG13~BG13,可能是因为肠内营养混悬剂具有一定的降血糖效果,但并没有将血糖控制在正常范围内。
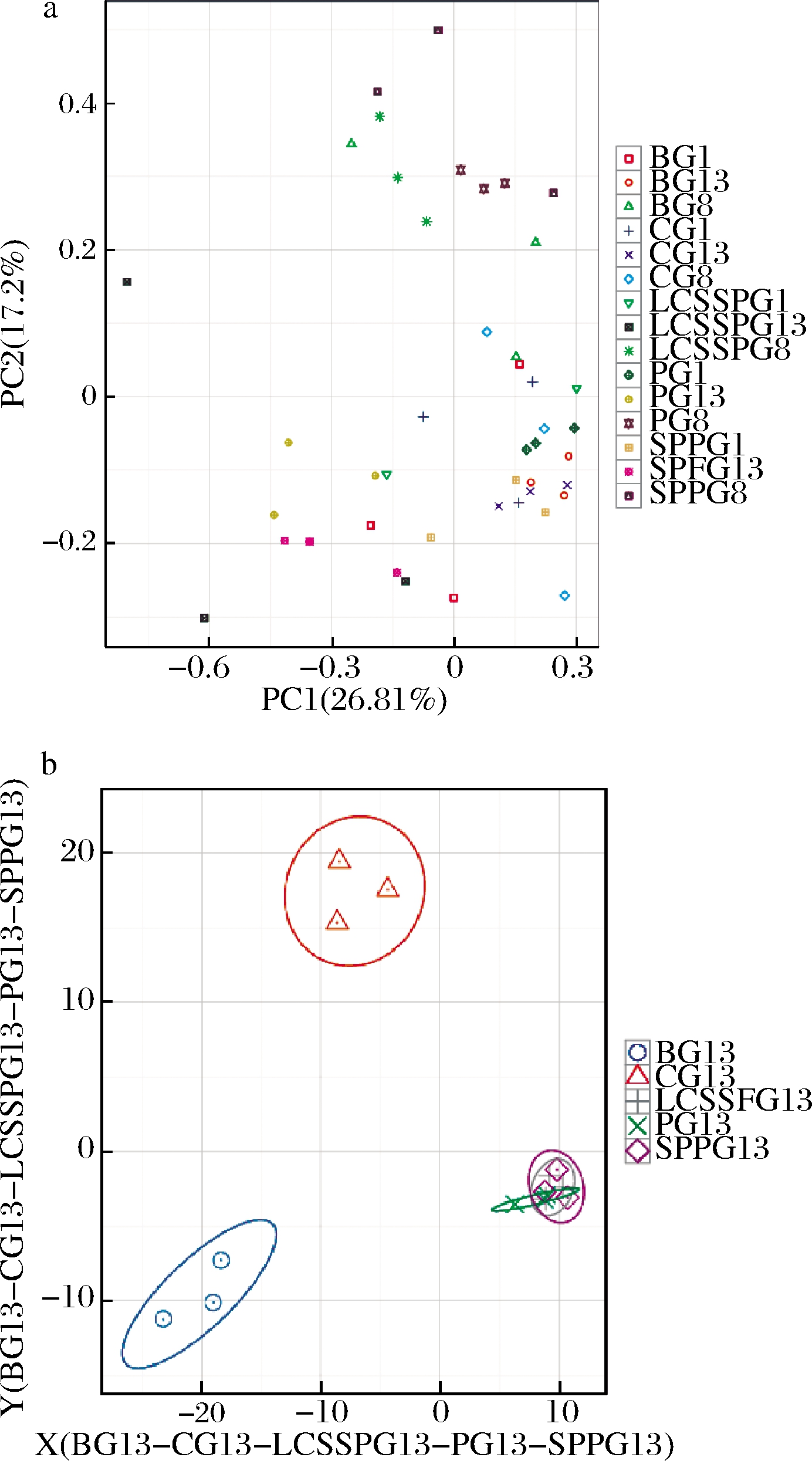
a-PCA分析;b-PLS-DA分析
图1 各组小鼠肠道菌群β多样性分析
Fig.1 Effect of enteral nutritional support on beta diversity analysis of gut microbiota
注:图1-a中2个样品在图上距离越近,表示这2个样品的组成越相似; 不同处理的样品可能表现出分散和聚集的情况;组名+1: 高脂饮食喂养之前;组名+8:造模后;组名+13:肠内营养治疗后
2.2 不同蛋白源肠内营养混悬剂对T2DM小鼠肠道菌群组成的影响
肠内营养治疗作为T2DM患者的一种辅助支持手段之一,在延缓患者餐后血糖上升,调节脂肪和蛋白质代谢紊乱中起一定的作用。因肠内营养混悬剂多为混合产品制剂,人们对于其中单一添加组分作用效果和作用机理的研究已经逐渐完善,但对于复合配方的作用机理和效果的研究还不够全面和深入,因此本实验通过生物信息学方法对T2DM小鼠的肠道菌群进行分析。BG与CG肠道菌群组成在门水平存在显著性差异。治疗前T2DM小鼠肠道菌群主要由Firmicutes、Proteobacteria、Bacteroidetes和TM7组成,各菌门的相对含量分别为36.54%、4%、52.36%和6% (图2-a)。实验结果表明在门水平,与CG相比,T2DM小鼠Frimicutes/Bacteroidetes显著升高(P<0.05)。治疗后,SPPG和PG中Frimicutes/Bacteroidetes有所降低并且接近CG。有研究表明T2DM患者体内Frimicutes/Bacteroidetes显著低于对照组,且与口服葡萄糖耐量测试中血糖水平升高呈正相关[15]。但在LARSEN等[16]的研究中,Frimicutes/Bacteroidetes与血糖浓度呈负相关。因此Bacteroidetes与Frimicutes的相对丰度能否作为T2DM检测的有效指标还有待进一步的研究。
与门水平不同,纲或者更高分类水平的变化(如机会致病菌增加、短链脂肪酸产生菌减少)与DM密切相关。据一项受试者高达345人的大规模宏基因组研究证实,以机会致病菌增加,硫酸盐还原菌还原能力增强,抗氧化应激相关菌群应激能力增强,短链脂肪酸(主要为丁酸)产生菌含量减少为特征的中等程度的肠道菌群紊乱,是T2DM患者肠道菌群的主要结构特点,但T2DM患者与对照组患者的肠道菌群多样性无显著性差异[17]。科水平的结果(图2-b)显示治疗后,各治疗组Bacteroidaceae和Porphyromonadaceae菌科的相对丰度显著降低(P<0.05)。与BG相比,SPPG和PG中Lachnospiraceae菌科相对丰度有所升高。治疗后,与BG相比,LCSSPG中S24-7和Porphyromonadaceae菌科相对丰度显著降低(P<0.05),Lachnospiraceae菌科相对丰度有所升高。Bacteroidetes中包含很多与丙酸产生有关的属,可以通过游离脂肪酸受体3抑制高脂饮食诱导的肥胖和胰岛素抵抗[18]。Lachnospiraceae菌可以帮助分解膳食纤维,从而为短链脂肪酸的合成提供底物。菊粉不能被人体消化吸收,但是可以被结肠中的肠道菌群利用,代谢后产生短链脂肪酸。短链脂肪酸不仅能与肠道细胞表面的G蛋白偶联受体41/43结合,还可以刺激肠道细胞表达胰高血糖素样肽-1进而调控葡萄糖代谢[19]。因此,SPPG可能通过短链脂肪酸介导的途径缓解T2DM的发生和发展。属水平的测序结果如图2-c所示。与CG相比,T2DM导致小鼠肠道中Oscillospira、Bacteroide、Odoribacter和Clostridium菌属相对丰度有所增加。LCSSPG小鼠肠道中Lactobacillus和Akkermansia菌属相对丰度与BG相比有所增加,Prevotella菌属有所减少。据研究表明机体免疫系统、肠道菌群以及葡萄糖代谢三者之间存在重要关联,发现消化道中名为Akkermansia的细菌能够帮助调节机体的葡萄糖代谢[20]。T2DM患者肠道内Lactobacillus菌属的相对含量显著降低,经热量限制治疗后,T2DM患者代谢紊乱症状有所改善,并且Lactobacillus菌属的相对含量显著升高[21]。极低热量饮食及益生菌Lactobacillus rhamnosus的摄入可以有效抑制糖尿病的发生[22]。SPPG和LCSSPG可能是通过选择性促进与机体糖代谢以及短链脂肪酸产生相关的菌群进而延缓T2DM的发生和发展。
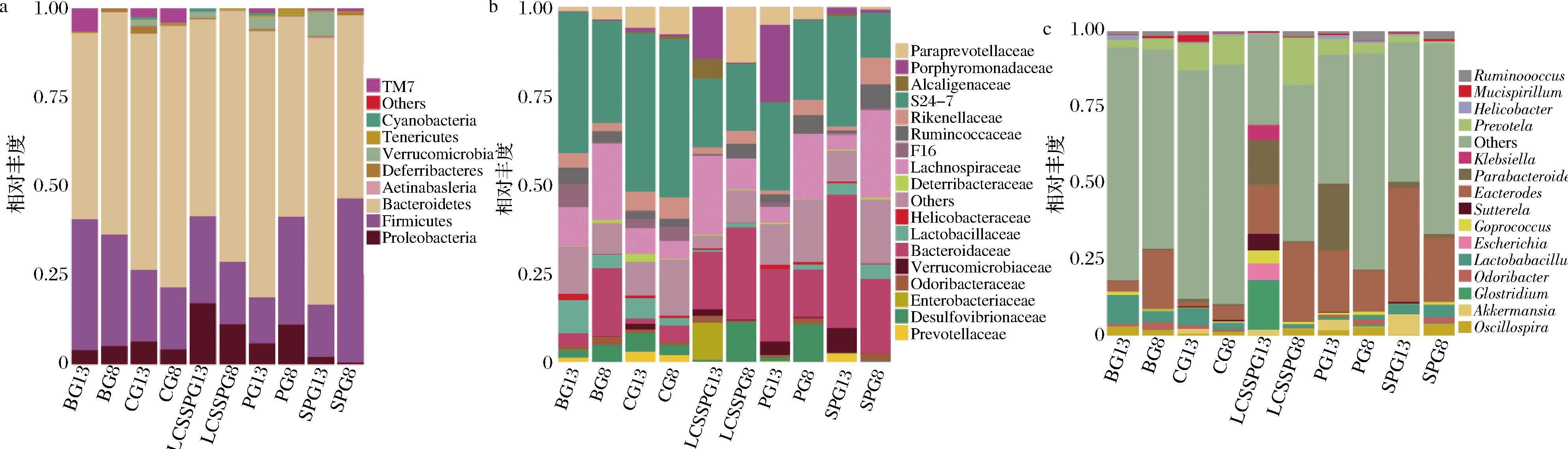
a-门水平;b-科水平;c-属水平
图2 各组小鼠样品在治疗前后肠道菌群组成的差异
Fig.2 Relative abundance of different species of gut mocrobiota of mice in different groups
2.3 不同蛋白源肠内营养混悬剂对T2DM小鼠血糖的影响
实验期间小鼠血糖变化情况如图3-a所示。治疗后,各治疗组小鼠FBG值和AUC值显著降低,各治疗组均与BG存在显著性差异(P<0.05)。综合结果显示SPPG治疗效果最明显,LCSSPG次之,且2组治疗效果均优于PG。适量补充乳清蛋白有助于T2DM患者血糖和血脂控制[23],蚕蛹蛋白及其水解后得到的肽类也具有很强的α-葡萄糖苷酶抑制活性因此可以延缓餐后血糖上升[24]。本实验制得的2种不同蛋白源肠内营养混悬剂含木薯淀粉、低聚果糖、玉米淀粉等缓释碳水化合物,可以延缓DM病人餐后血糖急剧上升。选用高单不饱和脂肪酸配方,可以代替碳水化合物供能,提高脂肪供能比,另外特别添加10 g/100g膳食纤维,不仅可以增加产品的黏稠度,还能延长胃排空时间进而延缓机体吸收和利用葡萄糖,降低产品的升糖指数,稳定餐后血糖。不同蛋白源肠内营养混悬剂在改善小鼠糖代谢紊乱方面不具有显著性差异,可能是因为各配方之间除蛋白质来源不同外,其余组分均相同。蛋白质来源不同的肠内营养混悬剂对T2DM小鼠的糖代谢调节作用影响不大,但具体的原因有待进一步的研究。
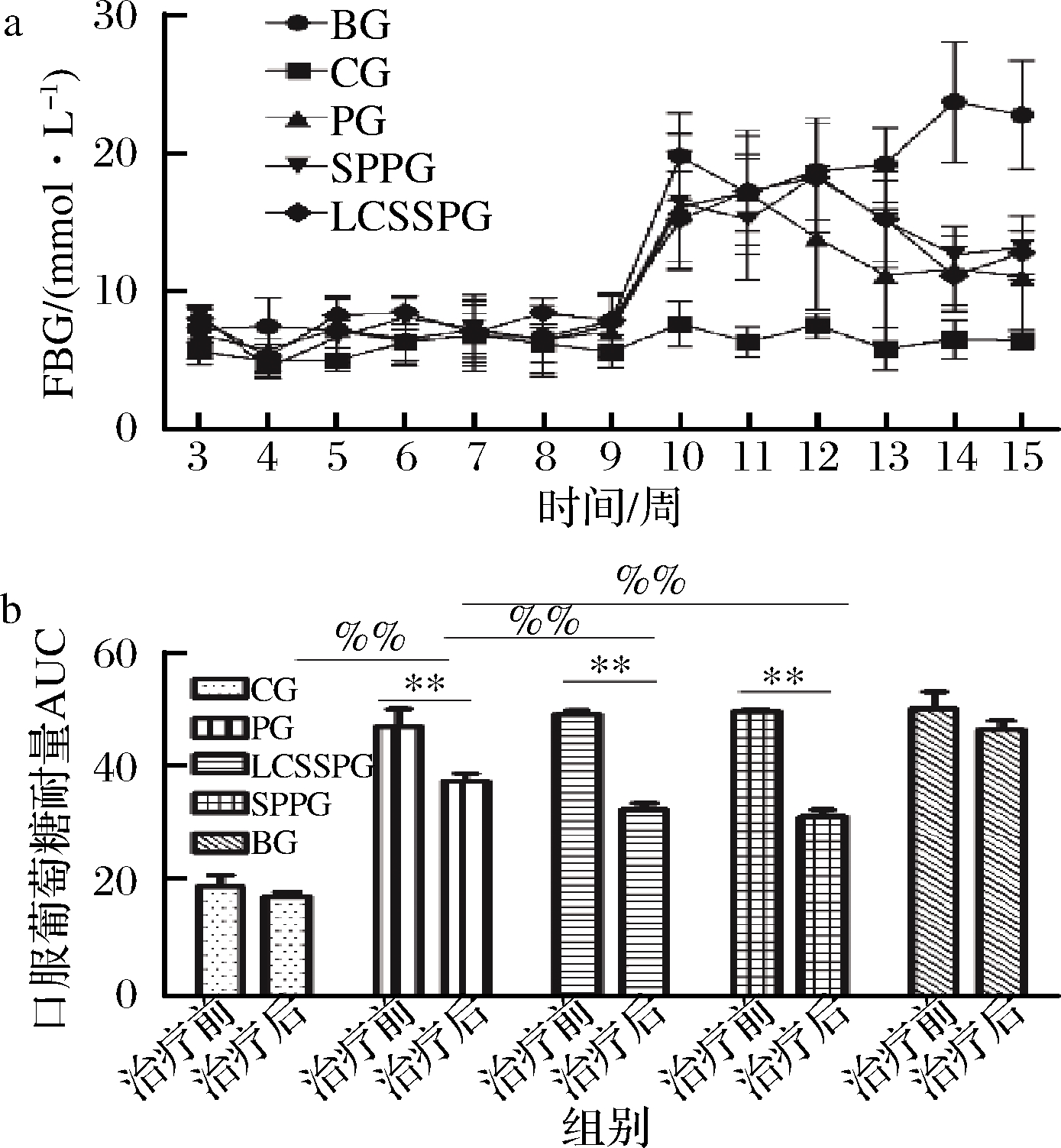
a-小鼠FBG值变化;b-小鼠口服葡萄糖耐量AUC变化
图3 不同蛋白源肠内营养支持对小鼠血糖的影响
Fig.3 Effect of enteral nutritional formula support on the blood glucose of T2DM mice
注:与对照组相比,%%表示P<0.01;与治疗前相比,**表示P<0.01
3 结论
肠内营养治疗改善肠道菌群的结构和组成成分有助于T2DM小鼠血糖控制。经过肠内营养治疗后的T2DM小鼠肠道菌群组成成分更接近正常小鼠,部分机会致病菌相对丰度显著降低,部分有益菌相对丰度显著升高。SPPG的代谢调节以及肠道菌群调节效果优于PG。3种不同蛋白源肠内营养混悬剂诱导的小鼠肠道菌群结构变化不具有统计学意义。然而本实验的样本量较少,需要进行大量样本采集以便深入探究不同蛋白源肠内营养混悬剂对T2DM患者肠道菌群的影响,为T2DM的治疗提供新思路。
[1] OGURTSOVA K, ROCHA FERNANDES J D D, HUANG Y, et al.IDF diabetes atlas:Global estimates for the prevalence of diabetes for 2015 and 2040[J].Diabetes Research and Clinical Practice, 2011, 128(3):40-50.
[2] MORENO-INDIAS I, CARDONA F, TINAHONES F J, et al.Impact of the gut microbiota on the development of obesity and type 2 diabetes mellitus[J].Frontiers in Microbiology, 2014(5):190.
[3] QIN J J, LI R Q, RAES J, et al.A human gut microbial gene catalogue established by metagenomic sequencing[J].Nature, 2010, 464(7 285):59-65.
[4] 郭慧玲. 肠道菌群与疾病关系的研究进展[J].微生物学通报, 2015, 42(2):400-410.
GUO H L.Research on the relation between gastrointestinal microbiota and disease[J].Microbiology China, 2015, 42(2):400-410.
[5] 张弘超,金英朝,李成镇,等.糖尿病患者肠道菌群研究[J].糖尿病新世界, 2016,19(15):113-114.
ZHANG H C, JIN Y C, LI C Z, et al.Study on the gut microbiota of diabetic patients[J].Diabetes New World, 2016,19(15):113-114.
[6] FEI N, ZHAO L P.An opportunistic pathogen isolated from the gut of an obese human causes obesity in germfree mice[J].Isme Journal Multidisciplinary Journal of Microbial Ecology, 2013, 7(4):880-884.
[7] 赵清波. 蚕蛹蛋白肠内营养制剂干预Ⅱ型糖尿病小鼠代谢特性的研究[D].上海:上海海洋大学, 2015.
ZHAO Q B.Metabolic mechanisms of silkworm pupa peptide based enteral formula for supporting type 2 diabetes mellitus in streptozotocin induced mice[D].Shanghai:Shanghai Ocean University, 2015.
[8] 尹丽. 乳清蛋白可以降低高血压和糖尿病患病风险[J].中外健康文摘, 2008(2):73.
YIN L.Whey protein can reduce the risk of high blood pressure and diabetes[J].The Chinese and Foreign Health Abstract, 2008(2):73.
[9] PAUL I C, GEORG Z, SHINICHI S A, Towards standards for human fecal sample processing in metagenomic studies[J].Nature Biotechnology, 2017,35(11):1 069-1 076.
[10] 何静,高婉婷,明亮,等.驼乳对Ⅱ型糖尿病小鼠的糖脂代谢及胰岛素抵抗的影响[J].中国食品学报, 2019, 19(3):115-120.
HE J, GAO W T, MING L, et al.Effect of camel milk on glucose and lipid metabolism and insulin resistance in type Ⅱ diabetic mice[J].Journal of Chinese Institute of Food Science and Technology, 2019, 19(3):115-120.
[11] 李金磊. 黄芪散改善二型糖尿病胰岛素抵抗模型小鼠糖脂代谢及其机制研究[D].广州:广州中医药大学, 2014.
LI J L.Research on Huang Qi San improving glucose and lipid metabolism in C57BL/6j T2DM-IR mice and its mechanism[D].Guangzhou:Guangzhou University of Chinese Medicine, 2014.
[12] 李爽. 基于高通量测序研究陈皮提取物对高脂饮食小鼠肠道菌群的影响[D].哈尔滨:东北农业大学,2017.
LI S.Effects of Chenpi extract on intestinal flora of high-fat diet based on high-throughput sequencing[D].Harbin:Northeast Agricultural University, 2017.
[13] EVERARD A, BELZER C, GEURTS L, et al.Cross-talk between Akkermansia muciniphila and intestinal epithelium controls diet-induced obesity[J].Proceedings of the National Academy of Sciences, 2013, 110(22):9 066-9 071.
[14] ZHAO L P, ZHANG F, DING X Y, et al.Gut bacteria selectively promoted by dietary fibers alleviate type 2 diabetes[J].Science, 2018, 359(6 380):1 151-1 156.
[15] KARLSSON F H, TREMAROLI V, NOOKAEW I, et al.Gut metagenome in European women with normal, impaired and diabetic glucose control[J].Nature, 2013, 498(7 452):99-103.
[16] LARSEN N, FINN K. V, FRANS W. J,et al. Gut microbiota in human adults with type 2 diabetesdiffers from non-diabetic adults[J]. PLoS One,2010, 5(2): e9 085.
[17] QIN J J, LI Y G, CAI Z M, et al.A metagenome-wide association study of gut microbiota in type 2 diabetes[J].Nature, 2012, 490(7 418):55-60.
[18] LIN H V, FRASSETTO A, JR E J K, et al.Butyrate and propionate protect against diet-induced obesity and regulate gut hormones via free fatty acid receptor 3-independent mechanisms[J].PloS One, 2012, 7(4):e35 240.
[19] SONG X F, ZHONG L, LYU N, et al.Inulin can alleviate metabolism disorders in ob/ob mice by partially restoring leptin-related pathways mediated by gut microbiota[J].Genomics Proteomics Bioinformatics, 2019,17(1):64-75.
[20] GREER R L, DONG X X, MORAES A C F D, et al.Akkermansia muciniphila mediates negative effects of IFNγ on glucose metabolism[J].Nature Communications, 2016, 7(1):13 329.
[21] WEI S Y, HAN R M, ZHAO J G, et al.Intermittent administration of a fasting-mimicking diet intervenes in diabetes progression, restores β cells and reconstructs gut microbiota in mice[J].Nutrition & Metabolism, 2018, 15(1):1-12.
[22] MURPHY R K. Fasting and probiotics may help prevent diabetes[J].Medical Express, 2016.11(1):1-6
[23] 冯筱青, 黄陈, 邹洁,等.乳清蛋白预进餐对2型糖尿病患者餐后血糖的影响研究[J].中国食物与营养, 2014,20(11):78-80.
FENG X Q, HUANG C, ZOU J, et al.Effect of pre-meal with whey protein on postprandial blood glucose in patients with type 2 diabetes[J].Food and Nutrition in China, 2014,20(11):78-80.
[24] ZHANG Y, WANG N, WANG W, et al.Molecular mechanisms of novel peptides from silkworm pupae that inhibit α-glucosidase[J].Peptides,2016(76):45-50.