益生菌是一类对宿主有益的活性微生物,能产生确切的健康功效从而改善宿主微生态平衡。近年来,我国对益生菌的研究不断深入,益生菌产业已成为我国食品工业中增长较快、创新密集的产业[1]。双歧杆菌是益生菌研究和使用的主要对象之一,也是人体空肠中发现的最为重要的细菌,其数量可随着肠道延伸不断增加,在肠道中其他菌的数量也与双歧杆菌的生长直接相关[2-3]。乳双歧杆菌XLTG11是1株分离自健康婴儿肠道具有优良益生特性的双歧杆菌,目前国内外对于乳双歧杆菌XLTG11的免疫调节作用未见报道。本实验使用环磷酰胺(cyclophosphamide, CTX)建立免疫抑制模型小鼠,通过检测模型小鼠的全血白细胞数目、血清溶血素水平(HC50值)和脾淋巴细胞亚群百分比,探讨乳双歧杆菌XLTG11对宿主体液免疫和细胞免疫功能的调节作用。
1 材料与方法
1.1 材料与仪器
6~8周龄健康SPF级雄性BALB/c小鼠(18~22 g),辽宁长生生物技术股份有限公司,实验动物饲养于屏障环境动物室,期间自由饮水、摄食,温度控制在20~23 ℃,12 h明暗交替;乳双歧杆菌XLTG11菌粉,葵花药业集团股份有限公司;注射用CTX冻干粉,江苏恒瑞医药股份有限公司;盐酸左旋咪唑(levamisole hydrochloride,LEV),山西太原药业有限公司;绵羊红细胞(sheep red blood cell,SRBC)、都氏试剂和SA缓冲液,上海源叶生物科技有限公司;补体(豚鼠血清),玉环市南方试剂有限公司;胎牛血清(fetal bovine serum,FBS)和胶原酶Ⅳ(>160 U/mg),美国Gibco公司;磷酸盐缓冲液(phosphate buffer solution,PBS)和中性蛋白酶(50 U/mg),北京索莱宝科技有限公司;小鼠荧光单抗CD3-FITC(100203)、CD4-APC-Cy5.5(100433)、CD8a-PE(100707)和CD19-APC(115512),安诺论(北京)生物科技有限公司。
MLS-3751L-PC高压蒸汽灭菌器、MDF-382E -80 ℃冰箱,日本Panasonic公司;SORVALL ST8/8R低温离心机,美国TOMOS公司;NovoCyte3110流式细胞仪,美国Agilent公司;SMATBCD Synergy MX全自动酶标仪,美国BIOTEK公司。
1.2 实验方法
1.2.1 实验分组及受试样品给予
所有动物操作均按照黑龙江中医药大学《实验动物管理条例》进行,实验经黑龙江中医药大学动物伦理委员会批准(伦理审批代码:2020110401)。BALB/c小鼠适应性饲养7 d后,随机分为空白组、CTX组、LEV组、4个乳双歧杆菌XLTG11不同剂量组,共计7组,每组8只。各组小鼠于每日上午8点半分别灌胃给予生理盐水(空白组和环磷酰胺组),LEV(盐酸左旋咪唑组,10 mg/kg),以及乳双歧杆菌XLTG11(2.5×106、2.5×107、2.5×108和2.5×109 CFU/mL组),连续给予28 d。除空白组外,其余各组小鼠分别于灌胃的第23,24天腹腔注射CTX(40 mg/kg),建立免疫功能低下模型。
1.2.2 检测指标
1.2.2.1 白细胞总数的测定
在末次给药0.5 h后,采集小鼠眼球全血,加入含有抗凝剂的离心管中,用全血细胞分析仪检测白细胞总数。
1.2.2.2 血清溶血素的测定
于灌胃给予后第24天,各组小鼠腹腔注射体积分数2%的SRBC 0.2 mL进行免疫。5 d后,即灌胃给予的第28天,摘除眼球取血于离心管内,放置约1 h,2 000 r/min离心10 min,收集血清,将血清与生理盐水按1∶100体积比稀释。具体步骤参考文献[4],最后使用全自动酶标仪测定各孔混合溶液光密度值。溶血素的量以半数溶血值(HC50)表示,HC50计算如公式(1)所示:
样品![]()
(1)
1.2.2.3 脾淋巴细胞亚群百分比检测
末次给药0.5 h后,颈椎脱臼处死小鼠,分离脾脏放入生理盐水中清洗,用滤纸去掉多余水分,立即放入组织保存液中待用。
单细胞悬液制备:将小鼠脾脏剪碎,使用酶混液消化,37 ℃孵育1 h,加入10% FBS,研磨过滤后于4 ℃离心5 min,弃上清液。加入10倍细胞体积的红细胞裂解液,轻轻吹打混匀,裂解2 min后于4 ℃离心5 min,弃上清液。加入适量PBS,重悬沉淀,于4 ℃离心5 min,弃上清液,洗涤1~2次。最后用100 μL的PBS重悬细胞沉淀后进行染色。
流式细胞仪检测脾淋巴细胞膜表面标志物:将CD3-FITC、CD19-APC、CD4-APC-Cy5.5和CD8a-PE表面抗体按照一定的稀释比例加入细胞悬液中,4 ℃避光孵育30 min,染色后的细胞于4 ℃离心5 min,弃上清液。加入500 μL的PBS重悬细胞沉淀,过0.22 μmol/L滤网后上机。择通道FITC、APC、PE和PerCP/Cyanine 5.5,上机1×105个细胞,进行分析。结果以CD3+、CD19+、CD4+CD8-和CD4-CD8+的百分比表示乳双歧杆菌XLTG11对小鼠脾淋巴细胞亚群的影响。
1.2.3 统计学分析
采用SPSS 26.0统计软件,实验结果采用平均数±标准差![]() 表示,单因素方差分析方法进行数据处理,最小显著性差异法(least significant difference,LSD)进行两两比较,P<0.05具有显著性差异。
表示,单因素方差分析方法进行数据处理,最小显著性差异法(least significant difference,LSD)进行两两比较,P<0.05具有显著性差异。
2 结果与分析
2.1 白细胞总数的测定
乳双歧杆菌XLTG11不同剂量对CTX小鼠全血白细胞(white blood cell,WBC)总数的影响如图1所示。与空白组比较,CTX组小鼠白细胞总数显著降低(P<0.001)。与CTX组比较,LEV组小鼠全血白细胞总数增加(P<0.05),乳双歧杆菌(2.5×109 CFU/mL)组小鼠全血白细胞总数显著增加(P<0.01)。
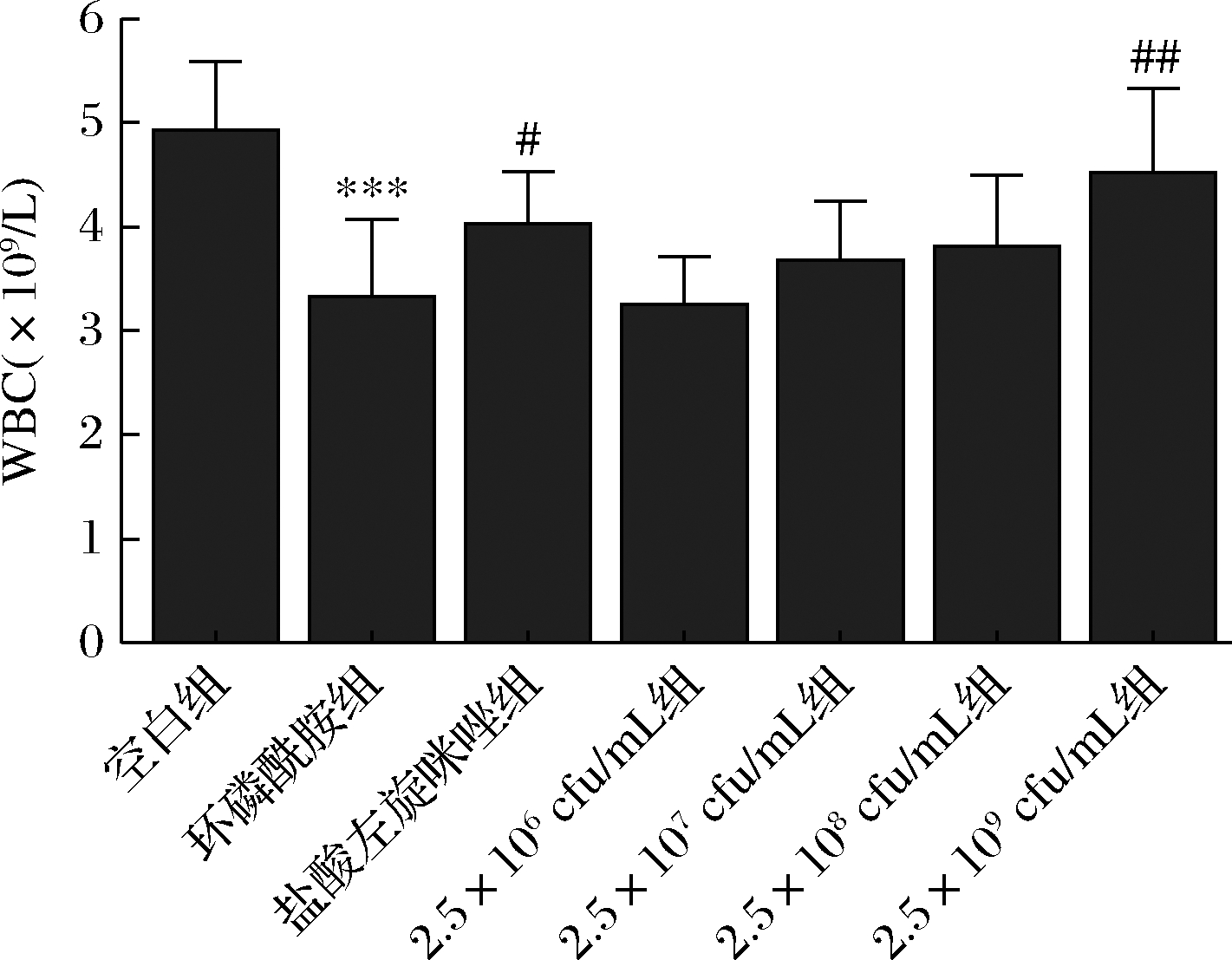
图1 XLTG11不同剂量组对CTX小鼠全血白细胞数目的影响
Fig.1 Effect of different doses of XLTG11 on total white blood cell of CTX mice
注:*** P<0.001,与空白组相比;#P<0.05,## P<0.01,与模型组相比
2.2 血清溶血素的测定
乳双歧杆菌XLTG11不同剂量对CTX小鼠HC50的影响如图2所示。与空白组比较,CTX组小鼠HC50值显著降低(P<0.001)。与CTX组比较,LEV组小鼠HC50值增加(P<0.01),乳双歧杆菌XLTG11(2.5×106 CFU/mL)和(2.5×107 CFU/mL)组小鼠HC50值增加(P<0.05),XLTG11(2.5×108 CFU/mL)和(2.5×109 CFU/mL)组小鼠HC50值显著增加(P<0.001)。
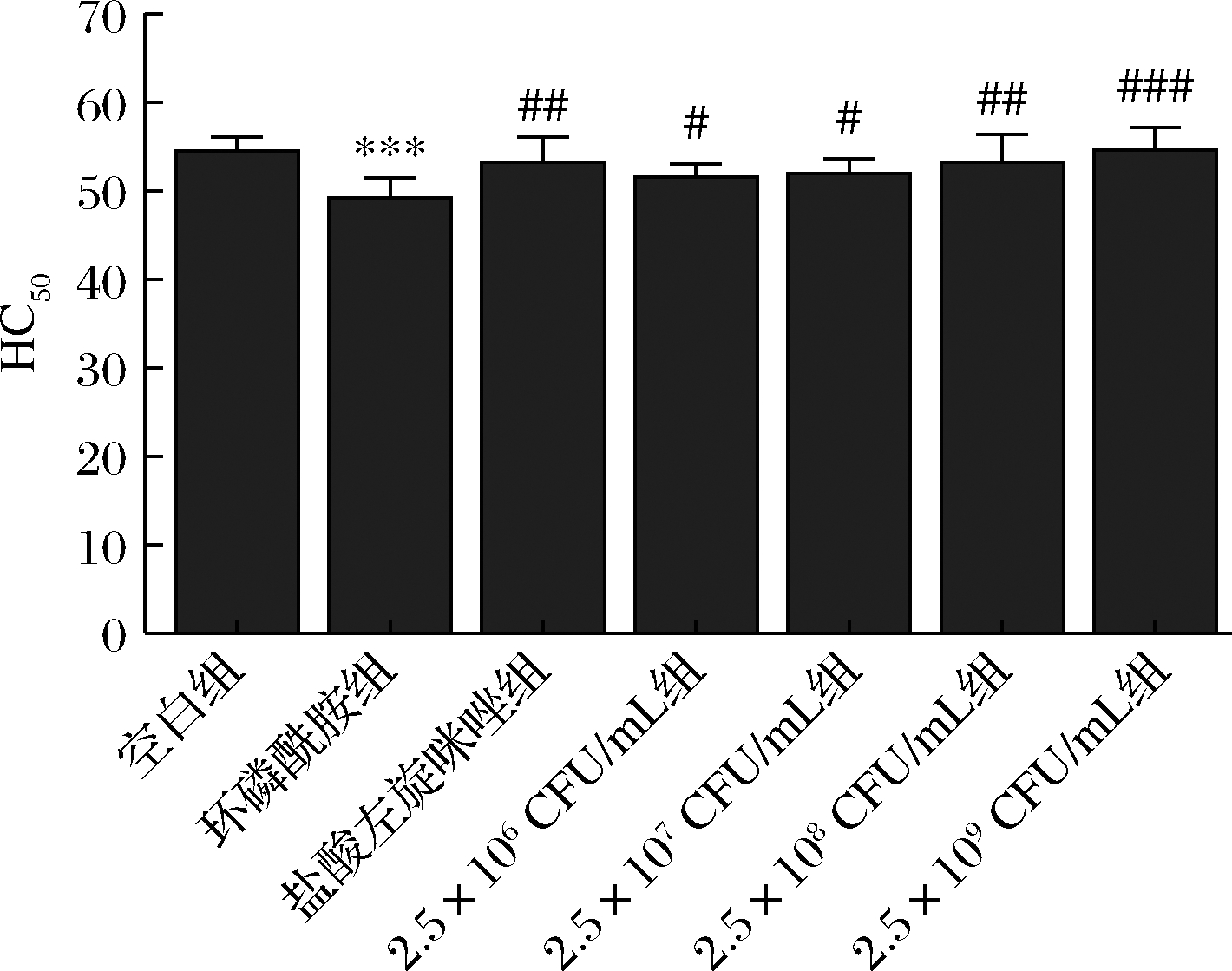
图2 XLTG11不同剂量组对CTX小鼠HC50的影响
Fig.2 Effect of different doses of XLTG11 on HC50 of CTX mice
注:*** P<0.001,与空白组相比;#P<0.05,##P<0.01, ##P<0.001,与模型组相比
2.3 脾淋巴细胞亚群百分比的测定
乳双歧杆菌XLTG11不同剂量组对CTX小鼠脾淋巴细胞亚群百分比的影响如表1和图3所示。与空白组比较,CTX组小鼠脾淋巴细胞CD3+、CD19+、CD4+CD8-和CD4-CD8+百分比均明显降低(P<0.05)。与CTX组比较,LEV组小鼠脾淋巴细胞CD3+、CD4+CD8-和CD4-CD8+百分比明显增加(P<0.05),乳双歧杆菌XLTG11各剂量组小鼠脾淋巴细胞CD3+、CD4+CD8-和CD4-CD8+百分比显著增加(P<0.05),乳双歧杆菌XLTG11(2.5×109 CFU/mL)组小鼠脾淋巴细胞CD19+百分比增加(P<0.01)。
表1 XLTG11不同剂量组对CTX小鼠脾淋巴细胞亚群百分比的影响![]() 单位:%
单位:%
Table 1 Effect of different doses of XLTG11 on percentage of splenic lymphocyte subsets of CTX mice ![]()
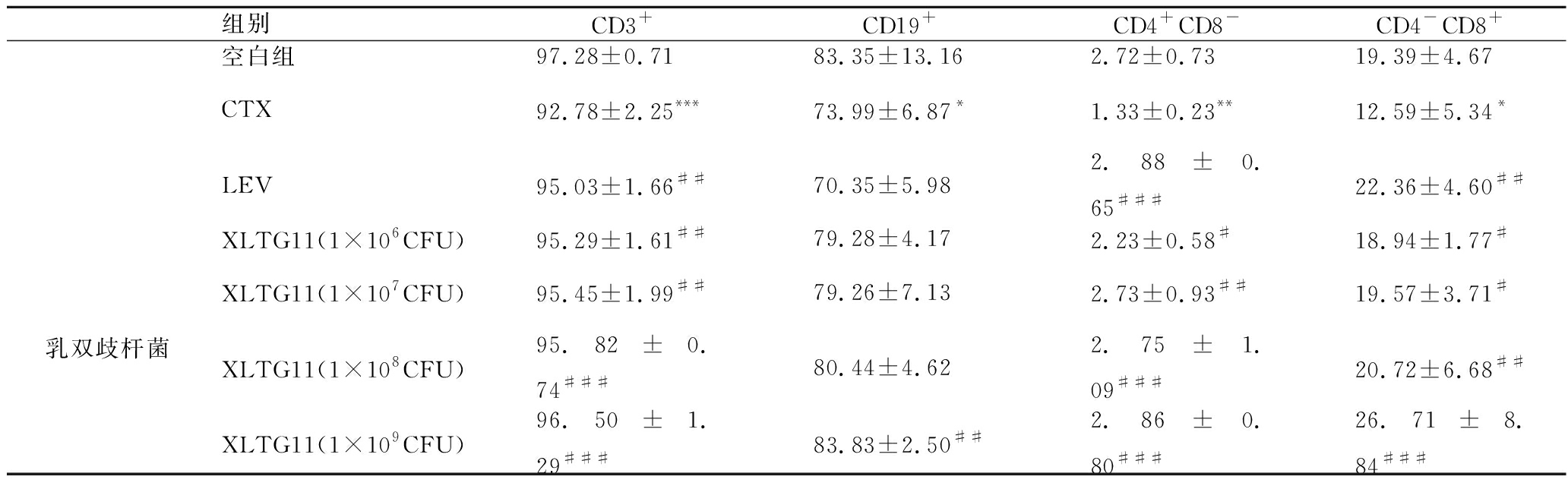
组别CD3+CD19+CD4+CD8-CD4-CD8+空白组97.28±0.7183.35±13.162.72±0.7319.39±4.67CTX92.78±2.25***73.99±6.87*1.33±0.23**12.59±5.34*LEV95.03±1.66##70.35±5.982.88±0.65###22.36±4.60##乳双歧杆菌XLTG11(1×106CFU)95.29±1.61##79.28±4.172.23±0.58#18.94±1.77#XLTG11(1×107CFU)95.45±1.99##79.26±7.132.73±0.93##19.57±3.71#XLTG11(1×108CFU)95.82±0.74###80.44±4.622.75±1.09###20.72±6.68##XLTG11(1×109CFU)96.50±1.29###83.83±2.50##2.86±0.80###26.71±8.84###
注:与空白组相比,*P<0.05, ** P<0.01, *** P<0.001;与模型组相比,#P<0.05, ##P<0.01, ###P<0.001

a-CD4+CD8-和CD4-CD8+ T淋巴细胞;b-CD19+ T淋巴细胞
图3 流式细胞技术检测各组小鼠脾淋巴细胞亚群百分比
Fig.3 Percentage of splenic lymphocyte subsets of mice in various groups detected by flow cytometry
注:A-空白组;B-模型组;C-LEX组;D-XLTG11(2.5×106 CFU/mL)组;E-XLTG11(2.5×107 CFU/mL)组;F-XLTG11(2.5×108 CFU/mL)组;G-XLTG11(2.5×109 CFU/mL)组
3 讨论
免疫系统是机体内一系列生物学结构和进程所组成的疾病防御系统,是人体健康的保障[5]。随着人们生活节奏加快,普遍人群免疫力低下,据世界卫生组织数据显示,全球约75%的人都处于亚健康状态[6],亚健康影响人们的生活,降低生活质量。因此,提高机体免疫力尤为重要。研究表明,肠道内的益生菌可以直接或间接地刺激机体免疫系统成熟,影响机体单核细胞、T细胞、B细胞、自然杀伤细胞等多种免疫细胞功能,提高机体免疫力[7-8]。
本实验结果显示,乳双歧杆菌XLTG11在2.5×106 CFU/mL时可以增加免疫低下小鼠的HC50值,提高脾淋巴细胞CD3+、CD19+、CD4+CD8-和CD4-CD8+百分比。作为保健食品摄入体内的益生菌在机体复杂的消化系统面前,其存活率大大降低,在体内存活时间变短,不能达到预期的健康功效[9],面对此问题往往通过加大剂量实现益生菌的增免作用。然而,乳双歧杆菌XLTG11具有优良益生特性,其在pH 8.0的人工消化液中消化11 h,存活率仍然高达89.75%,能够以活的状态进入人体肠道发挥健康功效。因此,乳双歧杆菌XLTG11在相对较低浓度2.5×106 CFU/mL时,表现出免疫增强作用。
本实验研究结果表明,40 mg/kg CTX连续腹腔注射2 d可显著降低小鼠全血白细胞总数和HC50值。在灌胃给予28 d不同剂量乳双歧杆菌XLTG11后,乳双歧杆菌XLTG11各剂量组小鼠的血清溶血素水平明显提高。乳双歧杆菌XLTG11(2.5×109 CFU/mL组)小鼠的血液白细胞数目明显增加。白细胞数目与机体非特异性免疫功能密切相关,血清溶血素的含量可以反映小鼠特异性体液免疫功能。以往研究表明,一种由双歧杆菌为主要成分的益生菌可以明显增加健康小鼠的血液白细胞数目[10]。双歧杆菌菌株Bifidobacterium adolescentis BB-2 和Bifidobacterium longum BB-3可以增高健康小鼠的血清溶血素吸光值,且随着剂量升高,溶血素含量逐渐增强[11]。综上可见,乳双歧杆菌XLTG11具有增强小鼠非特异性和特异性免疫功能的作用,且具有剂量依赖性。
T淋巴细胞是特异性免疫的主要效应细胞,其细胞膜表面分子与T细胞功能相关,用以分离鉴定不同亚群。T淋巴细胞按表面分化抗原不同(cluster differentiation,CD)大致分为具有协助细胞免疫和体液免疫功能的辅助性T细胞 (helper T cell, Th) 以及具有杀伤靶细胞功能的细胞毒性T细胞 (cytotoxic T lymphocyte, Tc)。T淋巴细胞亚群相互协作,反映机体免疫调控状态和免疫水平,是免疫调节的关键所在[12-13]。CD3+分子是T淋巴细胞标志物, 按照T淋巴细胞表面抗原决定簇不同分为CD4+CD8-T淋巴细胞和CD4-CD8+T淋巴细胞2个亚群[14]。CD4+CD8-T淋巴细胞为Th型淋巴细胞,参与细胞因子分泌,促进B淋巴细胞、T淋巴细胞和其他免疫细胞增殖分化,发挥固有免疫应答作用。CD4-CD8+T淋巴细胞为Tc型淋巴细胞,具有特异性杀伤功效和细胞毒作用,可杀伤靶细胞[15-16]。CD4+CD8-和CD4-CD8+T淋巴细胞与细胞因子IL-2、IFN-γ、TNF-α呈正相关关系[17]。CD19+参与B淋巴细胞发育再生,在成熟B淋巴细胞分化为合成和分泌抗体的浆细胞过程中,其表面CD19+丢失,并可发生免疫球蛋白的类别转换,被激活的B细胞膜表面表达和分泌的免疫球蛋白类别从产生IgM转换为产生IgG、IgA或IgE,升高血清中免疫球蛋白IgA和IgG表达水平,发挥体液免疫调节功能[18]。本实验研究结果显示,乳双歧杆菌XLTG11对CTX致免疫低下小鼠的脾脏T淋巴细胞亚群平衡具有调节作用,可提高小鼠脾脏T淋巴细胞CD3+、CD19+、CD4+CD8-和CD4-CD8+百分比。这与本实验前期研究结果相一致,即乳双歧杆菌XLTG11可以提高小鼠血清中免疫球蛋白IgA、IgG和细胞因子IL-2、IL-6、IFN-γ、TNF-α的水平,参与小鼠特异性免疫应答作用调节。另有研究表明,乳双歧杆菌M8可提高大鼠全血CD3+T淋巴细胞、CD4+T淋巴细胞、CD8+T淋巴细胞及NK细胞百分比[19]。包含多种乳双歧杆菌的复合益生菌可拮抗CTX造成的小鼠免疫低下状态,提高CD4+和CD8+T淋巴细胞占脾细胞的比例,减少脾淋巴细胞凋亡[20]。因此,推测乳双歧杆菌XLTG11可通过刺激T淋巴细胞增殖分化,发挥其增强小鼠细胞与体液免疫的能力。
综上可见,乳双歧杆菌XLTG11因其具有良好稳定性和肠道耐受性,相对较低浓度亦具有增强免疫作用,在益生菌保健食品开发方面具有成本低的优势。目前对于乳双歧杆菌的增强免疫作用机制研究多集中在肠道壁垒和肠道菌群等方面,乳双歧杆菌XLTG11表现出明显的免疫增强作用,今后可对其进行全面评价,为益生菌保健食品的开发提供药理学基础。
[1] 中国食品科学技术学会益生菌分会. 益生菌的科学共识(2020年版)[J].中国食品学报, 2020, 20(5):303-307.
Probiotics Society of the Chinese Institute of Food Science and Technology.Scientific consensus on probiotics (2020)[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(5):303-307.
[2] 翟云, 托娅.益生菌的免疫调节作用及其相关应用研究进展[J].中国微生态学杂志, 2018, 30(2):235-239.
ZHAI Y, TUO Y.The immunomodulatory effects of probiotics and recent advances in related researches[J].Chinese Journal of Microecology, 2018, 30(2):235-239.
[3] LUO J M, LI Y T, XIE J L, et al.The primary biological network of Bifidobacterium in the gut[J].FEMS Microbiology Letters, 2018, 365(8):1-7.
[4] 翟旭楠, 刘永武, 张娜, 等.刺五加多糖对小鼠免疫功能的影响[J].中医药信息, 2020, 37(6):42-45.
ZHAI X N, LIU Y W, ZHANG N, et al.Effect of Acanthopanax senticosus polysaccharide on immune function in mice[J].Information on Traditional Chinese Medicine, 2020, 37(6):42-45.
[5] 俞萍, 张庆贺, 姜虹延, 等.不同分子质量的人参糖肽复合物增强小鼠免疫功能的研究[J].食品与发酵工业, 2021, 47(22):109-114.
YU P, ZHANG Q H, JIANG H Y, et al.Immuno-enhancement of ginseng glycopeptide complex with different molecular weights on mice[J].Food and Fermentation Industries, 2021, 47(22):109-114.
[6] 费医, 马恰怡.“亚健康人群”的中医养生[J].食品与生活, 2021(8):76-77.
FEI Y, MA Q Y.“Sub-health crowd” of traditional Chinese medicine health[J].Food and Life, 2021(8):76-77.
[7] BOYLE R J, MAH L, KIVIVUORI S, et al. In vivo, in vitro and transplacental immune effects of a probiotic bacterium Lactobacillus rhamnosus GG in humans[J].Journal of Allergy and Clinical Immunology, 2009, 123(2):S200.
[8] 阿热爱·巴合提, 武瑞赟, 肖梦圆, 等.益生菌的生理功能及作用机理研究进展[J].食品与发酵工业, 2020, 46(22):270-275.
AREAI BAHATI, WU R Y, XIAO M Y, et al.Research progress in physiological function and mechanism of probiotics[J].Food and Fermentation industries, 2020, 46(22):270-275.
[9] 张林奇, 王晓蕊, 史畅, 等.益生菌粉中活菌稳定性及其耐受模拟胃肠液的研究[J].食品与发酵工业, 2021, 47(13):36-42.
ZHANG L Q, WANG X R, SHI C, et al.Stability and tolerance to simulated gastrointestinal fluids of probiotics in powder preparation[J].Food and Fermentation Industries, 2021, 47(13):36-42.
[10] 郑丽君, 马海然, 李洪亮.益生菌增强免疫功能的研究[J].轻工科技, 2020, 36(12):12-14.
ZHENG L J, MA H R, LI H L.Study on enhancing immune function of probiotics[J].Light Industry Science and Technology, 2020, 36(12):12-14.
[11] 范金波, 侯宇, 周素珍, 等.双歧杆菌增强小鼠机体的免疫功能[J].微生物学报, 2015, 55(4):484-491.
FAN J B, HOU Y, ZHOU S Z, et al.Effect of Bifidobacterium on the immunity in BALB/c mice[J].Acta Microbiologica Sinica, 2015, 55(4):484-491.
[12] KUMAR B V, CONNORS T J, FARBER D L.Human T cell development, localization, and function throughout life[J].Immunity, 2018, 48(2):202-213.
[13] 苏璐, 苏冀彦, 李丹, 等.兰茂牛肝菌含药血清对小鼠脾淋巴细胞的影响[J].食用菌学报, 2018, 25(2):113-120.
SU L, SU J Y, LI D, et al.Effects of Lanmaoa asiatica extracts administered mice serum on mice splenocytes[J].Acta Edulis Fungi, 2018, 25(2):113-120.
[14] LI G G, CAO Y H, RUN Y, et al.Inhibition of CD8+T cells and elimination of myeloid cells by CD4+ Foxp3-T regulatory type 1 cells in acute respiratory distress syndrome[J].Clinical and Experimental Pharmacology and Physiology, 2016, 43(12):1 191-1 198.
[15] 雷子颖, 王俞, 罗嘉莉, 等.胃癌患者外周血T淋巴细胞亚群和NK细胞分析[J].消化肿瘤杂志(电子版), 2018, 10(4):196-199.
LEI Z Y, WANG Y, LUO J L, et al.Analysis of T lymphocyte subsets and NK cells in peripheral blood of patients with gastric cancer[J].Journal of Digestive Oncology (Electronic Version), 2018, 10(4):196-199.
[16] 黄梅淑. 外周血T淋巴细胞及其相关细胞因子检测在胃部疾病发生、进展中的价值初探[D].石家庄:河北医科大学, 2012.
HUANG M S.The primary exploration of the value of T lymphocytes and cytokines in peripheral blood to the occurrence and development of gastric diseases[D].Shijiazhuang:Hebei Medical University, 2012.
[17] OVERGAARD N H, JUNG J W, STEPTOE R J, et al.CD4+/CD8+ double-positive T cells:More than just a developmental stage?[J].Journal of Leukocyte Biology, 2015, 97(1):31-38.
[18] 师越, 王冬梅, 廖晓龙.CD19分子的研究进展及临床应用[J].国际免疫学杂志, 2015, 38(2):156-160.
SHI Y, WANG D M, LIAO X L.Research progress and clinical application of CD19[J].International Journal of Immunology, 2015, 38(2):156-160.
[19] 翟云, 王雅菲, 托娅.乳双歧杆菌M8对免疫抑制模型大鼠免疫功能的影响[J].吉林大学学报(医学版), 2020, 46(3):582-588.
ZHAI Y, WANG Y F, TUO Y.Effect of Bifidobacterium lactis M8 on immune function of immunosuppressive model rats[J].Journal of Jilin University (Medicine Edition), 2020, 46(3):582-588.
[20] 田艳, 刘青青, 田海霞, 等.益生菌缓解环磷酰胺所致小鼠免疫功能低下[J].中国免疫学杂志, 2020, 36(15):1 805-1 808.
TIAN Y, LIU Q Q, TIAN H X, et al.Probiotics alleviate immunosuppression induced by cyclophosphamide in mice[J].Chinese Journal of Immunology, 2020, 36(15):1 805-1 808.