小球藻(Chlorella sp.)富含蛋白质、色素、多种脂肪酸和淀粉,是食品、医药和能源产品的优质来源[1- 2]。当前,小球藻的全球年产量可达2 500 t,但仍处于供不应求的局面[3]。原因在于,小球藻的培养主要是利用开放池和光反应器2种形式,这种通过吸收光能的自养培养模式存在很多弊端,如培养周期长、产量低和采收成本高等问题[4]。为填补市场缺口,微藻生产商只能通过加大用地面积,加大培养规模来提高产量。而扩培手段又无法从根本上解决小球藻培养成本高和产率低的问题,如何经济高效地培养小球藻一直都是学者和生产商的研究热点。
研究发现,部分小球藻可以利用有机碳源来获取能量以提供自身细胞代谢合成,进行异养生长。与光自养相比,异养培养的小球藻菌株能有效利用葡萄糖,极大提高生长速率,获得更高的产量[5]。小球藻异养培养过程中,培养基的组成及用量是影响细胞生长的关键因素[6-7]。适合的培养基往往能使小球藻具有较快的生长速率以及高的细胞密度[8]。因此通过优化培养基的组分及用量既可以降低小球藻的生产成本又可以提高产量。然而,小球藻细胞在异养条件下通常产生低蛋白质(<40%)和高脂肪/碳水化合物含量的生物量[9-10]。为有效地提高异养小球藻的蛋白质含量,研究人员开发了一些有效的工艺来促进微藻的蛋白质合成,如串联异养/自养培养法[11]和氮饥饿-过度补偿法[12]。但这些工艺具有过程繁琐、培养时间长以及成本昂贵等弊端,因此需要探索更为简单、有效的方法。
本文用实验室保藏的1株小球藻MBFJNU-17,研究不同氮源对微藻细胞生长及生理生化的影响,并对小球藻生长培养基关键影响成分的用量进行优化,对小球藻的细胞组分进行分析,评估蛋白质的氨基酸品质,旨在为开发优质的动物饲料或人类食品蛋白质来源提供理论依据。
1 材料与方法
1.1 藻种与培养基
小球藻Chlorella sp.MBFJNU-17,由本实验室保藏。保种斜面琼脂培养基为添加了5 g/L葡萄糖和20 g/L琼脂的BG11[13]培养基。
HA-SK培养基[11](g/L):葡萄糖 30、MgSO4·7H2O 0.7、CaCl2 5 mL/L、Fe-EDTA 16 mL/L、KNO3 9.25、KH2PO4 0.7、微量元素母液2.5 mL/L,配制完成后将pH调节至7.5。
Fe-EDTA母液:称取Fe2SO4·7H2O 1.745 g、EDTA 8.2 g,溶于少量蒸馏水后定容至1 L。
CaCl2母液:无水CaCl2 20.6 g,H2O 1 L。
微量元素母液(g/L):H3BO3 11.42、ZnSO4·7H2O 8.22、MnCl2·4H2O 1.95、Co(NO3)2·6H2O 0.49、(NH4)6Mo7O24·4H2O 0.870 7、CuSO4·5H2O 1.57。
所有培养基使用前于115 ℃灭菌20 min。
1.2 实验仪器与试剂
1.2.1 仪器
SBA-40E生物传感分析仪,山东省科学研究院;海能K9840全自动凯氏定氮仪,济南海能仪器股份有限公司;BS224S电子秤,北京赛多利斯系统仪器有限公司;HVE50高压蒸汽灭菌锅,中远机械有限公司;DHG-9070A电热鼓风干燥箱,上海一恒科技有限公司;SW-CJ-2FD超净工作台,苏州净化设备有限公司;H1650-W湘仪离心机,湖南湘仪实验室仪器开发有限公司;DELTA320 pH计,梅特勒-托利多仪器上海有限公司;IS-RDS3恒温振荡摇床,赛伯乐上海仪器有限公司。
1.2.2 试剂
酵母粉,索莱宝生物科技有限公司;蛋白胨粉,生工生物工程(上海)股份有限公司;KNO3、尿素,西陇科学股份有限公司。
1.3 实验方法
1.3.1 藻种制备
从葡萄糖BG11培养基斜面挑取适量小球藻体,接种于装有100 mL HA-SK培养基的250 mL锥形瓶中,置于28 ℃恒温振荡摇床中培养,摇床转速为150 r/min,培养时长约72 h。
1.3.2 小球藻生长曲线的绘制
取培养至72 h的新鲜小球藻种子液,以体积分数为10%的接种量接入HA-SK培养基,与藻种相同条件下培养,培养时长168 h,每天取样测定生物量,并绘制其生长曲线。
1.3.3 氮源种类的优化
根据HA-SK培养基的初始氮含量,探究相同氮质量浓度(以总氮分子质量计)的4种不同氮源对小球藻细胞生长以及生物质组分的影响,即KNO3(9.25 g/L)、酵母粉(9.21 g/L)、蛋白胨粉(9.21 g/L)和尿素(2.8 g/L),筛选出小球藻MBFJNU-17异养培养的最适氮源。将小球藻MBFJNU-17藻种以10%的接种量,接种于装有100 mL不同氮源HA-SK培养基的250 mL锥形瓶中,置于恒温振荡摇床中培养。培养温度为28 ℃,摇床转速为150 r/min,黑暗条件下培养5 d。每天测定培养液的pH,并测定最终的小球藻生物量、蛋白质、碳水化合物以及油脂等理化组分。
1.3.4 响应面优化
以Plackett-Burman设计法[14],设计以培养基中葡萄糖、氮源、KH2PO4、MgSO4·7H2O、CaCl2母液、Fe-EDTA母液和微量元素母液为不同因素,在原始HA-SK培养基各因素浓度的附近取高低2个水平,其中高水平为低水平的2倍,并以小球藻培养120 h的生物量为响应值,筛选出HA-SK培养基成分中对小球藻MBFJNU-17生长最重要的几个因素。随后用最陡爬坡来快速逼近各重要因素最佳用量的区域。最后再利用响应面法[15]优化得到各培养基的最佳用量。
1.4 分析测试
1.4.1 小球藻生物量的测定
采用干重法测定小球藻的生物量。取1 mL的小球藻藻液,移至预先烘干称重的2 mL离心管中,离心弃上清液,加纯水重复离心,洗涤3次,置于80 ℃烘箱内至恒重,称重并记录。
1.4.2 小球藻生物质主要成分的分析
采用凯氏定氮法测定微藻蛋白质含量[16]。采用苯酚硫酸法测定微藻的碳水化合物含量[17]。采用氯仿-甲醇法测定微藻细胞的油脂含量[18]。
1.4.3 蛋白质中氨基酸组成测定及品质评价
采用高效液相色谱法测定小球藻蛋白质的氨基酸组分[19]。利用必需氨基酸指数(essential amino acids index,EAAI)评价小球藻的蛋白质营养价值,将小球藻MBFJNU-17的必需氨基酸与FAO /WHO的建议模式进行比较[20]。
1.4.4 培养基氮含量计算
培养基氮含量计算如公式(1)所示:
(1)
式中:ρ(N),培养基中氮含量,g/L;m,氮源质量,g;Pn,氮源的总氮占比,%;L,培养基体积,L。
2 结果与分析
2.1 小球藻 MBFJNU-17生长曲线
由图1可知,小球藻MBFJNU-17种子接入HA-SK培养基后快速生长,迅速进入指数生长期,几乎没有延滞期。培养至96 h,小球藻的生物量达最大值9.32 g/L;96~168 h,不再增加,甚至轻微衰减。可能是此时培养体系内某些影响小球藻细胞生长的关键营养成分被消耗,残余量不足以继续供应细胞正常的生长繁殖,整个细胞群体的凋亡速度大于新细胞合成速度。因此,选择以培养120 h为1个周期。
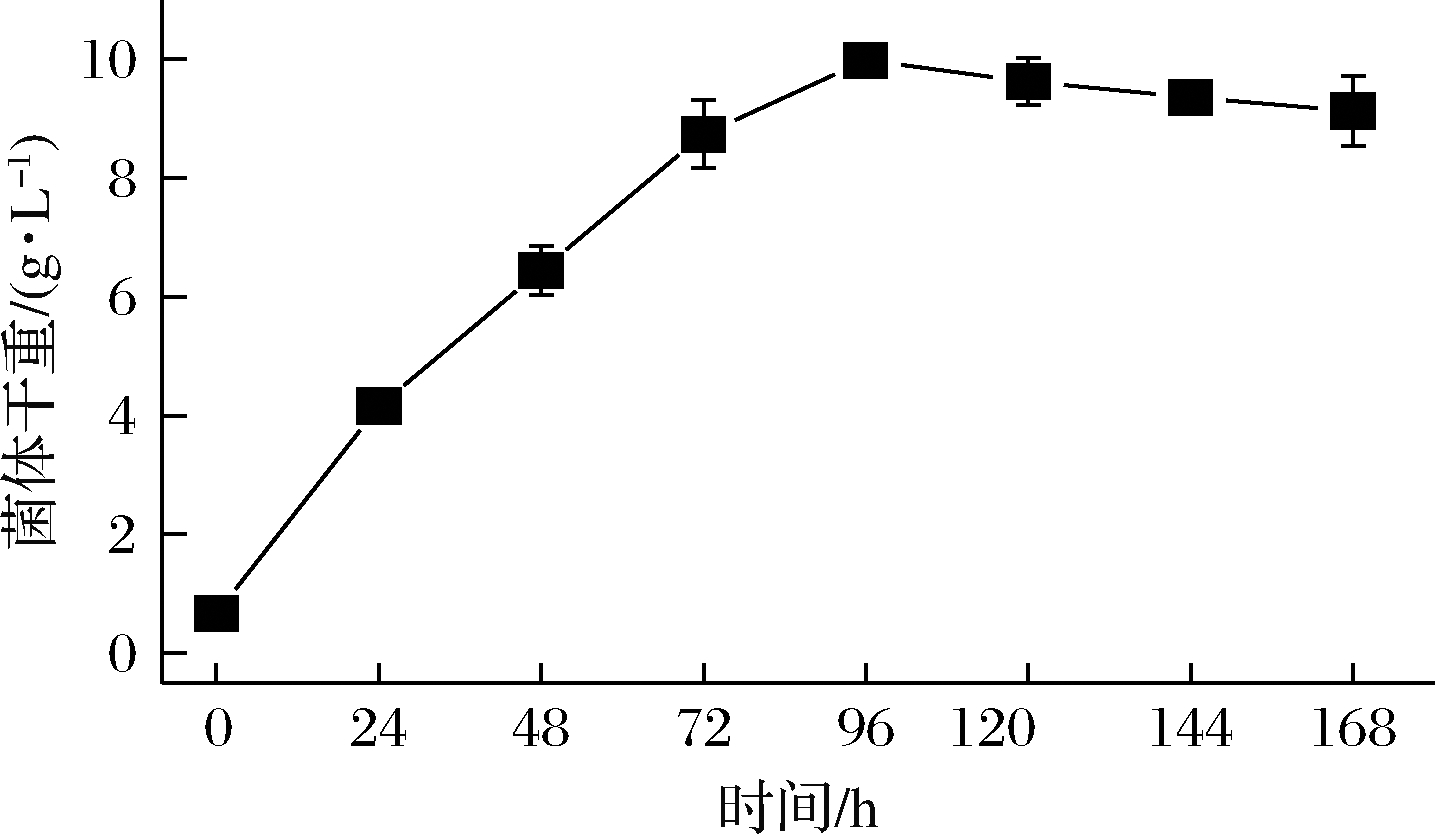
图1 小球藻MBFJNU-17在HASK培养基的生长曲线
Fig.1 Growth curve of Chlorella sp.MBFJNU-17 cultivated in HA-SK medium
2.2 小球藻培养基氮源的筛选
氮源是微藻培养中最重要的常量营养元素,藻细胞的蛋白质、色素和核酸合成都需要氮元素参与。由图2-a可知,以尿素为氮源小球藻MBFJNU-17培养120 h后生物量最高(10.85 g/L),KNO3组为9.44 g/L。而以蛋白胨、酵母粉为氮源的实验组小球藻生物量远低于尿素组和KNO3组,最终生物量仅约3 g/L。表明小球藻MBFJNU-17不能很好地利用酵母粉和蛋白胨等有机氮源,而更倾向于利用尿素和KNO3。肖雪花等[21]发现,酵母粉更适于作为蛋白核小球藻异养培养的氮源,与本研究结果不一致,可能是因为藻的种间差异。而利用尿素为氮源比以KNO3为氮源的细胞干重略有优势,主要是由于小球藻在选择利用尿素时,脲酶将尿素分解成氨态氮和CO2,过程不需要消耗能量[22],而利用硝态氮时需转化为氨态氮才能被利用,这个过程需要多消耗能量,造成有机碳源的损耗[23]。
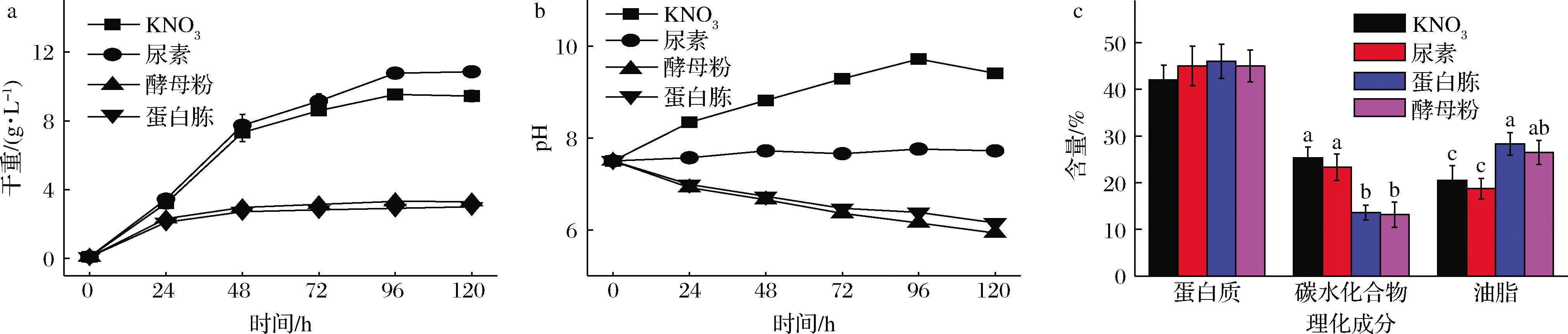
a-生长情况;b-pH;c-理化成分
图2 不同氮源对小球藻MBFJNU-17的影响
Fig.2 Effects of different nitrogen sources on Chlorella sp.MBFJNU-17
图2-b记录了以不同氮源培养异养培养小球藻MBFJNU-17过程的pH变化情况。以尿素为氮源,小球藻培养液的pH始终在7.5左右。可能是因为尿素是分子式为CH4N2O的有机化合物,其主要成分为碳和氮,在被微藻吸收利用后,不会残留大量阴离子和阳离子,因此不会影响培养基的pH。而以KNO3、蛋白胨和酵母粉为单一氮源则使培养液pH变化较大。其中以蛋白胨、酵母粉为氮源,培养小球藻120 h后,培养液的pH从7.5降至约6,而KNO3组的藻液pH迅速升高,升至9.5左右。KNO3作为微藻培养的氮源时,微藻对NO3-的吸收比K+更多,因此有部分K+残留在培养基质中生成K2CO3等弱酸强碱盐,升高了培养环境的pH值。而酵母粉和蛋白胨粉作为有机氮源成分相对复杂,其影响微藻培养pH值的机制尚不清楚,今后还需更多地利用多组学技术来阐述其代谢活动。据报道,培养液pH值的变化会影响小球藻生长[24]。SHI等[25]发现在同等氮浓度下,尿素作为氮源在藻类生长过程中优于常用的硝酸盐,在培养基中引起的pH波动小,藻类的生物量相对较高,这与本研究结果相似。
另外,氮源的种类对小球藻MBFJNU-17的理化成分影响显著。如图2-c所示,以尿素和KNO3为氮源更有利于蛋白质的合成(40%~45%),而以蛋白胨和酵母粉为氮源则更有利于油脂的积累(30%~35%)。
综上可得,以KNO3或尿素为唯一氮源时,有利于小球藻细胞生长。此外,对生物量、蛋白质含量和氮源添加量进行计算可知,获得相同生物量的小球藻时,所需的KNO3质量约为单独使用尿素的3.8倍,且利用KNO3获得的小球藻蛋白质产量仅为使用尿素为唯一氮源时的81.2%。同时,在以尿素为唯一氮源时也更有利于稳定培养液的pH。小球藻在规模化异养培养过程中,若频繁调节pH势必会增加操作工序和培养成本,也更容易造成染菌。根据调查,尿素的市场价格也会比KNO3的价格更低[26]。因此后续培养小球藻MBFJNU-17选取尿素作为异养培养的氮源,可以减少物料的投入成本,同时无需调节培养液的pH,易于规模化应用。
2.3 小球藻异养培养基配方优化
2.3.1 Plackett-Burman优化小球藻培养基
选取小球藻培养基里的葡萄糖、尿素、MgSO4·7H2O、CaCl2母液、Fe-EDTA母液、KH2PO4和微量元素母液7类组分为自变量,每个因素设计高低2个水平,以培养120 h的小球藻生物量作为响应值。实验结果见表1。在众多因子中,葡萄糖、尿素和微量元素母液显著影响(P<0.05)小球藻MBFJNU-17的生长。其中葡萄糖和尿素为正效应(T>0),而微量元素母液为负效应(T<0)。
表1 Plackett-Burman试验设计方差分析表
Table 1 Analyses of variance for Plackett-Burman design
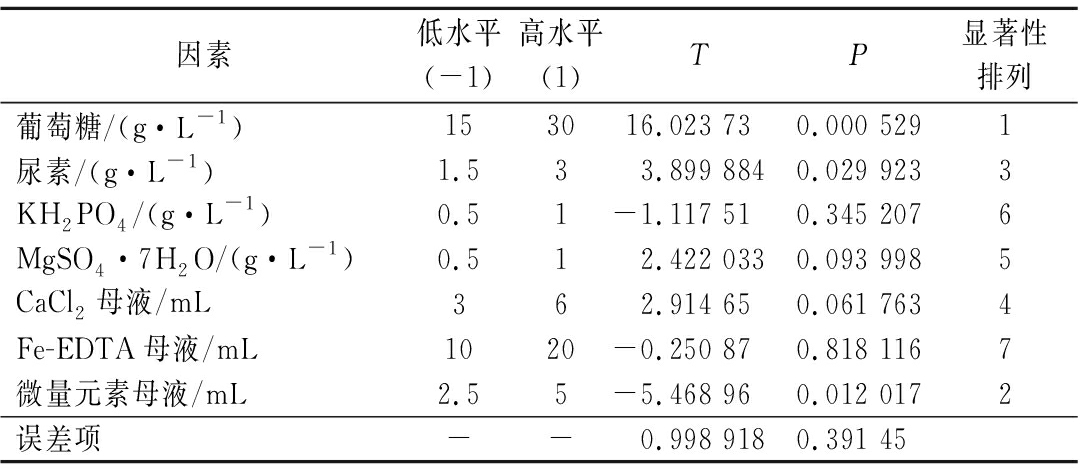
因素低水平(-1)高水平(1)TP显著性排列葡萄糖/(g·L-1)153016.023 73 0.000 5291尿素/(g·L-1)1.533.899 8840.029 9233KH2PO4/(g·L-1)0.51-1.117 510.345 2076MgSO4·7H2O/(g·L-1)0.512.422 0330.093 9985CaCl2母液/mL362.914 650.061 7634Fe-EDTA母液/mL1020-0.250 870.818 1167微量元素母液/mL2.55-5.468 960.012 0172误差项--0.998 9180.391 45
2.3.2 最陡爬坡试验
根据Plackett-Burman选取最显著的3个因素,即葡萄糖、尿素和微量元素母液,进行最陡爬坡试验。由于葡萄糖和尿素是正效应,而微量元素母液为负效应,因此葡萄糖和尿素的浓度水平应增加,微量元素母液浓度水平应减少。根据效应值大小,确定步长,设计及结果如表2。试验组3的小球藻生物量最大,达15.25 g/L。因此选取试验组3的水平条件作为中心点进一步通过响应面优化最佳浓度水平。
表2 最陡爬坡试验设计及其结果
Table 2 Designs and result of steepest ascent search
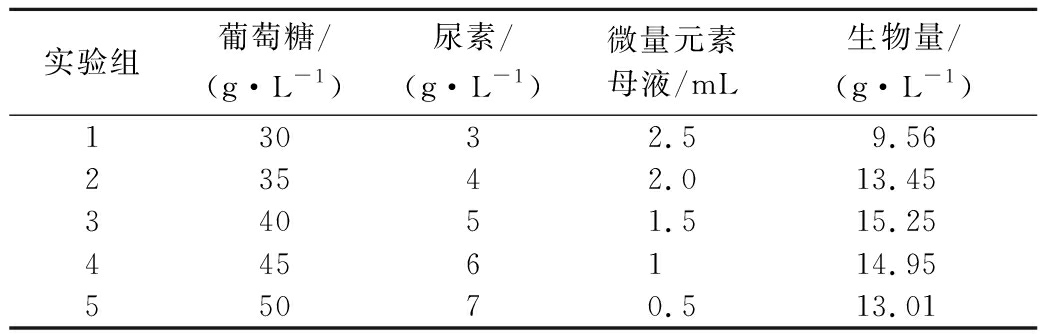
实验组葡萄糖/(g·L-1)尿素/(g·L-1)微量元素母液/mL生物量/(g·L-1)13032.59.5623542.013.4534051.515.254456114.9555070.513.01
2.3.3 响应面分析确定最优水平
根据最陡爬坡试验结果,选取葡萄糖40 g/L、尿素5 g/L、微量元素母液2 mL为中心点。参照Box-Behnken中心法则设计原理,通过Design-Expert 8.05软件设计3因素3水平的响应面试验,以生物量为响应值,设计和数据分析见表3、表4和表5。
表3 响应面设计因素及水平
Table 3 Factors and levels of Box-Behnken design
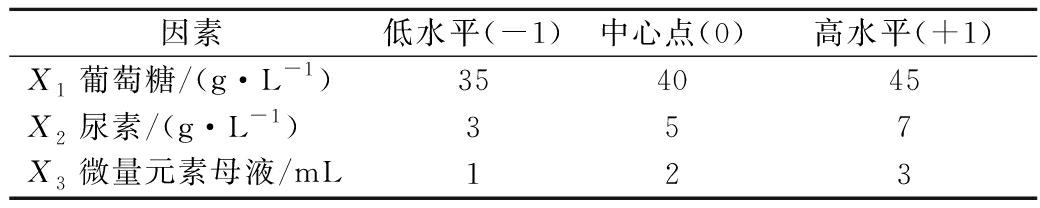
因素低水平(-1)中心点(0)高水平(+1)X1葡萄糖/(g·L-1)354045X2尿素/(g·L-1)357X3微量元素母液/mL123
表4 响应面设计及结果
Table 4 Results of response surface Box-Behnken design
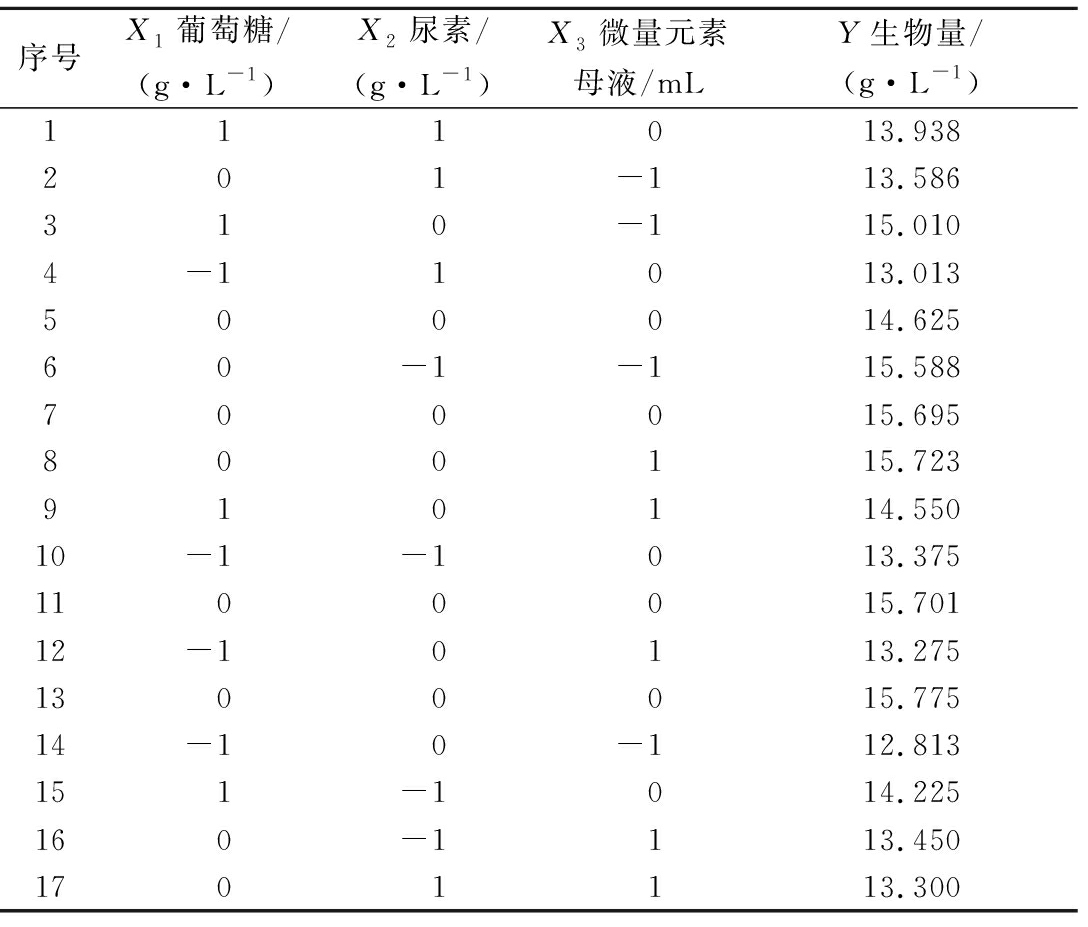
序号X1葡萄糖/(g·L-1)X2尿素/(g·L-1)X3微量元素母液/mLY生物量/(g·L-1)1 1 1 013.938201-113.586310-115.0104-11013.013500014.62560-1-115.588700015.695800115.723910114.55010-1-1013.3751100015.70112-10113.2751300015.77514-10-112.813151-1014.225160-1113.4501701113.300
用Design-Expert 8.05b 软件对试验进行回归拟合分析,得到响应值小球藻细胞干重与各自变量因素的二次回归方程如下:
Y=15.48+0.74X1-0.44X2-0.30X3-0.16X1X2-0.23X1X3+0.46X2X3-0.87X12-0.80X22-0.70X32
为检验方程的有效性,对回归方程进行方差分析,结果见表5。回归方程响应值和自变量因素之间的线性关系显著(R2=0.989 9),方程P=0.009 1,说明此回归方程极显著;失拟项P=0.380 3>0.1,说明方程对实验的拟合度较好,此实验方法是合适的[12]。为求得最佳配方,通过对模型方程各变量求一阶偏导数,解得X1=41.53、X2=4.14、X3=1.84。即小球藻细胞生长干重的最佳葡萄糖浓度为41.53 g/L、尿素质量浓度为4.14 g/L、微量元素母液用量为1.84 mL,在此条件下的小球藻细胞干重为15.79 g/L。
表5 回归方程的系数估计值
Table 5 The regression equation of coefficient estimates
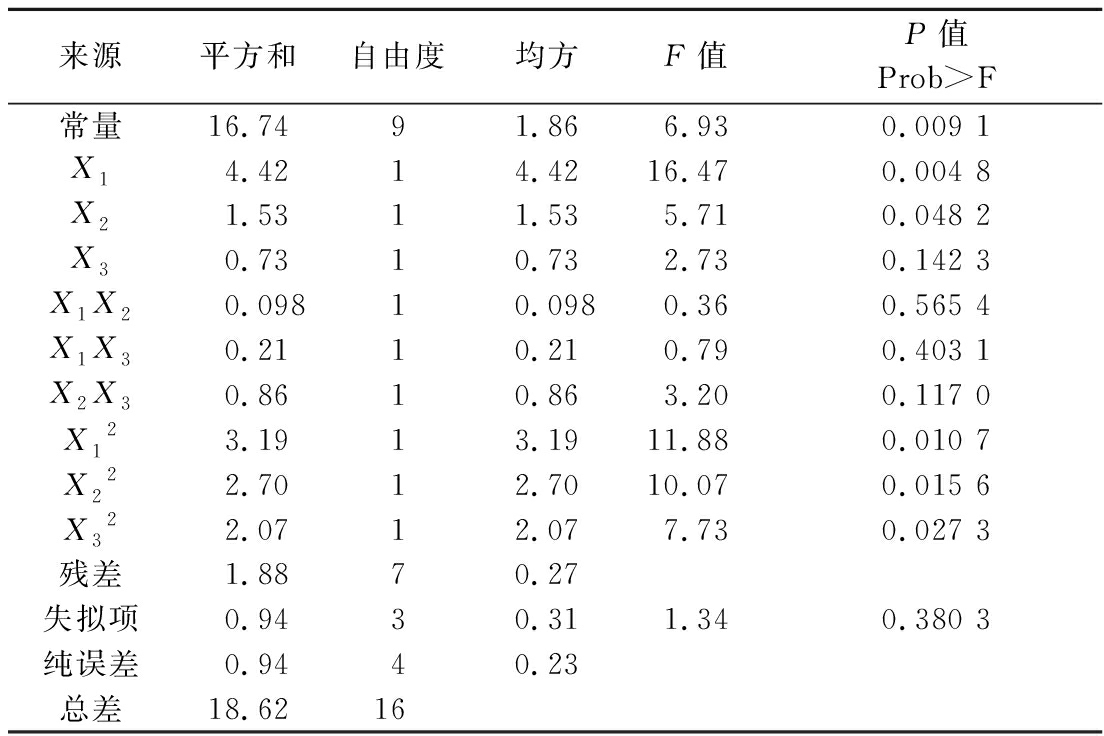
来源平方和自由度均方F值P值Prob>F常量16.7491.866.930.009 1 X14.4214.4216.470.004 8X21.5311.535.710.048 2X30.7310.732.730.142 3X1X20.09810.0980.360.565 4X1X30.2110.210.790.403 1X2X30.8610.863.200.117 0X123.1913.1911.880.010 7X222.7012.7010.070.015 6X322.0712.077.730.027 3残差1.8870.27 失拟项0.9430.311.340.380 3 纯误差0.9440.23总差18.6216
注:R2=0.989 9;Adj.R2=0.769 4;Prob>F:0.380 3
2.3.4 响应面结果验证
将经过优化后的培养基以相同接种量、培养条件进行3次重复试验,以验证此模型精准性。如图3-a所示,在优化后的培养基中培养120 h,小球藻MBFJNU-17最终生物量为15.53 g/L,与预测值15.79 g/L接近,比优化前提高了43.1%,说明此优化模型可取。
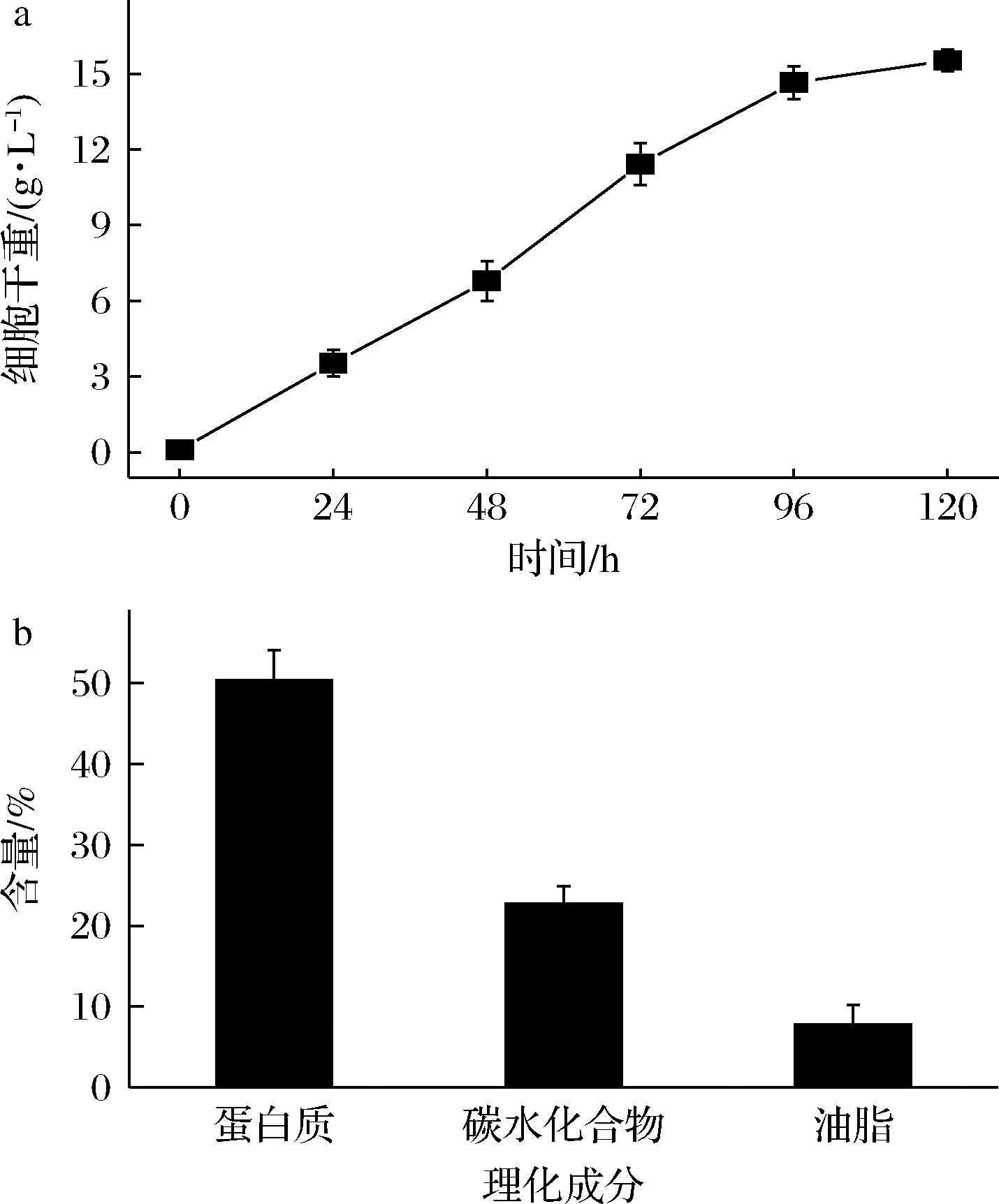
a-细胞生长变化;b-生化组成分析
图3 优化后培养基培养小球藻MBFJNU-17的细胞生长变化和生化组成分析
Fig.3 Changes of cell growth and biochemical composition of Chlorella sp.MBFJNU-17 treated by optimized medium
优化后培养基培养的小球藻生化组分分析见图3-b。优化后的小球藻蛋白质含量达52.4%,淀粉含量22.7%以及油脂含量为7.8%。利用优化后的培养基培养小球藻MBFJNU-17,蛋白质含量从44.5%提高到了52.4%。说明优化后的培养基配方在保证了小球藻MBFJNU-17生物量提高的同时,也促进了细胞蛋白质合成。说明培养基优化后,小球藻MBFJNU-17成为生产高密度生物量且富含蛋白质的理想菌株。
2.4 小球藻蛋白质的评价
蛋白质的营养品质与氨基酸的含量、比例相关,特别是由各类必需氨基酸的浓度决定[27]。本文采用EAAI对小球藻MBFJNU-17在自养(BG11培养基培养)和异养2种培养模式下的氨基酸组成进行比较分析和评价。高EAAI值表明样品存在高含量的必需氨基酸[28]。如表6所示,异养小球藻MBFJNU-17蛋白质在FAO/WHO/UNU模式下的EAAI为0.724,高于自养模式培养的藻蛋白质(0.572)。可能原因是,异养培养基中丰富的营养元素使得小球藻MBFJNU-17更容易合成必需氨基酸。同时,异养小球藻MBFJNU-17蛋白质的EAAI值也高于大豆蛋白(0.657)。说明异养小球藻MBFJNU-17蛋白比大豆蛋白具有更高的营养价值,有可能成为优质的动物饲料或人类食品蛋白质来源。
表6 异养/自养小球藻蛋白与大豆蛋白在FAO/WHO/UNU模式下EAAI 单位:mg/g蛋白
Table 6 Compared heterotrophic/phototrophic Chlorella sp. MBFJNU-17 protein with soya protein in essential amino acid index (EAAI) in FAO/WHO/UNU standard
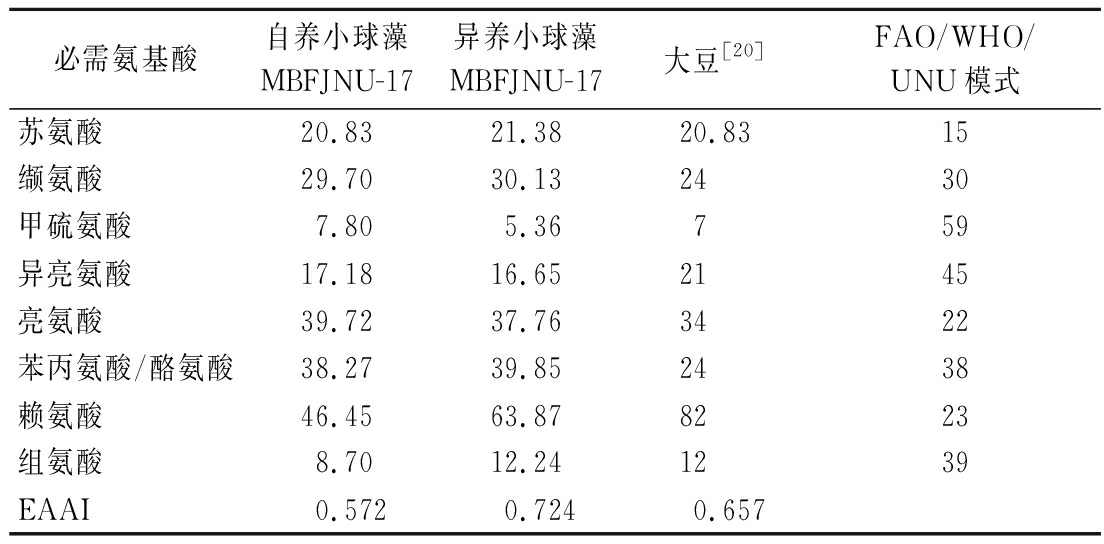
必需氨基酸自养小球藻MBFJNU-17异养小球藻MBFJNU-17大豆[20]FAO/WHO/UNU模式苏氨酸20.8321.3820.8315缬氨酸29.7030.132430甲硫氨酸7.805.36759异亮氨酸17.1816.652145亮氨酸39.7237.763422苯丙氨酸/酪氨酸38.2739.852438赖氨酸46.4563.878223组氨酸8.7012.241239EAAI0.5720.7240.657
3 结论
本研究通过单因素试验选取了尿素作为小球藻MBFJNU-17异养培养的氮源。相比于其他氮源,用尿素作为氮源异养培养小球藻能具有最高生物量,且培养过程pH稳定,更具应用前景。小球藻MBFJNU-17异养培养的培养基经优化后,其生物量为15.53 g/L,比优化前提升了43.1%,同时藻细胞的蛋白质含量为52.4%。氨基酸评价分析表明,小球藻MBFJNU-17蛋白质氨基酸组成平衡,比大豆蛋白具有更高的营养价值,小球藻MBFJNU-17有成为优质的动物饲料或人类食品蛋白质原料来源的潜能。
[1] ABU-GHOSH S, DUBINSKY Z, VERDELHO V, et al.Unconventional high-value products from microalgae:A review[J].Bioresource Technology, 2021, 329:124895.
[2] LIANG M H, WANG L, WANG Q M, et al.High-value bioproducts from microalgae:Strategies and progress[J].Critical Reviews in Food Science and Nutrition, 2019, 59(15):2 423-2 441.
[3] POND TECH. Chlorella[EB/OL].(2016-06-16)[2021-10-27]https://www.pondtech.com/blog/chlorella/.
[4] UMMALYMA S B, SAHOO D, PANDEY A.Bioremediation and Biofuel Production from Chlorella sp.:A Comprehensive ReviewMicroalgae Biotechnology for Development of Biofuel and Wastewater Treatment, 2019:635-655
[5] CANELLI G, NEUTSCH L, CARPINE R, et al.Chlorella vulgaris in a heterotrophic bioprocess:Study of the lipid bioaccessibility and oxidative stability[J].Algal Research, 2020, 45:101754.
[6] HU J J, NAGARAJAN D, ZHANG Q G, et al.Heterotrophic cultivation of microalgae for pigment production:A review[J].Biotechnology Advances, 2018, 36(1):54-67.
[7] BARKA A, BLECKER C.Microalgae as a potential source of single-cell proteins.A review[J].BASE, 2016:427-436.
[8] DINESHKUMAR R, DHANARAJAN G, DASH S K, et al.An advanced hybrid medium optimization strategy for the enhanced productivity of lutein in Chlorella minutissima[J].Algal Research, 2015, 7:24-32.
[9] BOUYAM S, CHOORIT W, SIRISANSANEEYAKUL S, et al.Heterotrophic production of Chlorella sp.TISTR 8990—biomass growth and composition under various production conditions[J].Biotechnology Progress, 2017, 33(6):1 589-1 600.
[10] KLAMCZYNSKA B, MOONEY W.Chapter 20—Heterotrophic Microalgae a Scalable and Sustainable Protein Source[M].Pittsburgh:Academic Press, 2017.
[11] FAN J H, HUANG J K, LI Y G, et al.Sequential heterotrophy-dilution-photoinduction cultivation for efficient microalgal biomass and lipid production[J].Bioresource Technology, 2012, 112:206-211.
[12] XIE T H, XIA Y, ZENG Y, et al.Nitrate concentration-shift cultivation to enhance protein content of heterotrophic microalga Chlorella vulgaris:Over-compensation strategy[J].Bioresource Technology, 2017, 233:247-255.
[13] KIM H S, PARK W K, LEE B, et al.Optimization of heterotrophic cultivation of Chlorella sp.HS2 using screening, statistical assessment, and validation[J].Scientific Reports, 2019:19383.
[14] 李扬, 杨宁线, 谢国芳, 等.Plackett-Burman联用响应面法优化超声波-酸法提取狐臭柴果胶工艺[J].食品与发酵工业, 2021, 47(13):210-218.
LI Y, YANG N X, XIE G F, et al.Technology optimization on ultrasonic-acid extracting pectin from Premna puberula Pamp by Plackett-Burman combined with response surface methodology[J].Food and Fermentation Industries, 2021, 47(13):210-218.
[15] YOLMEH M, JAFARI S M.Applications of response surface methodology in the food industry processes[J].Food and Bioprocess Technology, 2017, 10(3):413-433.
[16] HE Y J, LIN G, RAO X Z, et al.Microalga Isochrysis galbana in feed for Trachinotus ovatus:Effect on growth performance and fatty acid composition of fish fillet and liver[J].Aquaculture International, 2018, 26(5):1 261-1 280.
[17] HE Y J, CHEN L J, ZHOU Y C, et al.Analysis and model delineation of marine microalgae growth and lipid accumulation in flat-plate photobioreactor[J].Biochemical Engineering Journal, 2016, 111:108-116.
[18] LI X M, WANG M Z, LIAO X H, et al.Two stages of N-deficient cultivation enhance the lipid content of microalga Scenedesmus sp[J].Journal of the American Oil Chemists’ Society, 2015, 92(4):503-512.
[19] 魏祖晨, 赵顺鑫, 周浓, 等.响应面法优化浙贝母氨基酸提取工艺及含量测定[J].食品与发酵工业, 2021, 47(8):180-188;196.
WEI Z C, ZHAO S X, ZHOU N, et al.The use of response surface methodology to optimize the extraction process and determine amino acids in Fritillaria thunbergii Mig[J].Food and Fermentation Industries, 2021, 47(8):180-188;196.
[20] WAGHMARE A G, SALVE M K, LEBLANC J G, et al.Concentration and characterization of microalgae proteins from Chlorella pyrenoidosa[J].Bioresources and Bioprocessing, 2016, 3:16.
[21] 肖雪花, 占凌云, 戴静璇, 等.培养条件对蛋白核小球藻生长及油脂合成的影响[J].中国油脂, 2021, 46(1):132-136.
XIAO X H, ZHAN L Y, DAI J X, et al.Effects of culture condition on the growth and oil synthesis of Chlorella pyrenoidosa[J].China Oils and Fats, 2021, 46(1):132-136.
[22] RAMANNA L, GULDHE A, RAWAT I, et al.The optimization of biomass and lipid yields of Chlorella sorokiniana when using wastewater supplemented with different nitrogen sources[J].Bioresource Technology, 2014, 168:127-135.
[23] ZHENG Y B, LI T T, YU X C, et al.High-density fed-batch culture of a thermotolerant microalga Chlorella sorokiniana for biofuel production[J].Applied Energy, 2013, 108:281-287.
[24] CHO H U, KIM Y M, CHOI Y N, et al.Effects of pH control and concentration on microbial oil production from Chlorella vulgaris cultivated in the effluent of a low-cost organic waste fermentation system producing volatile fatty acids[J].Bioresource Technology, 2015, 184:245-250.
[25] SHI X M, ZHANG X W, CHEN F.Heterotrophic production of biomass and lutein by Chlorella protothecoides on various nitrogen sources[J].Enzyme and Microbial Technology, 2000, 27(3-5):312-318.
[26] CHEN C Y, LU I C, NAGARAJAN D, et al.A highly efficient two-stage cultivation strategy for lutein production using heterotrophic culture of Chlorella sorokiniana MB-1-M12[J].Bioresource Technology, 2018, 253:141-147.
[27] 魏文志, 付立霞, 陈国宏.7种小球藻氨基酸组成及多元性分析[J].食品科学, 2011, 32(5):254-257.
WEI W Z, FU L X, CHEN G H.Multivariate analysis of amino acid composition of 7 types of Chlorella[J].Food Science, 2011, 32(5):254-257.
[28] BITO T, OKUMURA E, FUJISHIMA M, et al.Potential of Chlorella as a dietary supplement to promote human health[J].Nutrients, 2020, 12(9):2524.