狭义上的酵素是指生物体利用发酵原料所产生的具有催化作用的活性大分子物质,但目前市面上常见的酵素是广义上的酵素,包含酶和其他生物活性成分的混合物[1]。目前国内酵素市场还处于发展初期,市场上出现的酵素产品质量参差不齐,进口的酵素产品在国内售价普遍偏高,难以满足市场需求[2]。
果蔬中碳水化合物、酚类物质、维生素、膳食纤维及矿物质[3]等含量较高,是微生物发酵的优良基质,因此大量研究人员将果蔬作为发酵原料。从原料选择到发酵时长、发酵温度等各条件存在差异,生产过程中所发生的变化也有所不同,酵素生产的基本流程主要包括原料预处理、调整发酵液中的成分、发酵、后熟以及后处理等。在食用植物酵素生产中,常用到后熟陈酿这一工艺,专利CN105995684A公布了一种共生菌群酵素的制备方法,将所得的初酵素液静置于25~30 ℃的环境中后熟1~2个月,最终所得产品中含有高质量的酶以及益生菌分泌物。
植物酵素中的生物活性成分的差异会导致其功能活性的差异,市售酵素产品质量参差不齐,目前科学研究主要集中在开发不同原料酵素的发酵工艺方面,对植物酵素发酵、后熟过程中的变化情况,特别是对后熟过程中的变化情况研究较少。本试验以复合蔬菜汁为原料,以植物乳杆菌PMO08为发酵菌种,采用仪器分析等研究方法,对植物酵素发酵和后熟期间的变化情况进行研究,旨在对植物酵素在生产过程中的变化进行初步探讨,以期为该产品的开发应用提供理论依据。
1 材料与方法
1.1 材料与试剂
配料表见表1,复合蔬菜酵素配料种类及比例由前期试验确定;植物乳杆菌PMO08、质量分数为55%的低聚果糖溶液,韩国圃美多公司。
表1 复合蔬菜酵素配料表
Table 1 Ingredients for compound vegetable Jiaosu
原料茄子奶白菜韭菜奶黄瓜黄瓜二荆条水白菜苋菜冬瓜秋葵低聚果糖比例/%33.5010.000.501.001.001.0010.0010.0010.003.0019.99
葡萄糖标准品、NaH2PO4、Na2HPO4、没食子酸标准品、乙酸标准品、磷酸、柠檬酸钠、Na2CO3、Al(NO3)3、FeSO4,重庆跃翔化工有限公司;无水乙醇、三羟甲基氨基甲烷(trimethylol aminomethane,Tris)、FeCl3、NaOH、HCl,重庆市钛新化工有限公司;ABTS,美国Sigma公司;福林酚,上海源叶生物科技有限公司;芦丁标准品、有机酸标准品,北京索莱宝科技有限公司;平板计数培养基、马铃薯葡萄糖琼脂培养基,国药集团化学试剂有限公司;水杨酸、NaNO2,上海易恩化学技术有限公司;甲醇,上海阿拉丁生化科技股份有限公司;5-磺基水杨酸,北京华威锐科化工有限公司;邻苯三酚,毕得医药公司。
1.2 仪器与设备
UV-1780紫外可见分光光度计、GCMS-QP2010Plus气质联用仪、LC-20AD高效液相色谱,日本岛津公司;UltraSan PRO测色仪,美国Hunter Lab公司;L-8800全自动氨基酸分析仪,日本日立公司。
1.3 试验方法
1.3.1 样品预处理
将复合蔬菜汁(FQ)接种活化后的植物乳杆菌PMO08,接种量为0.01%(体积分数),37 ℃发酵72 h后,当总酸[(35.0±1.0) g/kg]、pH(3.3±0.5)、可溶性固形物[(13.0±1.0)%]时,停止发酵,得到复合蔬菜酵素(FH),将得到的样品FH与质量分数为55%的低聚果糖溶液按1∶1(体积比)混合后进入后熟阶段,后熟温度25 ℃,每周定时搅拌10 min,定时取样,所取样品以“SC-天数”形式命名。
1.3.2 复合蔬菜酵素发酵、后熟过程中的感官评价
参考T/CBFIA 08003—2017《食用植物酵素》感官要求及邢慧雅[4]的方法,结合本试验研究的复合蔬菜酵素产品的感官特点,由10位接受过感官评价培训的专业人员(5男5女)根据感官评价标准进行评分,感官评价标准见表2。
表2 复合蔬菜酵素感官评分标准
Table 2 Sensory scoring standards for compound vegetable Jiaosu
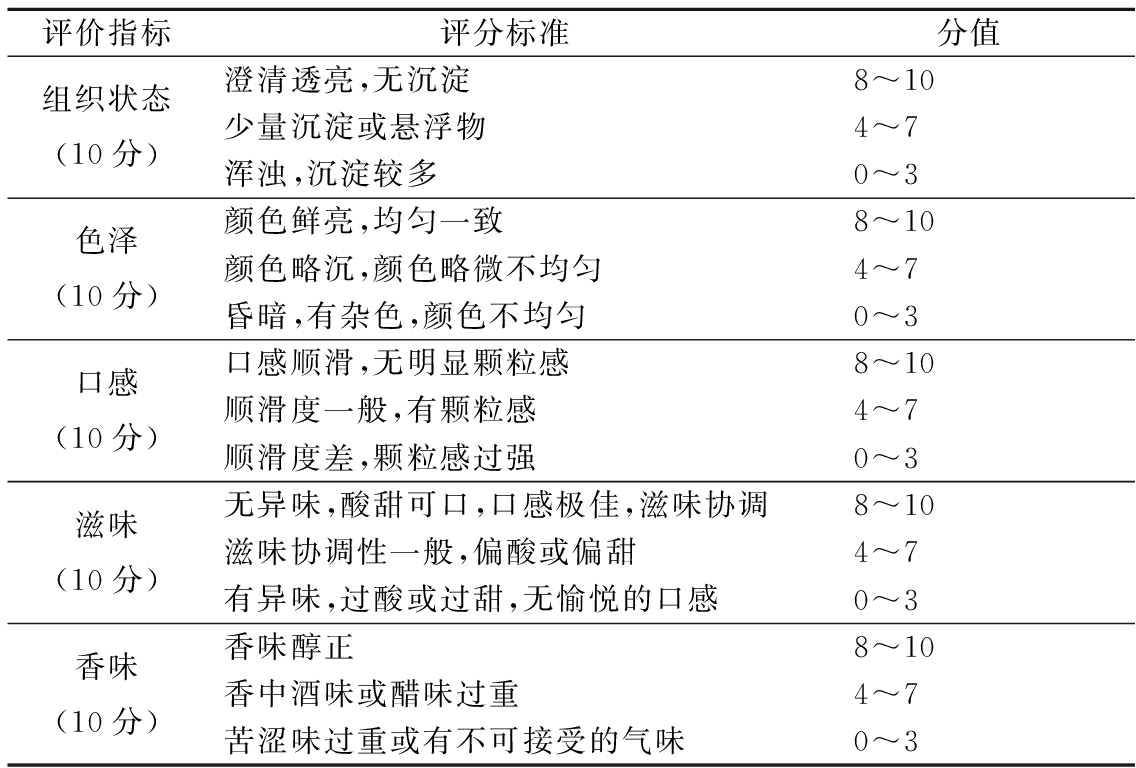
评价指标评分标准分值组织状态(10分)澄清透亮,无沉淀8~10少量沉淀或悬浮物4~7浑浊,沉淀较多0~3色泽(10分)颜色鲜亮,均匀一致8~10颜色略沉,颜色略微不均匀4~7昏暗,有杂色,颜色不均匀0~3口感(10分)口感顺滑,无明显颗粒感8~10顺滑度一般,有颗粒感4~7顺滑度差,颗粒感过强0~3滋味(10分)无异味,酸甜可口,口感极佳,滋味协调8~10滋味协调性一般,偏酸或偏甜4~7有异味,过酸或过甜,无愉悦的口感0~3香味(10分)香味醇正8~10香中酒味或醋味过重4~7苦涩味过重或有不可接受的气味0~3
1.3.3 复合蔬菜酵素发酵、后熟过程中的理化特性
1.3.3.1 理化指标的测定
pH值测定参照GB 5009.237—2016《食品pH值的测定》。总酸含量(以乳酸计)测定参照GB/T 12456—2008《食品中总酸的测定》。还原糖含量(以葡萄糖计)测定参照GB 5009.7—2016《食品中还原糖的测定》。可溶性固形物含量使用折光仪测定。
1.3.3.2 光学性质的测定
使用测色仪测定色值。参考MEYDAV等[5]的方法测定褐变度。浊度:4 ℃,8 000 r/min离心10 min后取上清液,在660 nm处测定吸光度。
1.3.3.3 离心沉淀率的测定
取50 g样品,5 000 r/min离心10 min,去除上清液,精确称量剩余沉淀的质量。
1.3.3.4 微生物指标的测定
菌落总数测定参照GB 4789.2—2016《食品微生物学检验菌落总数测定》。霉菌数测定参照GB 4789.15—2016《食品微生物学检验霉菌和酵母计数》。
1.3.4 复合蔬菜酵素发酵、后熟过程中生物活性成分的含量
1.3.4.1 总酚含量的测定
参考ADOM等[6]和CHU等[7]的方法,以没食子酸为标准品绘制的标准曲线为:y=0.021 3x+0.036 8(R2=0.994 9)。
1.3.4.2 总黄酮含量的测定
参考LIU等[8]的方法,以为芦丁标准品绘制的标准曲线为:y=0.013x-0.034(R2=0.996 6)。
1.3.4.3 有机酸含量的测定
参考GB 5009.157—2016《食品有机酸的测定》以及甘奕[9]的方法并稍作修改。色谱条件:LC-20AD型号高效液相色谱仪;紫外检测器(检测波长210 nm);色谱柱:Chromplus C18柱,250 mm×4.6 mm×5 μm;柱箱温度30 ℃;进样量20 μL;流动相为0.1%(体积分数)的磷酸溶液和甲醇;流速0.5 mL/min。8种有机酸的回归方程见表3。
表3 八种有机酸的回归方程
Table 3 Regression equations for the eight organic acids
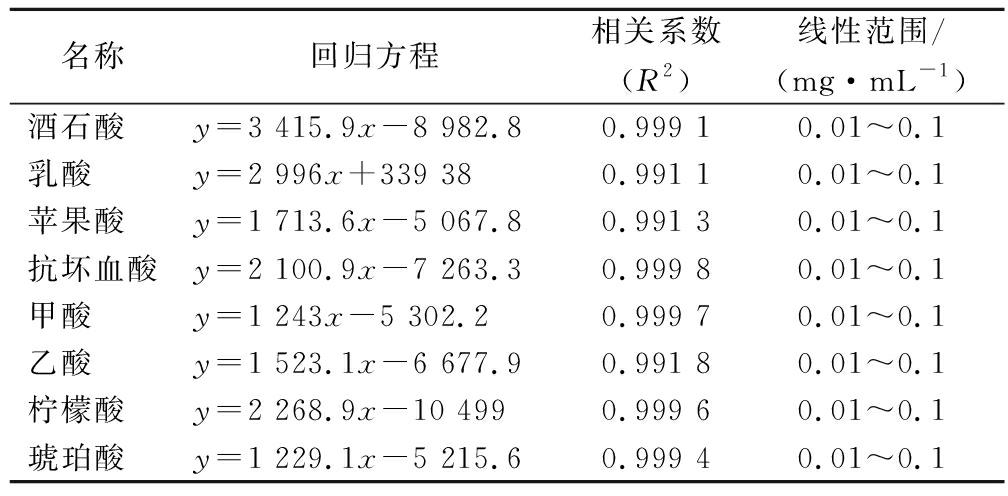
名称回归方程相关系数(R2)线性范围/(mg·mL-1)酒石酸y=3 415.9x-8 982.80.999 10.01~0.1乳酸y=2 996x+339 380.991 10.01~0.1苹果酸y=1 713.6x-5 067.80.991 30.01~0.1抗坏血酸y=2 100.9x-7 263.30.999 80.01~0.1甲酸y=1 243x-5 302.20.999 70.01~0.1乙酸y=1 523.1x-6 677.90.991 80.01~0.1柠檬酸y=2 268.9x-10 4990.999 60.01~0.1琥珀酸y=1 229.1x-5 215.60.999 40.01~0.1
1.3.4.4 游离氨基酸含量的测定
采用全自动氨基酸分析仪进行测定。取1 mL样品,加入1 mL 30 g/L的5-磺基水杨酸溶液,4 ℃静置30 min取出,加入0.06 mol/L的HCl溶液0.5 mL、1%(质量分数)的EDTA-2Na溶液0.5 mL,4 ℃,10 000 r/min离心10 min,取1 mL上清液,加入pH 3.0柠檬酸钠缓冲溶液2 mL,4 ℃、10 000 r/min离心10 min,取上清液过0.22 μm滤膜得到待测样品。
1.3.5 复合蔬菜酵素发酵、后熟过程中抗氧化能力的变化
1.3.5.1 ·OH清除能力的测定
配制不同浓度的待测液,在1 mL待测液中加入1 mL 3 mmol/L的FeSO4溶液、1 mL 3 mmol/L的水杨酸-乙醇溶液和1 mL 3 mmol/L的H2O2溶液,37 ℃水浴30 min,510 nm处测定吸光度值。
1.3.5.2 ·O2-清除能力的测定
配制不同浓度待测液,参考MHATRE等[10]的方法取1 mL待测液进行反应,加入0.5 mL 10 mmol/L的HCl溶液终止反应,325 nm处测定吸光度值。
1.3.5.3 ABTS阳离子自由基清除能力的测定
配制不同浓度待测液,参考EREL[11]的方法取待测液1 mL进行试验,反应结束后在734 nm处测定吸光度值。
1.4 数据处理与分析
试验平行进行3次,采用Origin 8.1绘制图表,采用SPSS 21.0、Excel 2007等进行数据分析。
2 结果与分析
2.1 复合蔬菜酵素发酵、后熟过程中感官评价的变化
如图1所示,经过植物乳杆菌PMO08发酵后,复合蔬菜酵素的总体可接受度略有提升,但总体评分仍然偏低,后熟过程对复合蔬菜酵素的感官评分有显著影响,可见其对提高复合蔬菜酵素的感官品质十分必要。这可能是未经发酵的复合蔬菜汁带有较强青草气味,风味不协调,导致香味、滋味得分较低,发酵后,复合蔬菜酵素中含有丰富的微生物代谢产物,丰富了滋味,但发酵后酸味过浓,影响了感官评分,后熟过程中,酵素内部发生复杂的反应,香气更协调,总体评分上升。
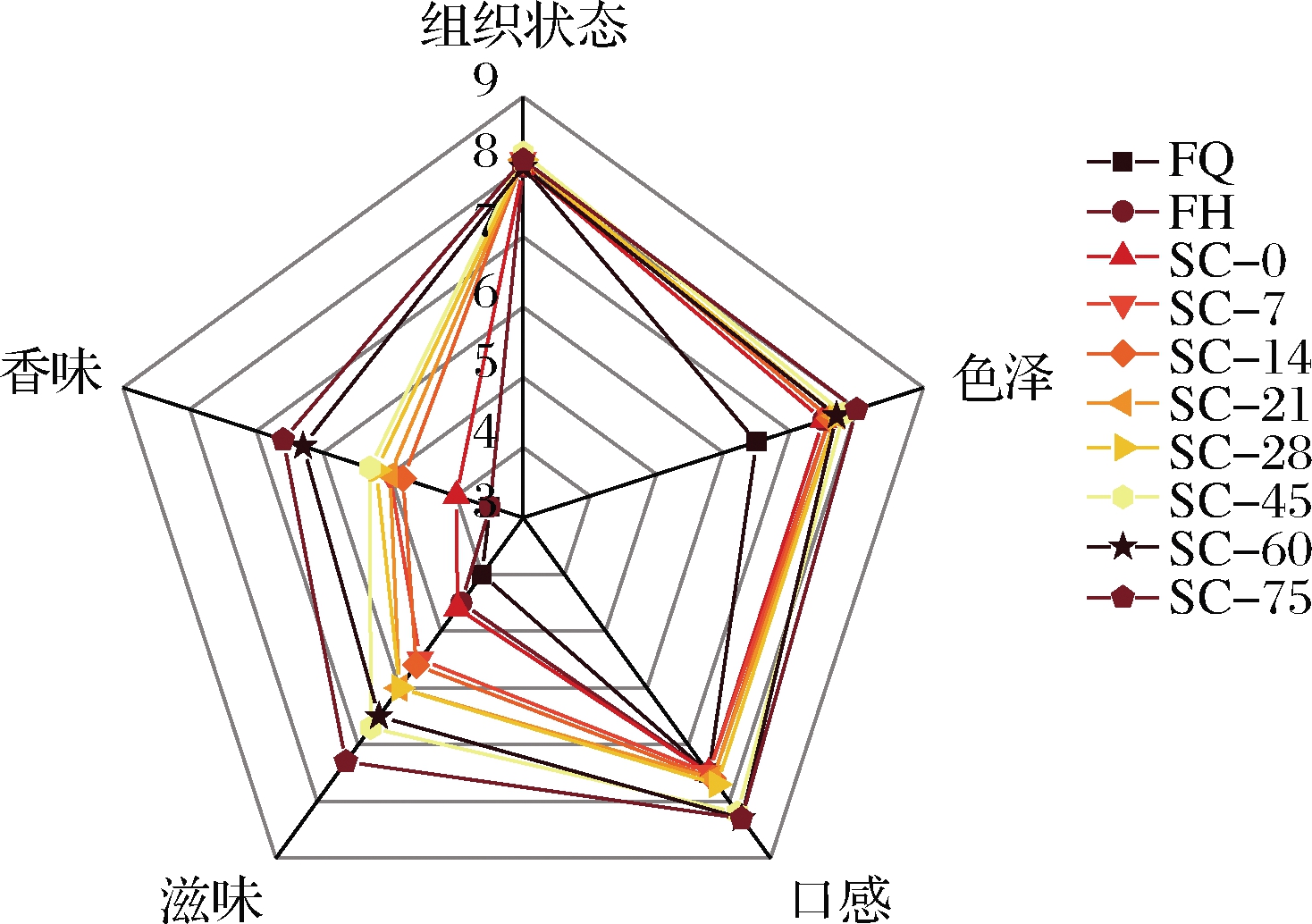
图1 复合蔬菜酵素发酵、后熟过程中感官评价雷达图
Fig.1 Radar chart for sensory evaluation of compound vegetable Jiaosu during fermentation and post-ripening
2.2 复合蔬菜酵素发酵、后熟过程中理化特性的变化
2.2.1 理化指标的变化
由表4可知,FQ中的总酸含量低,pH值相对较高,发酵后,FH总酸含量大幅上升,pH值降至3.40,这是由于植物乳杆菌的代谢过程产生了酸类物质,使总酸含量增加,pH值降低。后熟过程中,总酸含量先上升后下降,pH值总体来说变化范围不大(3.37~3.43),与高庆超[12]的研究一致,可能是因为刚进入后熟阶段时,剩余的植物乳杆菌继续利用糖类发酵产生酸类物质,后熟14 d后,剩余的菌利用、消耗有机酸,使总酸含量减少后熟过程中,还原糖和可溶性固形物含量均先升高后降低,最后趋于稳定,可能是因为在后熟初期,剩余活菌数较少,对糖类的代谢较慢,而植物乳杆菌发酵产生了胞外多糖,消耗速率比产生速率慢,使发酵液中还原糖和可溶性固形物含量有所上升,而在后熟后期,糖类消耗速率增加,或胞外多糖产生速率降低,使发酵液中还原糖和可溶性固形物含量有所下降。[13]。
表4 复合蔬菜酵素发酵、后熟过程中理化指标的变化
Table 4 Changes in physio-chemical indexes of compound vegetable Jiaosu during fermentation and post-ripening
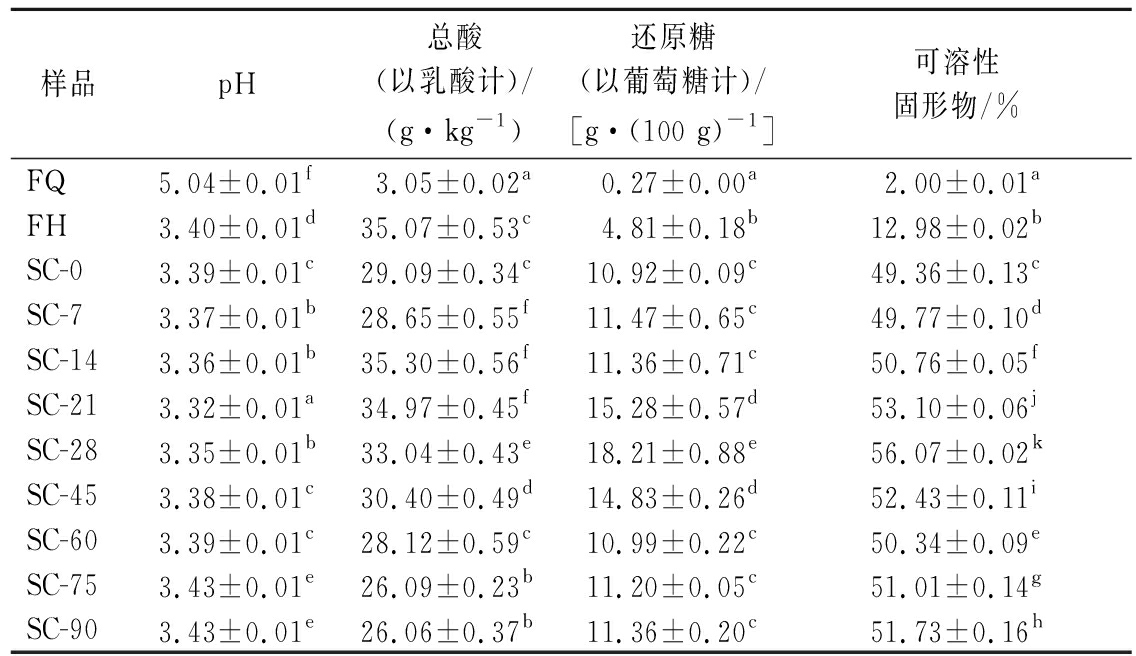
样品pH总酸(以乳酸计)/(g·kg-1)还原糖(以葡萄糖计)/[g·(100 g)-1]可溶性固形物/%FQ5.04±0.01f3.05±0.02a0.27±0.00a2.00±0.01aFH3.40±0.01d35.07±0.53c4.81±0.18b12.98±0.02bSC-03.39±0.01c29.09±0.34c10.92±0.09c49.36±0.13cSC-73.37±0.01b28.65±0.55f11.47±0.65c49.77±0.10dSC-143.36±0.01b35.30±0.56f11.36±0.71c50.76±0.05fSC-213.32±0.01a34.97±0.45f15.28±0.57d53.10±0.06jSC-283.35±0.01b33.04±0.43e18.21±0.88e56.07±0.02kSC-453.38±0.01c30.40±0.49d14.83±0.26d52.43±0.11iSC-603.39±0.01c28.12±0.59c10.99±0.22c50.34±0.09eSC-753.43±0.01e26.09±0.23b11.20±0.05c51.01±0.14gSC-903.43±0.01e26.06±0.37b11.36±0.20c51.73±0.16h
注:同列不同小写字母表示差异显著(P<0.05)(下同)
2.2.2 光学性质的变化
由表5可知,在发酵、后熟过程中L*、a*、b*值发生显著变化,FH与FQ相比,L*值显著上升,a*值显著下降,b*值显著上升。在后熟过程中,红度逐渐减小,体系越来越偏绿。经过发酵后,样品褐变程度显著降低,色泽更鲜亮,与L*值反应情况一致,样品浊度显著降低,随着后熟的进行,褐变程度显著下降后趋于稳定,浊度先降低后上升,这可能与多酚物质和蛋白质的相互作用相关[14]。
表5 复合蔬菜酵素发酵、后熟过程中光学性质的变化
Table 5 Changes in the optical properties of compound vegetable Jiaosu during fermentation and post-ripening

样品名称L*a*b*ΔEC*A420A660FQ29.99±0.14a3.54±0.08e5.73±0.23bc-6.83±0.11d0.42±0.01e0.05±0.00bFH33.18±0.07f1.57±0.19d6.70±0.72f3.94±0.18b6.89±0.66d0.25±0.01a0.03±0.00aSC-032.54±0.15e1.22±0.07c6.48±0.03ef3.53±0.15a6.59±0.05d0.36±0.00d0.22±0.00fSC-731.74±0.06bc0.81±0.11b6.12±0.33e3.28±0.11a6.17±0.34bcd0.35±0.01d0.21±0.01eSC-1431.41±0.45b0.70±0.04b6.06±0.63c3.28±0.22a6.10±0.63bcd0.30±0.00b0.13±0.00cSC-2132.06±0.08cd0.74±0.11bc5.49±0.24ad3.50±0.07a5.54±0.26abc0.30±0.00b0.14±0.00cSC-2833.29±0.03f0.79±0.03b6.27±0.21e4.34±0.04c6.32±0.21bcd0.29±0.00b0.14±0.00cSC-4533.19±0.16f0.61±0.03b6.33±0.49e4.41±0.07c6.36±0.50cd0.29±0.00b0.15±0.00cSC-6032.80±0.24e0.33±0.06a5.02±0.39f4.35±0.18c5.03±0.39a0.30±0.00b0.16±0.00cSC-7532.27±0.06d0.32±0.02bd5.38±0.12ae3.96±0.03b5.39±0.12ab0.32±0.00c0.18±0.00dSC-9031.99±0.06cd0.18±0.11bcd5.36±0.64ade3.98±0.08b5.36±0.64ab0.33±0.01c0.22±0.00f
2.2.3 离心沉淀率的变化
如图2所示,发酵、后熟过程中离心沉淀率显著下降,可能是发酵过程中产生大量酶类,使原料中的大分子物质降解为小分子,体系稳定性提高。徐萌萌[15]研究发现果蔬汁的离心沉淀率均较高,多在7%~10%,发酵果蔬汁中可溶性固形物含量较高容易使产品出现沉淀或分层的现象,而本试验中的复合蔬菜酵素后熟90 d后的离心沉淀率为3.3%,说明植物乳杆菌PMO08发酵复合蔬菜汁能显著提高体系的稳定性。
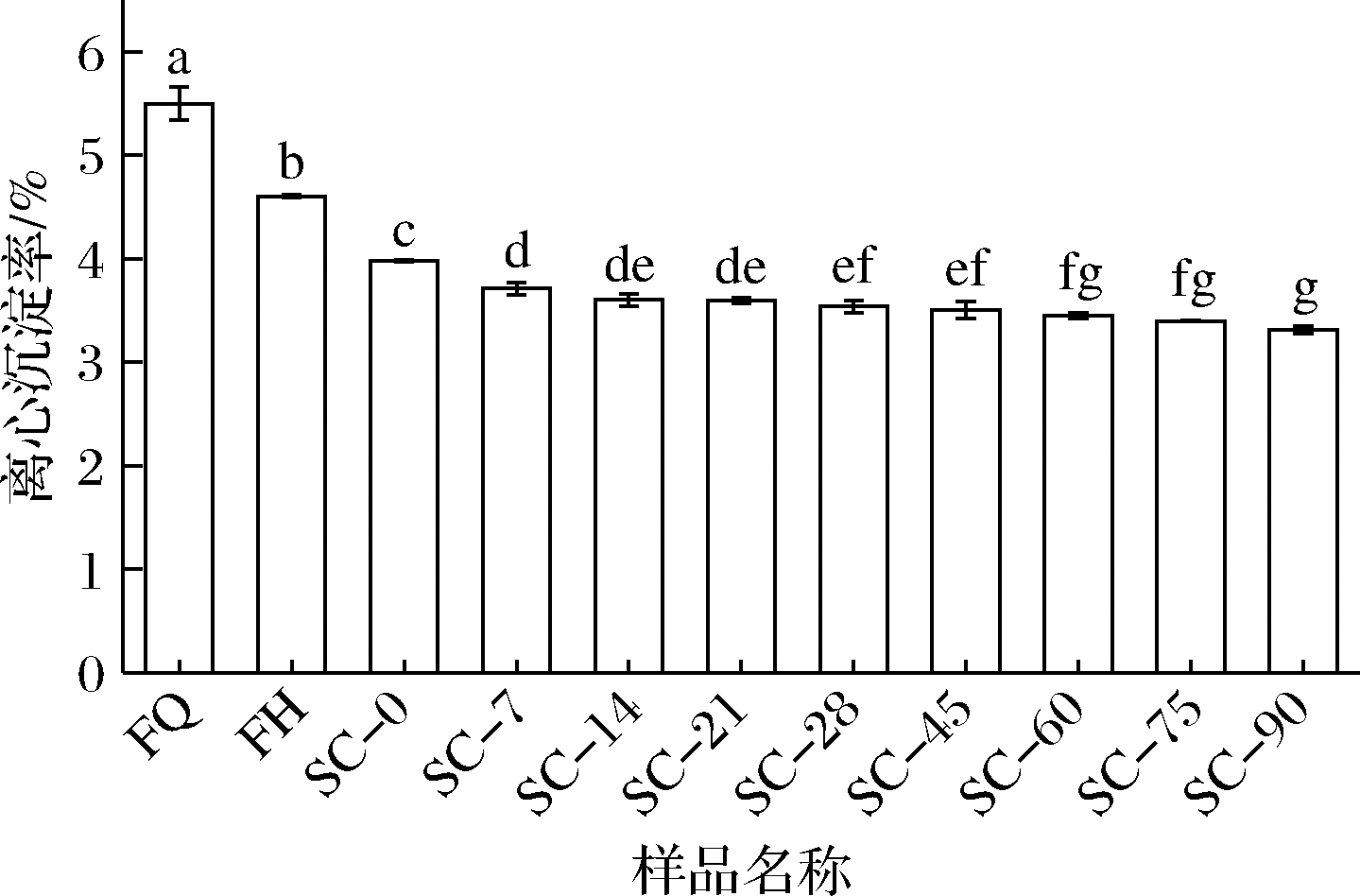
图2 复合蔬菜酵素发酵、后熟过程中离心沉淀率的变化
Fig.2 Change of centrifugal sedimentation rate during fermentation and post-ripening of compound vegetable Jiaosu
注:不同字母表示差异显著(P<0.05)(下同)
2.2.4 微生物指标的变化
如表6所示,菌落总数在发酵后略微降低,但不显著(P>0.05),在后熟阶段,菌落总数增至6.95 lg CFU/mL,这可能是发酵后,原料中的营养物质无法满足微生物生长的需求,加入糖原后在短时间大量繁殖,随着后熟的进行,过多的糖原以及总酸的增加抑制微生物的生长繁殖,导致菌落总数不断下降,也可能是因为酚类物质的增多,在后熟期间抑制了微生物的生长繁殖。在整个发酵、后熟过程中,霉菌均未检出。
表6 复合蔬菜酵素发酵、后熟过程中微生物指标的变化
Table 6 Changes in microbial indicators during fermentation and post-ripening of compound vegetable Jiaosu

样品名称菌落总数(lg CFU/mL)霉菌(lg CFU/mL)FQ3.94±0.00f-FH3.90±0.01f-SC-06.95±0.01g-SC-73.18±0.02e-SC-143.15±0.03e-SC-213.00±0.04bc-SC-283.01±0.02bc-SC-453.04±0.03c-SC-603.02±0.05bc-SC-752.98±0.01ab-SC-902.94±0.01a-
注:“-”表示未检出(下同)
2.3 复合蔬菜酵素发酵、后熟过程中生物活性成分的变化
2.3.1 总酚含量的测定
如图3所示,发酵后总酚含量显著增加了71%,这与KAYATH等[16]的研究结果一致,由于植物乳杆菌发酵能够从植物细胞壁中释放出酚类化合物[17]。同时植物乳杆菌进行发酵会使pH值降低,从而激活能参与复杂酚类物质水解的各种酶,有助于简单酚类物质的转化和高分子质量酚类化合物的解聚[18],研究发现乳酸菌产生的有机酸也能使原料中的酚类物质呈游离态,进而增加总酚含量[19]。在后熟60 d后,总酚显著下降的原因可能是酚类物质浓度上升到一定程度后抑制了某些微生物的生长,而这些微生物为了正常繁殖会产生酶类,从而达到降解酚类物质的目的[20]。但总体来说发酵和后熟均能显著提高复合蔬菜酵素的总酚含量。
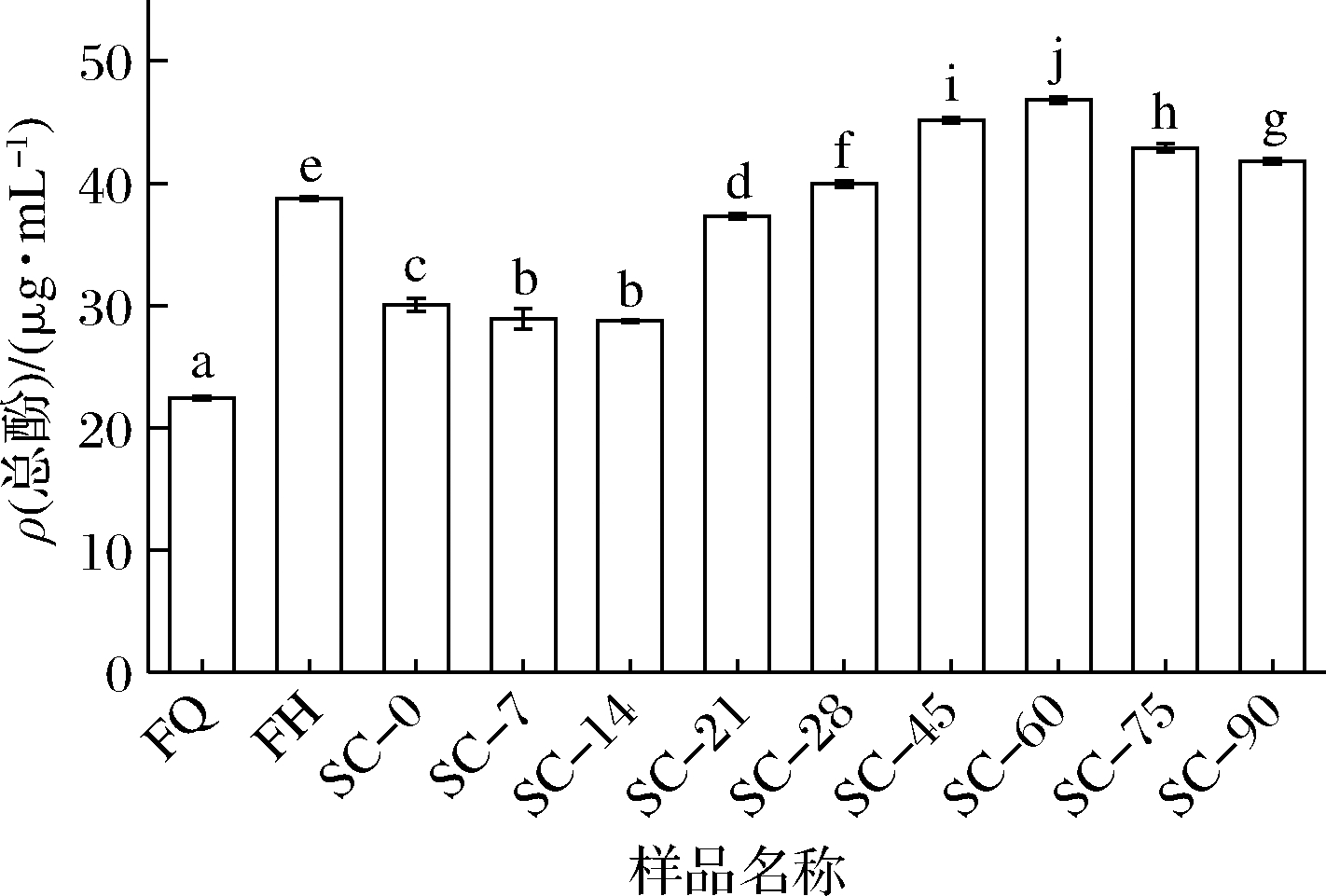
图3 复合蔬菜酵素发酵、后熟过程中总酚含量的变化
Fig.3 Changes in total phenolic content during fermentation and post-ripening of compound vegetable Jiaosu
2.3.2 总黄酮含量的测定
如图4所示,发酵后总黄酮含量显著增加。在植物内,黄酮类物质主要以与糖结合的形式存在,经过发酵后,糖类被消耗,黄酮类物质析出,使发酵体系内总黄酮含量增加,此外,与酚类类似,黄酮类物质能在微生物发酵过程中从植物细胞内释放出来,从而使其含量增加。在后熟45 d达到最大值,随后显著下降,发酵和后熟均能显著提高复合蔬菜酵素的总黄酮含量。
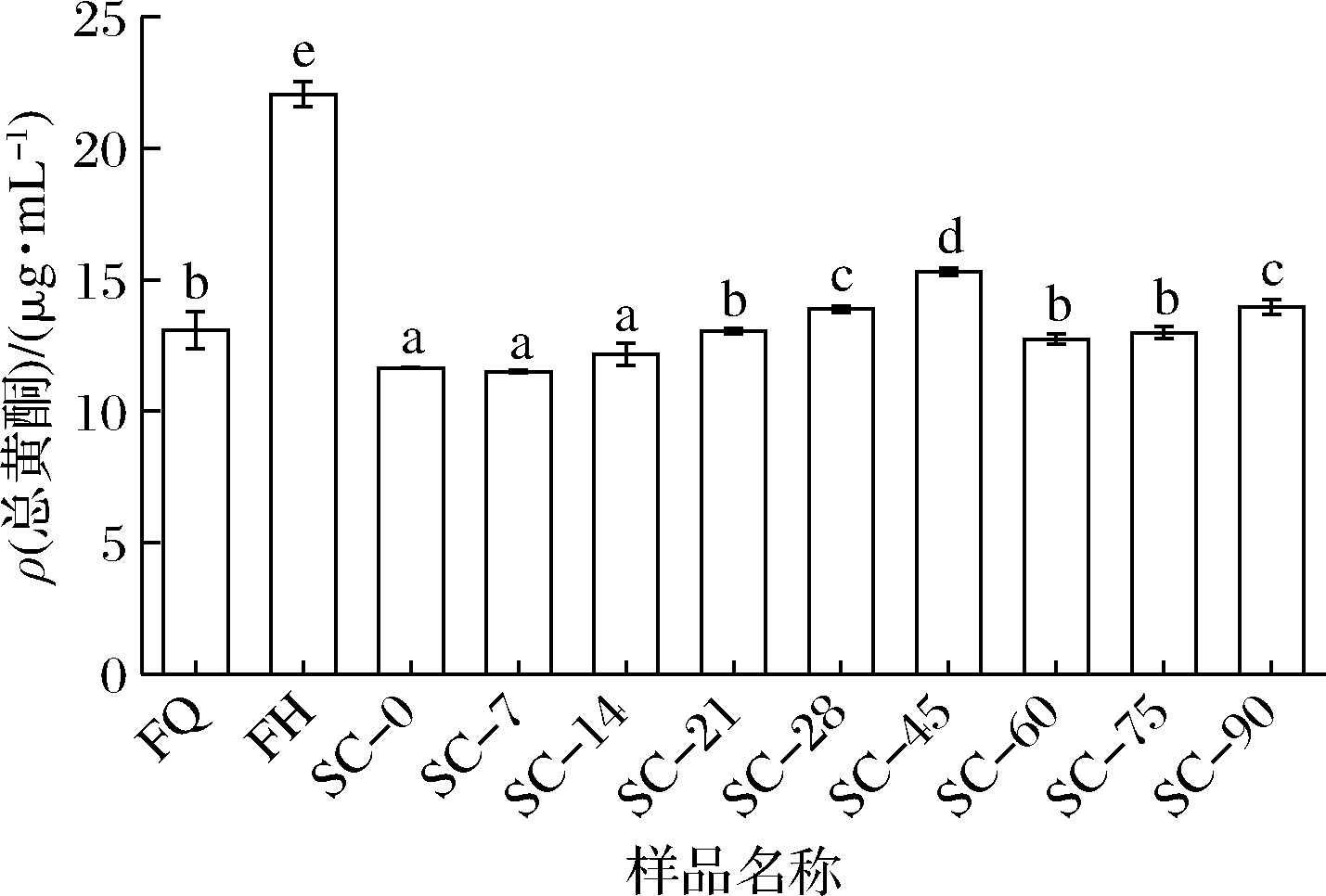
图4 复合蔬菜酵素发酵、后熟过程中总黄酮含量的变化
Fig.4 Changes in total flavonoid content during fermentation and post-ripening of compound vegetable Jiaosu
2.3.3 有机酸含量的测定
如表7所示,本试验中的复合蔬菜酵素中含有酒石酸、乳酸、抗坏血酸、甲酸、乙酸、柠檬酸、琥珀酸7种有机酸,其中乳酸含量远远高于其他有机酸,在发酵后样品中乳酸含量显著上升,达到12.98 mg/mL。在后熟期间乳酸含量略有波动,总体显著上升,后熟90 d时乳酸质量浓度为12.28 mg/mL。酒石酸、抗坏血酸、乙酸含量均在发酵后和后熟期间显著上升。甲酸、柠檬酸、琥珀酸的含量在发酵后显著降低,尤其是柠檬酸,含量由0.25 mg/mL下降到0.02 mg/mL,与YU等[21]的研究一致,在后熟过程中甲酸、柠檬酸、琥珀酸的含量不断波动,但含量与后熟0 d相比显著上升。
表7 复合蔬菜酵素发酵、后熟过程中有机酸的变化
Table 7 Changes in organic acids during fermentation and post-ripening of compound vegetable Jiaosu
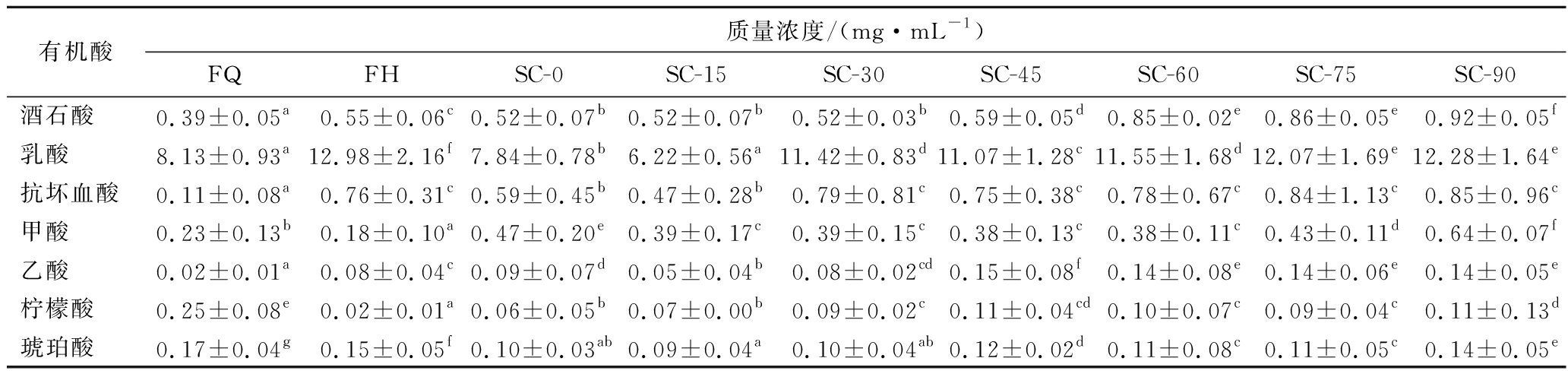
有机酸质量浓度/(mg·mL-1)FQFHSC-0SC-15SC-30SC-45SC-60SC-75SC-90酒石酸0.39±0.05a0.55±0.06c0.52±0.07b0.52±0.07b0.52±0.03b0.59±0.05d0.85±0.02e0.86±0.05e0.92±0.05f乳酸8.13±0.93a12.98±2.16f7.84±0.78b6.22±0.56a11.42±0.83d11.07±1.28c11.55±1.68d12.07±1.69e12.28±1.64e抗坏血酸0.11±0.08a0.76±0.31c0.59±0.45b0.47±0.28b0.79±0.81c0.75±0.38c0.78±0.67c0.84±1.13c0.85±0.96c甲酸0.23±0.13b0.18±0.10a0.47±0.20e0.39±0.17c0.39±0.15c0.38±0.13c0.38±0.11c0.43±0.11d0.64±0.07f乙酸0.02±0.01a0.08±0.04c0.09±0.07d0.05±0.04b0.08±0.02cd0.15±0.08f0.14±0.08e0.14±0.06e0.14±0.05e柠檬酸0.25±0.08e0.02±0.01a0.06±0.05b0.07±0.00b0.09±0.02c0.11±0.04cd0.10±0.07c0.09±0.04c0.11±0.13d琥珀酸0.17±0.04g0.15±0.05f0.10±0.03ab0.09±0.04a0.10±0.04ab0.12±0.02d0.11±0.08c0.11±0.05c0.14±0.05e
2.3.4 游离氨基酸含量的测定
如表8所示,FQ中含有17种游离氨基酸,发酵后,游离氨基酸含量显著减少,蛋氨酸未检出,这与KHAN等[22]的研究结果一致,这有可能是原料中的氨基酸为植物乳杆菌PMO08提供了氮源,这些氨基酸为其他代谢产物的合成提供了前体物质,或者由于复杂反应的进行,导致游离氨基酸含量显著降低,如美拉德反应和酶转化等[23]。在后熟期间,半胱氨酸在后熟30 d后没有检出,谷氨酸含量显著降低,其余游离氨基酸含量均显著上升,原因可能是后熟阶段剩余的植物乳杆菌利用蛋白质,将其分解产生氨基酸,使其含量升高。
表8 复合蔬菜酵素发酵、后熟过程中游离氨基酸的变化
Table 8 Changes in free amino acids during the fermentation and post-ripening of compound vegetable Jiaosu
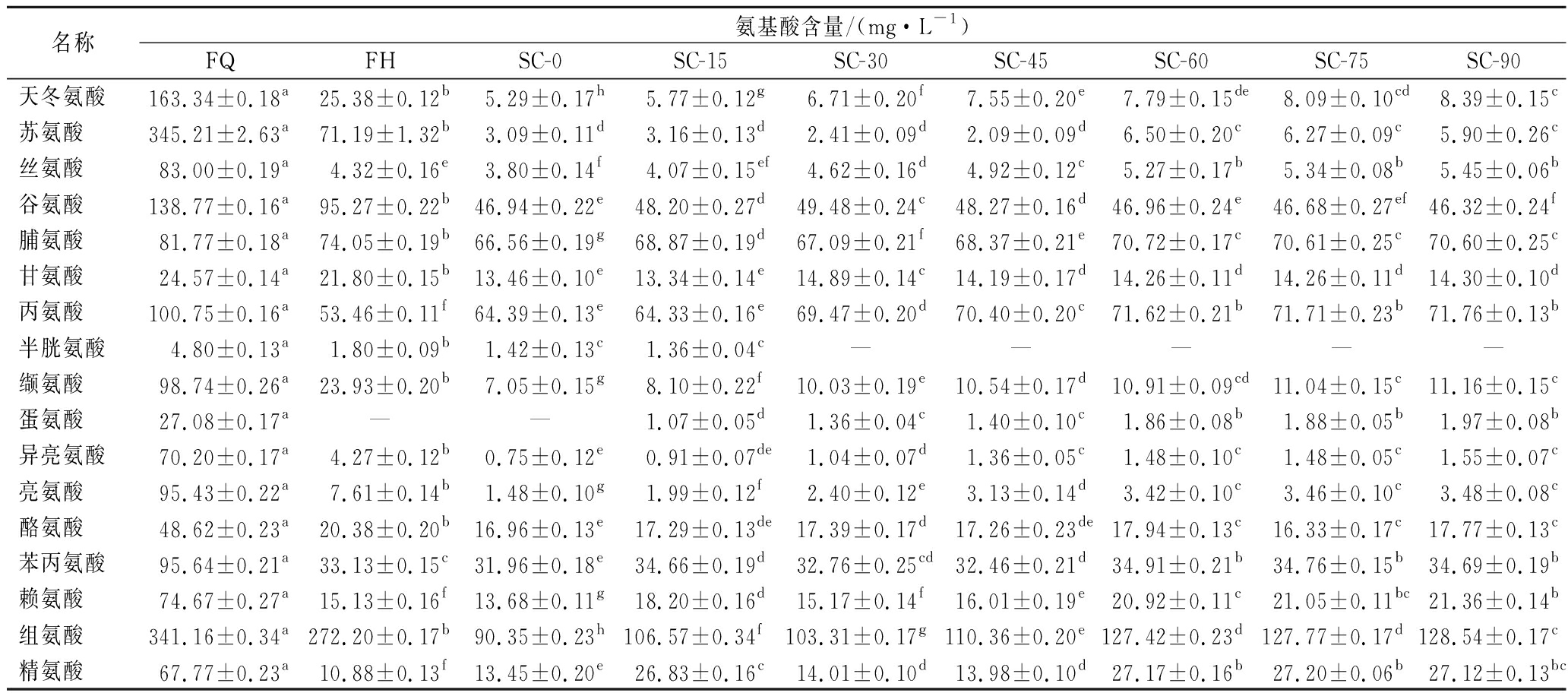
名称氨基酸含量/(mg·L-1)FQFHSC-0SC-15SC-30SC-45SC-60SC-75SC-90天冬氨酸163.34±0.18a25.38±0.12b5.29±0.17h5.77±0.12g6.71±0.20f7.55±0.20e7.79±0.15de8.09±0.10cd8.39±0.15c苏氨酸345.21±2.63a71.19±1.32b3.09±0.11d3.16±0.13d2.41±0.09d2.09±0.09d6.50±0.20c6.27±0.09c5.90±0.26c丝氨酸83.00±0.19a4.32±0.16e3.80±0.14f4.07±0.15ef4.62±0.16d4.92±0.12c5.27±0.17b5.34±0.08b5.45±0.06b谷氨酸138.77±0.16a95.27±0.22b46.94±0.22e48.20±0.27d49.48±0.24c48.27±0.16d46.96±0.24e46.68±0.27ef46.32±0.24f脯氨酸81.77±0.18a74.05±0.19b66.56±0.19g68.87±0.19d67.09±0.21f68.37±0.21e70.72±0.17c70.61±0.25c70.60±0.25c甘氨酸24.57±0.14a21.80±0.15b13.46±0.10e13.34±0.14e14.89±0.14c14.19±0.17d14.26±0.11d14.26±0.11d14.30±0.10d丙氨酸100.75±0.16a53.46±0.11f64.39±0.13e64.33±0.16e69.47±0.20d70.40±0.20c71.62±0.21b71.71±0.23b71.76±0.13b半胱氨酸4.80±0.13a1.80±0.09b1.42±0.13c1.36±0.04c—————缬氨酸98.74±0.26a23.93±0.20b7.05±0.15g8.10±0.22f10.03±0.19e10.54±0.17d10.91±0.09cd11.04±0.15c11.16±0.15c蛋氨酸27.08±0.17a——1.07±0.05d1.36±0.04c1.40±0.10c1.86±0.08b1.88±0.05b1.97±0.08b异亮氨酸70.20±0.17a4.27±0.12b0.75±0.12e0.91±0.07de1.04±0.07d1.36±0.05c1.48±0.10c1.48±0.05c1.55±0.07c亮氨酸95.43±0.22a7.61±0.14b1.48±0.10g1.99±0.12f2.40±0.12e3.13±0.14d3.42±0.10c3.46±0.10c3.48±0.08c酪氨酸48.62±0.23a20.38±0.20b16.96±0.13e17.29±0.13de17.39±0.17d17.26±0.23de17.94±0.13c16.33±0.17c17.77±0.13c苯丙氨酸95.64±0.21a33.13±0.15c31.96±0.18e34.66±0.19d32.76±0.25cd32.46±0.21d34.91±0.21b34.76±0.15b34.69±0.19b赖氨酸74.67±0.27a15.13±0.16f13.68±0.11g18.20±0.16d15.17±0.14f16.01±0.19e20.92±0.11c21.05±0.11bc21.36±0.14b组氨酸341.16±0.34a272.20±0.17b90.35±0.23h106.57±0.34f103.31±0.17g110.36±0.20e127.42±0.23d127.77±0.17d128.54±0.17c精氨酸67.77±0.23a10.88±0.13f13.45±0.20e26.83±0.16c14.01±0.10d13.98±0.10d27.17±0.16b27.20±0.06b27.12±0.13bc
2.4 复合蔬菜酵素发酵、后熟过程中抗氧化能力的变化
2.4.1 ·OH清除能力的测定
如图5所示,浓度为400 μL/mL时,所有样品的·OH清除率均在97.85%~99.98%,FQ的IC50值显著高于其他样品(P<0.05),说明植物乳杆菌PMO08发酵能显著增强复合蔬菜酵素对·OH抑制能力,在后熟期间,后熟0 d时,IC50值最大,说明后熟过程有利于增强复合蔬菜酵素的·OH抑制能力。
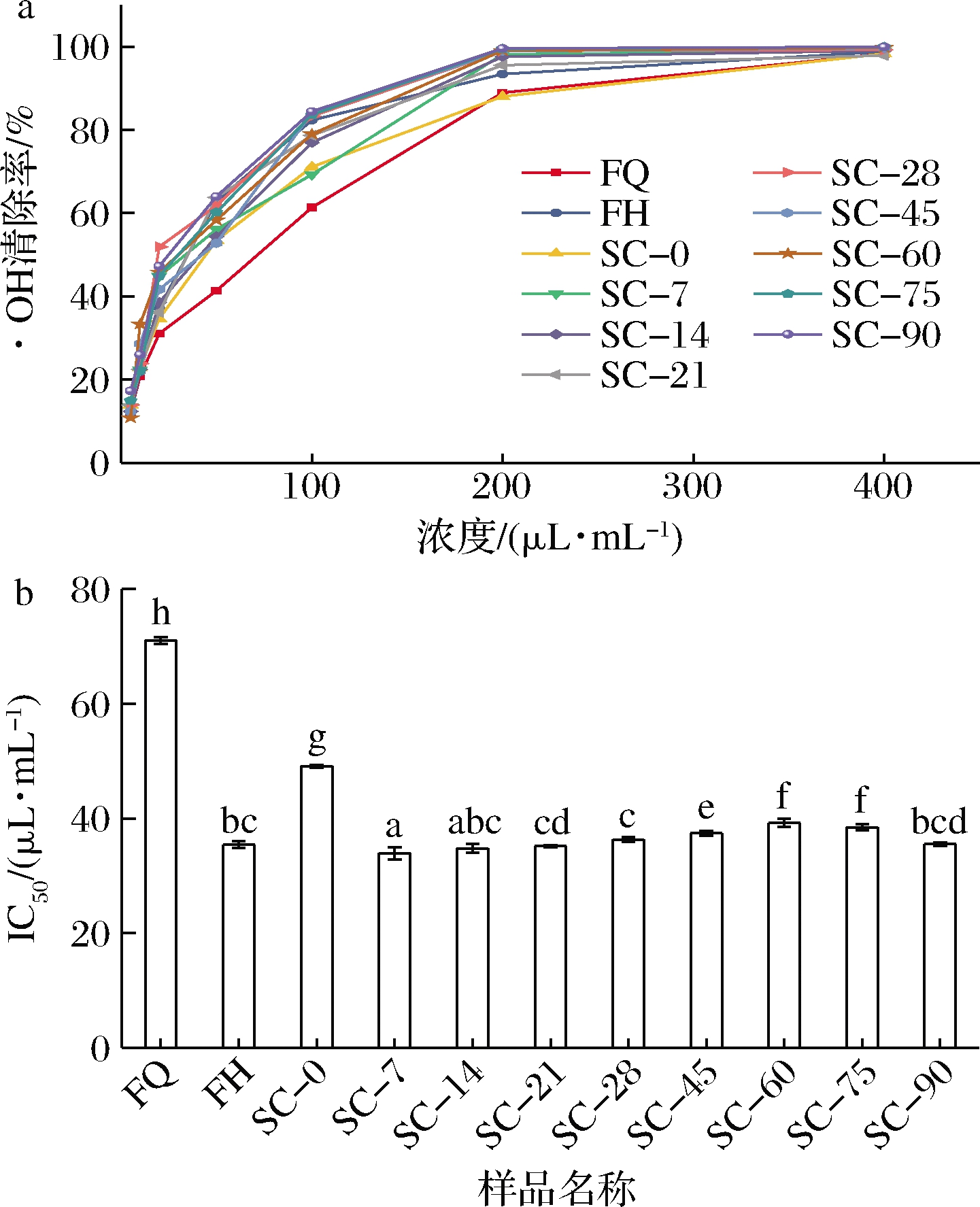
a-·OH清除率;b-·OH的半抑制浓度IC50
图5 复合蔬菜酵素发酵、后熟过程中·OH清除能力的变化
Fig.5 Changes in hydroxyl radical scavenging capacity during fermentation and post-ripening of compound vegetable Jiaosu
2.4.2 ·O2-清除能力的测定
如图6所示,浓度为800 μL/mL时,·O2-清除率均在60%以上,经发酵后·O2-清除能力减弱,随着后熟的进行,IC50值不断降低,最终趋于稳定,后熟90 d的IC50值为273.30 μL/mL,显著低于FQ,说明后熟过程能提高复合蔬菜酵素对·O2-的抑制能力。

a-·O2-清除率;b-·O2-的半抑制浓度IC50
图6 复合蔬菜酵素发酵、后熟过程中·O2-清除能力的变化
Fig.6 Changes in superoxide anion radical scavenging capacity during fermentation and post-ripening of compound vegetable Jiaosu
2.4.3 ABTS阳离子自由基清除能力的测定
如图7所示,浓度为50 μL/mL时,所有样品的ABTS阳离子自由基清除率在93.51%~99.95%,FQ的清除率最低,为93.51%,其余均在98.65%以上。FQ的IC50值为12.28 μL/mL,FH为10.63 μL/mL,发酵后ABTS阳离子自由基清除能力增强,后熟0 d的IC50值为8.05 μL/mL,随着后熟的进行,IC50值不断降低,最终趋于稳定,说明后熟过程能显著提高复合蔬菜酵素对ABTS阳离子自由基清除的抑制能力(P<0.05)。
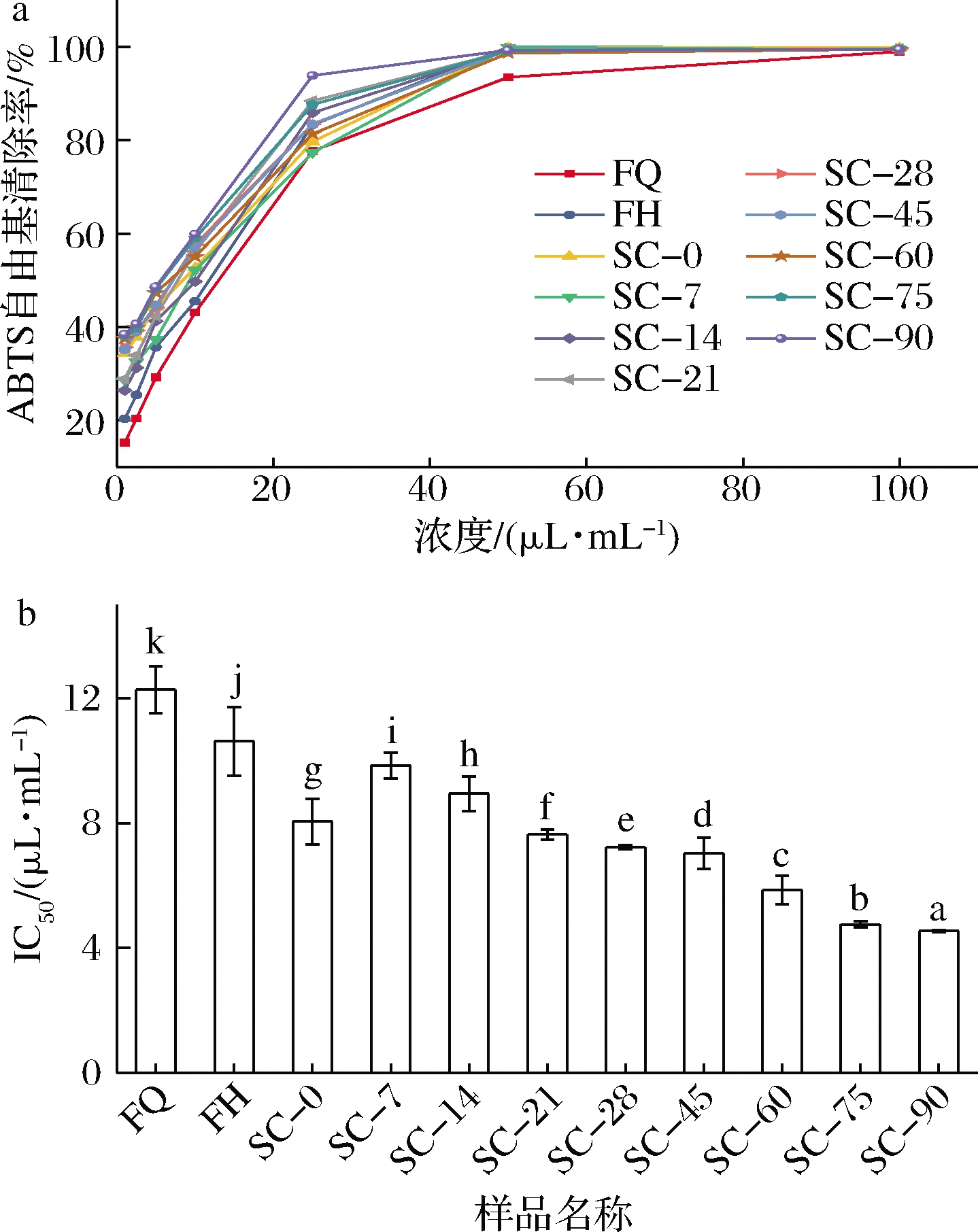
a-ABTS阳离子自由基清除率;b-ABTS阳离子自由基的半抑制浓度IC50
图7 复合蔬菜酵素发酵、后熟过程中ABTS阳离子自由基清除能力的变化
Fig.7 Changes in ABTS free radical scavenging capacity during fermentation and post-ripening of compound vegetable Jiaosu
3 结论与讨论
本研究采用茄子、奶白菜、水白菜等作为原料,用植物乳杆菌PMO08发酵,探究复合蔬菜酵素发酵、后熟过程中感官评价、理化特性、生物活性成分以及抗氧化活性的变化情况。研究发现,植物乳杆菌PMO08发酵及后熟过程均能提高产品的品质,在后熟后期产品品质趋于稳定,这可能是发酵过程中产生大量酶类,使原料中的大分子物质降解为小分子,使产品更稳定。发酵和后熟2个过程对产品的生物活性成分含量以及抗氧化活性有显著影响,发酵过程能显著提高复合蔬菜酵素的·OH、ABTS阳离子自由基清除能力,后熟过程中,7种有机酸含量均显著上升,·O2-、ABTS阳离子自由基清除能力显著提升,这可能是发酵使多酚等生物活性成分从植物细胞壁中释放出来,从而影响了复合蔬菜酵素的生物活性成分及其抗氧化活性。在复合蔬菜酵素生产过程中,不同时期的产品中各类物质的含量及抗氧化活性变化显著。综上所述,发酵能显著提高复合蔬菜酵素生物活性成分含量及抗氧化活性,后熟过程能使产品更加稳定并进一步提高其抗氧化活性。本文研究结果为酵素后熟过程的研究提供参考,为提高该酵素的市场竞争力提供了一定的理论基础,为消费者了解产品品质提供了参考,促进酵素行业健康发展。
[1] 朱政, 周常义, 曾磊, 等.酵素产品的研究进展及问题探究[J].中国酿造, 2019, 38(3):10-13.
ZHU Z, ZHOU C Y, ZENG L, et al.Research progress and problems exploring of ferment products[J].China Brewing, 2019, 38(3):10-13.
[2] 李豆. 新型水果酵素的研制及生物活性研究[D].沈阳:沈阳农业大学, 2018.
LI D.Study on the development of A new type of fruit enzyme and its biological activity[D].Shenyang:Shenyang Agricultural University, 2018.
[3] SEPTEMBRE-MALATERRE A, REMIZE F, POUCHERET P.Fruits and vegetables, as a source of nutritional compounds and phytochemicals:Changes in bioactive compounds during lactic fermentation[J].Food Research International, 2018, 104:86-99.
[4] 邢慧雅. 响应面法优化藜麦发酵浓浆发酵工艺研究[D].太原:山西大学, 2019.
XING H Y.Optimization of fermentation process of quinoa fermented thick pulp by response surface methodology[D].Taiyuan:Shanxi University, 2019.
[5] MEYDAV S, SAGUY I, KOPELMAN I J.Browning determination in citrus products[J].Journal of Agricultural and Food Chemistry, 1977, 25(3):602-604.
[6] ADOM K K, LIU R H.Antioxidant activity of grains[J].Journal of Agricultural and Food Chemistry, 2002, 50(21):6 182-6 187.
[7] CHU Y F, SUN J, WU X Z, et al.Antioxidant and antiproliferative activities of common vegetables[J].Journal of Agricultural and Food Chemistry, 2002, 50(23):6 910-6 916.
[8] LIU D R, LIN Y, HUANG S S, et al.Study on the extraction and purification of total flavone in etirfel preparation[J].Asian Journal of Chemistry, 2013, 25(3):1 339-1 343.
[9] 甘奕. 乳酸菌的特性研究及发酵山楂液对大鼠脂质代谢的影响[D].重庆:西南大学, 2019.
GAN Y.The characteristics of lactic acid bacteria and the effect of fermented hawthorn juice on the lipid metabolism of rats[D].Chongqing:Southwest University, 2019.
[10] MHATRE B, MARAR T.Vetting and comparative analysis of antioxidants and phytochemicals from methanolic, aqueous and a popular commercial fruit juice (noni) Morinda citrifolia L.[J].Research Journal of Pharmaceutical Biological and Chemical Sciences, 2015, 6(6):884-890.
[11] EREL O.A novel automated direct measurement method for total antioxidant capacity using a new generation, more stable ABTS radical cation[J].Clinical Biochemistry, 2004, 37(4):277-285.
[12] 高庆超. 黑果枸杞酵素发酵过程中微生物及物质变化规律的研究[D].西宁:青海大学, 2020.
GAO Q C.Study on change law of microorganisms and metabolites during fermentation process of Lycium ruthenicum Murr.Jiaosu[D].Xining:Qinghai University, 2020.
[13] 高子飞. 樱桃中几种多酚类物质清除自由基机理研究[D].烟台:烟台大学, 2019.
GAO Z F.Study on free radical scavenging mechanism of several polyphenols from cherry[D].Yantai:Yantai University, 2019.
[14] MARANGON M, VINCENZI S, LUCCHETTA M, et al.Heating and reduction affect the reaction with tannins of wine protein fractions differing in hydrophobicity[J].Analytica Chimica Acta, 2010, 660(1-2):110-118.
[15] 徐萌萌. 益生菌发酵胡萝卜饮料营养特性及其储藏稳定性研究[D].南昌:南昌大学, 2016.
XU M M.The study on nutritional properties and storage stability of carrot beverage fermented by probiotics[D].Nanchang:Nanchang University, 2016.
[16] KAYATH C A, IBALA ZAMBA A, MOKÉMIABEKA S N, et al.Synergic involvements of microorganisms in the biomedical increase of polyphenols and flavonoids during the fermentation of ginger juice[J].International Journal of Microbiology, 2020, 2020:8417693.
[17] HUYNH N T, VAN CAMP J, SMAGGHE G, et al.Improved release and metabolism of flavonoids by steered fermentation processes:A review[J].International Journal of Molecular Sciences, 2014, 15(11):19 369-19 388.
[18] OTHMAN N B, ROBLAIN D, CHAMMEN N, et al.Antioxidant phenolic compounds loss during the fermentation of Chétoui olives[J].Food Chemistry, 2009, 116(3):662-669.
[19] GHOSH K, RAY M, ADAK A, et al.Role of probiotic Lactobacillus fermentum KKL1 in the preparation of a rice based fermented beverage[J].Bioresource Technology, 2015, 188:161-168.
[20] DI CAGNO R, CODA R, DE ANGELIS M, et al.Exploitation of vegetables and fruits through lactic acid fermentation[J].Food Microbiology, 2013, 33(1):1-10.
[21] YU Y S, XIAO G S, XU Y J, et al.Slight fermentation with Lactobacillus fermentium improves the taste (sugar:acid ratio) of citrus (Citrus reticulata cv.chachiensis) juice[J].Journal of Food Science, 2015, 80(11):M2543-M2547.
[22] KHAN S A, LIU L, LAI T, et al.Phenolic profile, free amino acids composition and antioxidant potential of dried longan fermented by lactic acid bacteria[J].Journal of Food Science and Technology, 2018, 55(12):4 782-4 791.
[23] ZHU Y C, LUO Y H, WANG P P, et al.Simultaneous determination of free amino acids in Pu-erh tea and their changes during fermentation[J].Food Chemistry, 2016, 194:643-649.