淀粉及其衍生物中被应用于包合领域的主要为环糊精、分支糖原和直链淀粉/糊精[1-5]。环糊精产品主要有α、β和γ-环糊精,能够对多种化合物进行助溶性包合[1]。工业制造和应用最多的为β-环糊精,其助溶效果受限于其较低的溶解度[2]。此外,环糊精的助溶功能主要体现在助溶后的药物保护和缓释方面,该特性使得其不适用于包合溶解度低又需要被快速降解的环境污染性物质。同样,分支糖原虽然得益于其较高的分支度从而具有较好的水溶性,但是功能性体现在缓释和递送方面[3-4],并且它的生产需要多酶复配[6],操作较为复杂。直链淀粉/糊精则是通过形成复合物的形式实现不饱和脂肪酸等的胃肠道递送和缓释功能[5]。以上3种常见淀粉衍生物不适用于难溶化合物助溶降解,需要一种既能助溶,又不阻碍难溶化合物生物降解的功能性多糖。
中聚合度(10~100)[7]的异麦芽/麦芽多糖(megalo isomalto/malto-polysaccharides,M-IMMPs)是由来自Limosilactobacillus reuteri 121的4,6-α-葡萄糖基转移酶GtfB-ΔN合成的新型水溶性多糖[8],对难溶性的环境污染物质具有新颖的助溶效果[9]。M-IMMPs能够在不阻碍环境污染物的生物降解前提下,提高其溶解度,促进其生物降解。偶氮染料是一种被应用于食品包装、塑料餐具染色的合成有机染料[10],是潜在的致癌物质,其核心结构为连接有芳香基团或杂环的显色偶氮基团[11]。由于偶氮染料溶解度低,生物降解度低,使得其在自然界中积累,进一步增加了其危害[12-13]。现阶段研究主要采用环糊精对偶氮染料进行包合而提高其溶解度[14],但是该情况下发色基团进入环糊精空腔的空间位阻抑制了偶氮还原酶对偶氮染料的降解[9]。因此,使用M-IMMPs提高偶氮类染料溶解度具有良好的现实意义。但现有M-IMMPs的制备底物为麦芽六糖和麦芽七糖混合物,成本高昂且产物聚合度在11~12[15],其助溶效果远低于环糊精[9]。
针对该问题,本研究以偶氮染料中的典型代表乙基红作为助溶实验对象,采用4,6-α-葡萄糖基转移酶GtfB-ΔN转化直链糊精合成了较高聚合度的M-IMMPs,并通过添加受体底物合成了一系列具有梯度分子质量的M-IMMPs,测定比对了其对乙基红的助溶特性,并对乙基红- M-IMMPs复合物进行了系列表征,以期为后续M-IMMPs实际应用奠定理论基础。
1 材料方法
1.1 主要材料和仪器
L.reuteri 121,实验室保藏菌种;直链糊精(Mw=2.1 kDa),实验室自制;胰蛋白胨、酵母提取物、麦芽糖、氨苄青霉素、异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactopyranoside,IPTG)、右旋糖酐-20,上海生工生物有限公司;乙基红、二甲基亚砜-d6(dimethyl sulfoxide-d6, DMSO-d6)、D2O,上海阿拉丁生化科技有限公司。
DAWN HELEOS 8+高效凝胶渗透色谱仪,美国Waters公司;Advance Ⅲ 400 MHz全数字化核磁共振波谱仪,美国Brucker公司;NEXUS傅里叶红外光谱仪,美国尼高力仪器公司;SU8100冷场发射扫描电子显微镜,日本株式会社日立高新技术;Spectra Max 190酶标仪,美国Molecular Devices公司;Starter 5000pH计,美国Ohaus公司;ZQZY-80BS恒温摇床,上海知楚仪器有限公司;MTH-100恒温混匀仪,杭州米欧仪器有限公司;Centrifuge 5424R离心机,德国Eppendorf公司。
1.2 GtfB-ΔN分离及纯化
参考BAI等[16]酶的表达、纯化方法,并稍作修改。L.reuteri 121菌种接种至含有0.15 g/L氨苄的LB培养基中,37 ℃摇床培养10 h,吸取一定量培养液(体积分数为1%)至含有0.15 g/L氨苄的LB培养基中中进行扩大培养,扩大培养基OD600在0.4~0.6时,冰浴15 min后加入1 mmol/L IPTG诱导产酶,18 ℃摇床培养24 h。培养液于8 000 r/min、4 ℃下离心15 min 收取沉淀部分并破碎。破碎后在12 000 r/min、4 ℃下离心15 min,上清液经Ni+亲和色谱柱纯化得到酶液。酶活力测定参照BAI等[16]建立的碘显色法。
1.3 不同分子质量M-IMMPs的酶法制备
直链糊精(25 g/L)加入醋酸钠缓冲液(25 mmol/L,pH 5.0,含1 mmol/L CaCl2)后沸水浴30 min,后在高压灭菌锅(121 ℃,15 min)中完全糊化[17]。冷却至37 ℃后加入一定量的麦芽糖(0~2 000 mg/g)和GtfB-ΔN(0.6 mg/g),反应48 h后沸水浴15 min,8 000 r/min、4 ℃下离心15 min收集上清液干燥。
1.4 相对分子质量测定
样品(5 g/L)溶解于超纯水后沸水浴15 min,用0.45 μm针头式滤膜过滤。测试条件:UltrahydrogelTM柱(7.8 mm×300 mm),流动相100 mmol/L的 NaNO3溶液,流速0.5 mL /min。葡萄糖、右旋糖酐T-5(2 700 Da)、右旋糖酐T-10(9 750 Da)、右旋糖酐T-150(135 350 Da)和右旋糖酐T-300(300 600 Da)为标样,高效凝胶渗透色谱仪(high performance gel permeation chromatograph, HPGPC)测定分子质量,数据均使用Empower 3处理。
1.5 乙基红溶解度测定
过量乙基红和M-IMMPs(0、10、30、50、100、150 g/L)/β-环糊精(0、2、6、10、15 mmol/L)/右旋糖酐-20(0、10、30、50、100、150 g/L)加入到水中,28 ℃下振荡12 h。4 ℃、12 000 r/min下离心15 min,取上清液进行全波长扫描(320~600 nm),以450 nm处读数计算相对溶解度[18]。
1.6 核磁共振波谱
样品(20 g/L)于D2O中沸水浴1 h,冻干,以上操作重复2次完成置换后再次溶解,60 ℃下保温。4.98、5.37 ppm处的峰分别对应α1→6、α1→4键。M-IMMPs(0、10、30、50、100、150 g/L)与乙基红(1 g/L)溶于体积分数为70%、100% DMSO-d6溶液中,60 ℃下保温[9]。乙基红- M-IMMPs复合物中乙基红质子的化学位移(δ复)与乙基红的质子的化学位移(δ0)作差计算复合物形成前后乙基红质子的化学位移变化(Δδ)。
核磁共振波谱仪测定一维氢谱,谱宽为8 000 Hz,数据均使用MestReNova 12.0.3处理。
1.7 扫描电子显微镜
所有样品喷涂金层,并采用3.0 kV分析。
1.8 傅里叶红外光谱
所有样品从600~4 000 cm-1进行扫描,数据均使用OMNIC 9.2处理。
2 结果与分析
2.1 不同分子质量的M-IMMPs的合成
GtfB-ΔN已经被证实偏好作用于直链底物[19],其酶学机制如图1所示。GtfB-ΔN作用于麦芽七糖时,产物中聚合度在10以上的部分含量很低[20],当其作用于直链淀粉时,产物分子质量高达106 Da,因此中分子质量的直链糊精是制备M-IMMPs的合适底物。GtfB-ΔN的最小作用底物是麦芽三糖,当麦芽七糖作为反应底物时,其最多只能提供5个葡萄糖基被用于转糖基作用。麦芽糖既不会被GtfB-ΔN水解,也不能作为转糖基反应的供体底物,只能作为受体底物[21-22]。因此,当向直链糊精中添加麦芽糖后,整个反应体系中可被用作供体的葡萄糖基数目不变,但是受体底物增多,这导致了M-IMMPs的α1→6链长度降低。因此,本研究采用GtfB-ΔN作用于直链糊精,并添加不同量麦芽糖,此时供体底物含量不变,受体底物增多,导致产物分子质量下降,以此合成不同分子质量的M-IMMPs。

图1 GtfB-ΔN的酶学机制
Fig.1 The enzymatic mechanism of GtfB-ΔN
通过添加不同量的麦芽糖,合成了Mw在3.6~12.5 kDa的M-IMMPs,产物分子质量较直链糊精底物明显上升。由图2和表1可知,随着麦芽糖添加量的不断上升,产物前峰Mw和α1→6键含量不断降低。当麦芽糖添加量在0~160 mg/g时,产物分子质量对添加量较为敏感。当添加量达到160 mg/g时,产物的Mw降低至5.8 kDa;当添加量从160 mg/g上升到656 mg/g时,产物的Mw降低至3.6 kDa。当麦芽糖添加量达到896 mg/g后,前后峰已经无法分开,总产物中Mw为1.1 kDa,该产物已经不能被定义为M-IMMPs。
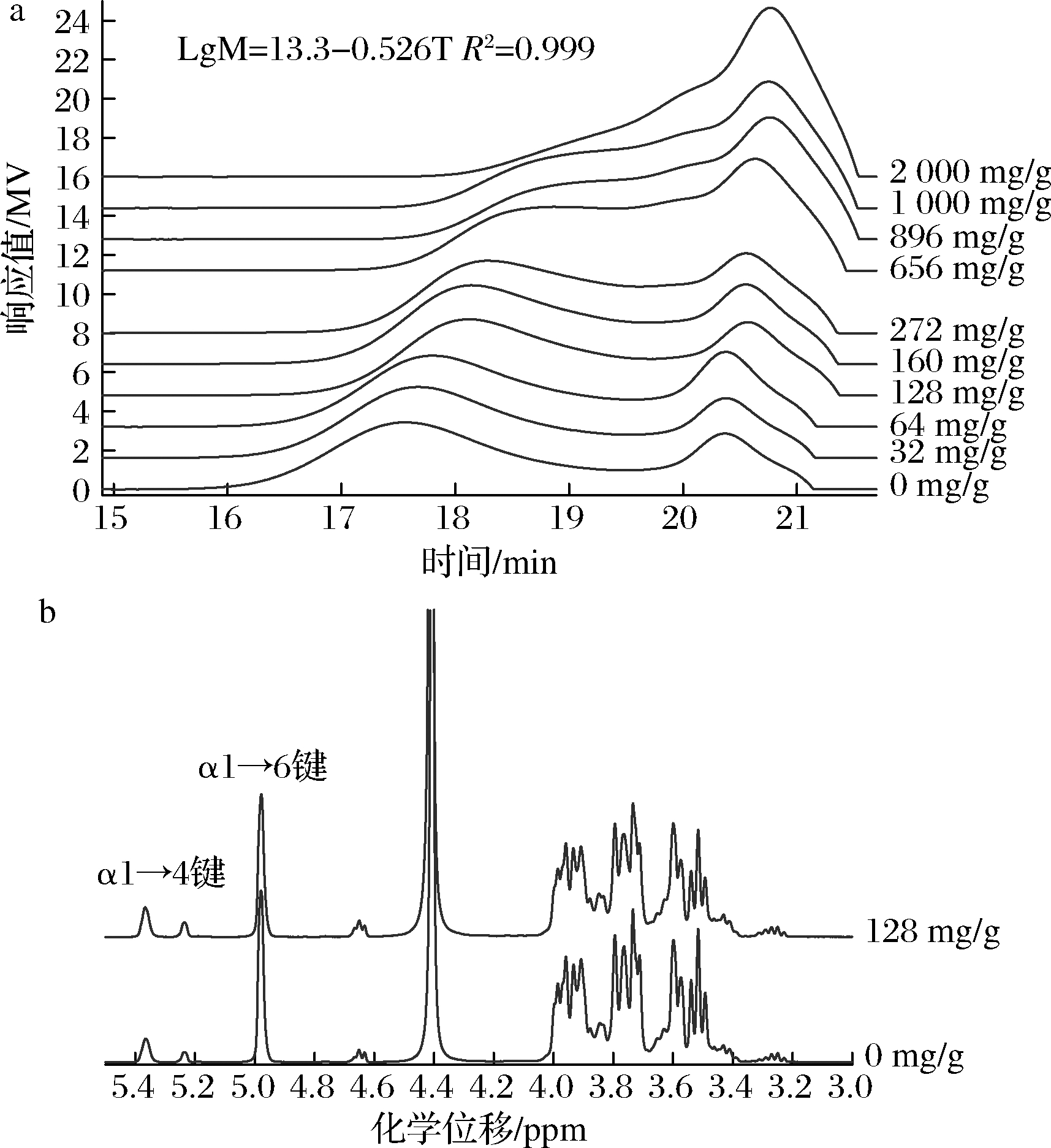
a-HPGFC-RID图谱;b-核磁共振图谱
图2 不同麦芽糖添加量下GtfB-ΔN与直链糊精反应产物的HPGFC-RID和核磁共振图谱
Fig.2 The HPGFC-RID and 1H NMR spectra of reaction products of GtfB-ΔN with linear dextrins under different maltose addition
表1 不同麦芽糖添加量下GtfB-ΔN与直链糊精反应产物的Mw和α1→6键含量
Table 1 Mw and α1→6 linkage content of reaction products of GtfB-ΔN with linear dextrins under different maltose addition
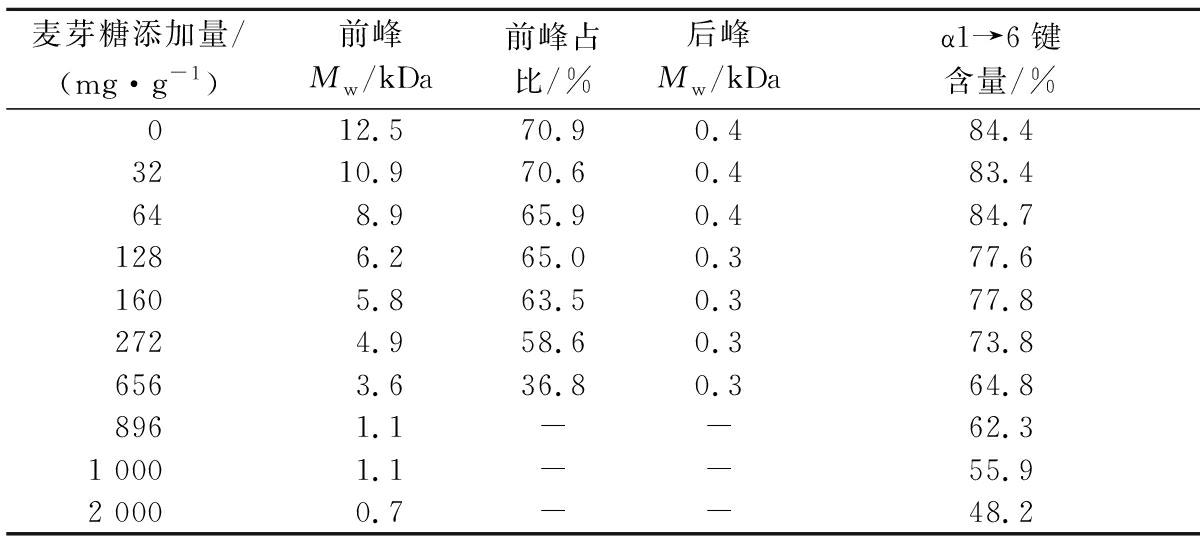
麦芽糖添加量/(mg·g-1)前峰Mw/kDa前峰占比/%后峰Mw/kDaα1→6键含量/% 012.570.90.484.43210.970.60.483.4648.965.90.484.71286.265.00.377.61605.863.50.377.82724.958.60.373.86563.636.80.364.88961.1--62.31 0001.1--55.92 0000.7--48.2
从中选择分子质量差异较大的2种M-IMMPs(12.5和5.8 kDa)用于后续助溶实验。
2.2 M-IMMPs助溶效果测定
乙基红在450 nm波长处存在最大吸收,以此处吸光度计算相对溶解度[18]。由图3-e可得,β-环糊精、12.5 kDa M-IMMPs、5.8 kDa M-IMMPs溶液中乙基红相对溶解度分别可高达3.18、4.50和1.30。在质量浓度低于17 g/L时,高分子质量M-IMMPs(12.5 kDa)的助溶效果与β-环糊精相近。β-环糊精溶解度较低(16 mmol/L)[23],而高α1→6键含量使得M-IMMPs具有良好的水溶性,这使得M-IMMPs助溶上限更高。该助溶效果呈现出分子质量依赖性,高分子质量M-IMMPs(12.5 kDa)的效果显著优于低分子质量M-IMMPs(5.8 kDa),分子质量是影响助溶效果的重要因素。值得注意的是,加入传统的α1→6键含量高于90%的右旋糖酐-20(约20 kDa)[24],乙基红相对溶解度反而降低至0.10(图3-e)。这表明,M-IMMPs的助溶效果并非简单来源于高α1→6键含量和分子质量,其特异性结构决定了助溶效果。
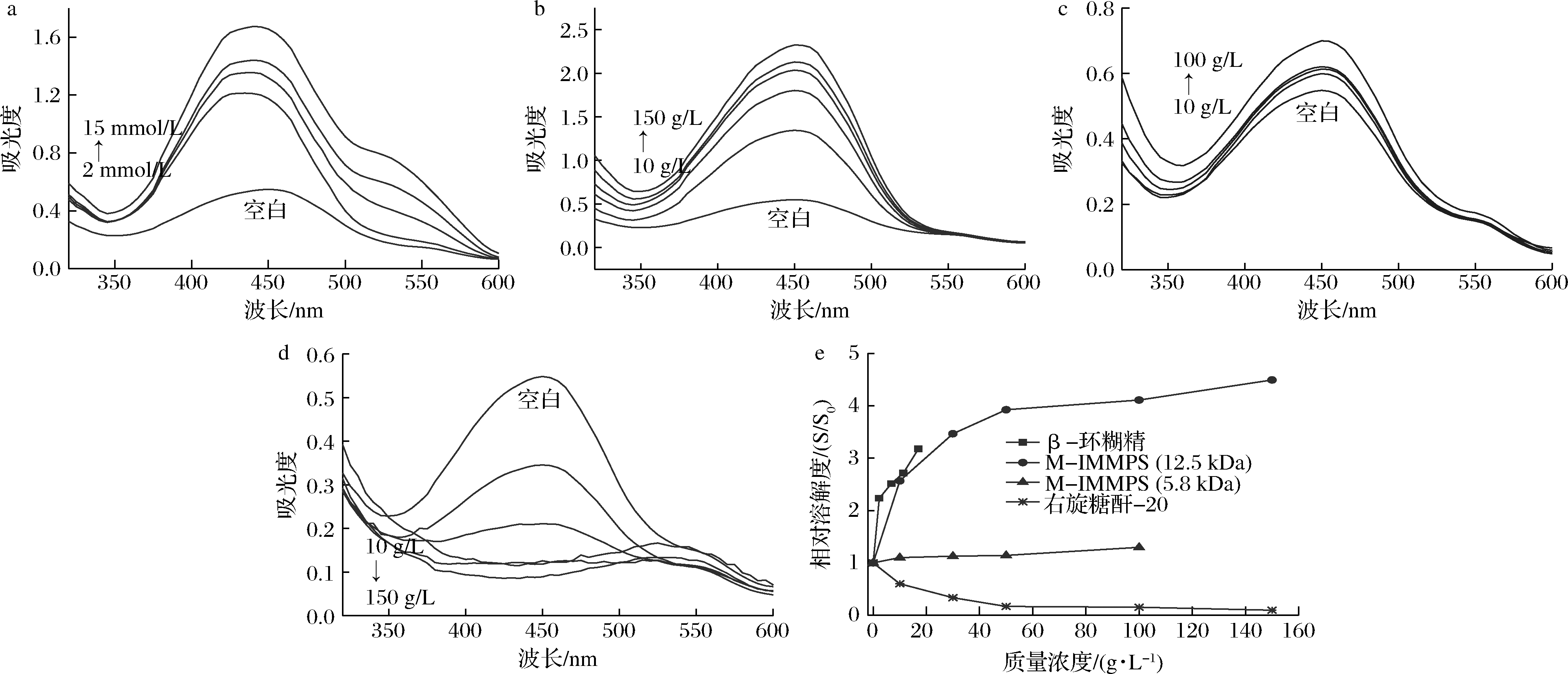
a-β-环糊精(2、6、10、15 mmol/L);b-M-IMMPs(12.5 kDa,10、30、50、100、150 g/L);c-M-IMMPs(5.8 kDa,10、30、50、100 g/L)d-右旋糖酐-20(20 kDa,10、30、50、100、150 g/L);e-相对溶解度
图3 乙基红在不同溶液中吸收光谱和相对溶解度
Fig.3 Absorption spectra and relative solubility of ethyl red in different solutions
当复合物中乙基红和M-IMMPs的浓度增加时,只有光谱强度变化,这表明复合物中的乙基红并未发生基本形式的变化。虽然M-IMMPs没有类似环糊精的空腔,但位于葡萄糖链两侧的羟基和甲基使得其可能具有两亲性[25]。α1→6键和α1→4键的共同存在有利于构建两亲表面,从而能够与通过疏水相互作用与各种非极性化合物形成复合物,但是右旋糖酐-20不能,这或许是由于其主要包含α1→6键和α1→3键所致。由此推测,M-IMMPs可以通过疏水相互作用提高乙基红溶解度。此外,M-IMMPs可以通过提高溶解度的方式促进肠道吸收槲皮素糖苷[26],助溶效果的非特异性提供了其来自非特异性疏水相互作用的支撑与可能。
2.3 乙基红- M-IMMPs复合物表征
2.3.1 核磁共振波谱
据上文推测,M-IMMPs的助溶作用是通过疏水相互作用实现的。为验证该推论,采用体积分数分别为70%、100%的DMSO-d6作为核磁共振一维氢谱分析的溶剂。当疏水相互作用起主要作用时,向溶液中添加有机溶剂会降低溶剂整体的极性,减小溶剂和宿主之间的疏水性差异,即疏水相互作用减弱[27]。且乙基红的亲油性决定了该浓度和溶解体系中乙基红溶解度较高,核磁信号较强。由图4-a和表2可得,70% DMSO-d6溶解体系中乙基红质子的化学位移变化高于100% DMSO-d6溶解体系中的。这表明,非特异性的疏水相互作用贡献了M-IMMPs对乙基红的助溶作用。

a-乙基红和乙基红-M-IMMPs复合物于70%、100% DMSO-d6;b-乙基红-M-IMMPs复合物于70% DMSO-d6
图4 乙基红结构式和不同溶液中乙基红、乙基红-M-IMMPs复合物的核磁共振图谱
Fig.4 Structural form, 1H NMR spectra of ethyl red and ethyl red-M-IMMPs complexes in different solutions
表2 游离乙基红和乙基红- M-IMMPs复合物中乙基红质子的化学位移及变化
Table 2 Chemical shifts and their change for the protons of ethyl red in the ethyl red and ethyl red-M-IMMPs complexes
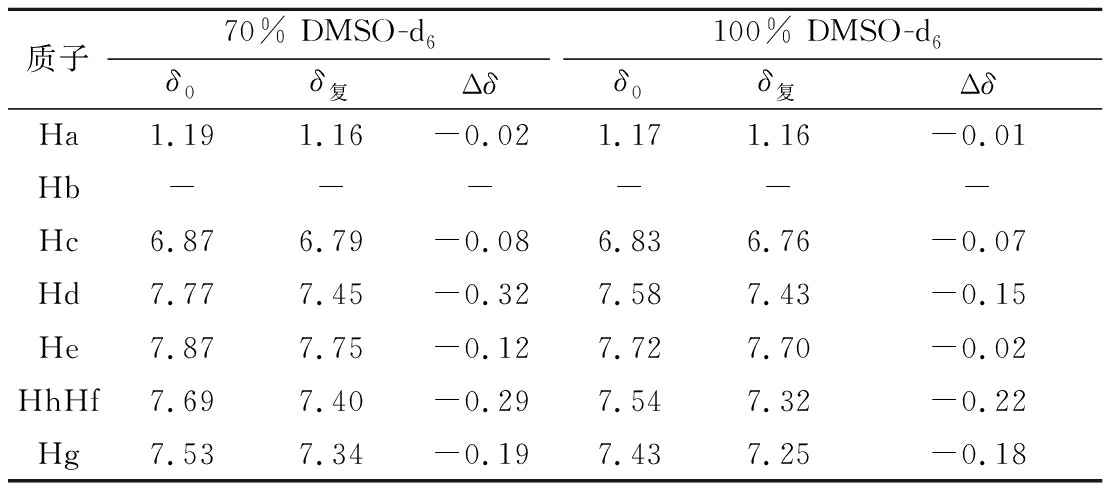
质子70% DMSO-d6100% DMSO-d6δ0δ复Δδδ0δ复ΔδHa1.191.16-0.021.171.16-0.01Hb------Hc6.876.79-0.086.836.76-0.07Hd7.777.45-0.327.587.43-0.15He7.877.75-0.127.727.70-0.02HhHf7.697.40-0.297.547.32-0.22Hg7.537.34-0.197.437.25-0.18
由图4-b和表3可得,乙基红质子的化学位移变化随着M-IMMPs浓度的提高而提高,到达一定浓度后不再发生变化。这表明在特定体系下,M-IMMPs和乙基红达到某一质量比后,疏水相互作用饱和,即使继续添加M-IMMPs,乙基红也不会受到影响。
表3 乙基红- M-IMMPs复合物中乙基红质子化学位移(70%DMSO-d6)变化
Table 3 Chemical shifts change (70%DMSO-d6) for the protons of ethyl red in the ethyl red-M-IMMPs complexes
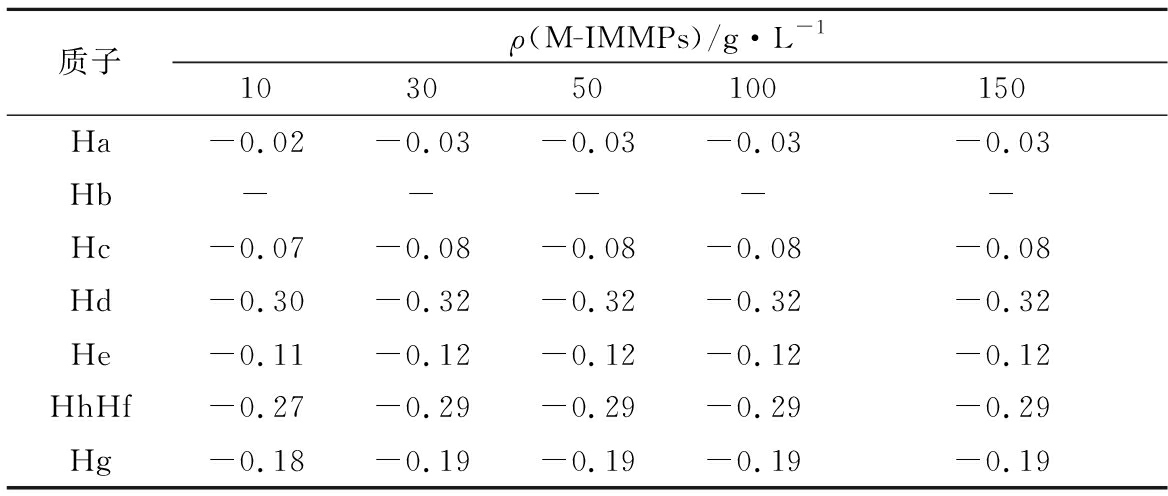
质子ρ(M-IMMPs)/g·L-1103050100150Ha-0.02-0.03-0.03-0.03-0.03Hb-----Hc-0.07-0.08-0.08-0.08-0.08Hd-0.30-0.32-0.32-0.32-0.32He-0.11-0.12-0.12-0.12-0.12HhHf-0.27-0.29-0.29-0.29-0.29Hg-0.18-0.19-0.19-0.19-0.19
2.3.2 扫描电子显微镜
由图5可得,乙基红呈现出大小不一的菱状结构(图5-a),M-IMMPs呈现为不规则片块状结构(图5-b)。2种物质的物理混合呈现出简单的叠加状态(图5-c),即菱状结构和不规则片块状结构同时存在,而乙基红-M-IMMPs复合物呈现为无定形糊状(图5-e和图5-f),菱状不规则片块状结构完全消失,与物理混合态存在明显差异,这证实了复合物的形成。此外,在高浓度M-IMMPs(图5-d)助溶体系下,由于乙基红在复合物中占比较低,复合物的颗粒形态、大小较原M-IMMPs未发生较大变化,但仍然呈现成糊趋势,片块状M-IMMPs开始发生连结。

a-乙基红;b-M-IMMPs;c-物理混合; d-乙基红-M-IMMPs(15%)复合物;e-乙基红-M-IMMPs(10 g/L)复合物(×500);f-乙基红-M-IMMPs(10 g/L)复合物(×2 000)
图5 乙基红、M-IMMPs、物理混合和乙基红-M-IMMPs复合物的扫描电镜图
Fig.5 SEM images of ethyl red, M-IMMs, physical mixture, and ethyl red-M-IMMPs complexes
2.3.3 傅里叶红外光谱分析
红外光谱常用于分析化合物的特征官能团。由图6可得,乙基红的红外光谱在1 707、1 591 cm-1处分别显示出—C![]() O和—C
O和—C![]() N—的特征峰[9]。物理混合显示出乙基红和M-IMMPs图谱的简单叠加状态。复合物400~1 300 cm-1的区域与M-IMMPs的几乎完全相同,—C
N—的特征峰[9]。物理混合显示出乙基红和M-IMMPs图谱的简单叠加状态。复合物400~1 300 cm-1的区域与M-IMMPs的几乎完全相同,—C![]() N—特征峰从1 591 cm-1右移至1 558 cm-1,—OH特征峰从3 311 cm-1右移至3 264 cm-1,这表明除了疏水相互作用外,复合物的形成过程中或许还存在氢键[28],M-IMMPs的助溶效果由疏水相互作用和氢键相互作用共同实现。该结果证实了复合物的形成。
N—特征峰从1 591 cm-1右移至1 558 cm-1,—OH特征峰从3 311 cm-1右移至3 264 cm-1,这表明除了疏水相互作用外,复合物的形成过程中或许还存在氢键[28],M-IMMPs的助溶效果由疏水相互作用和氢键相互作用共同实现。该结果证实了复合物的形成。
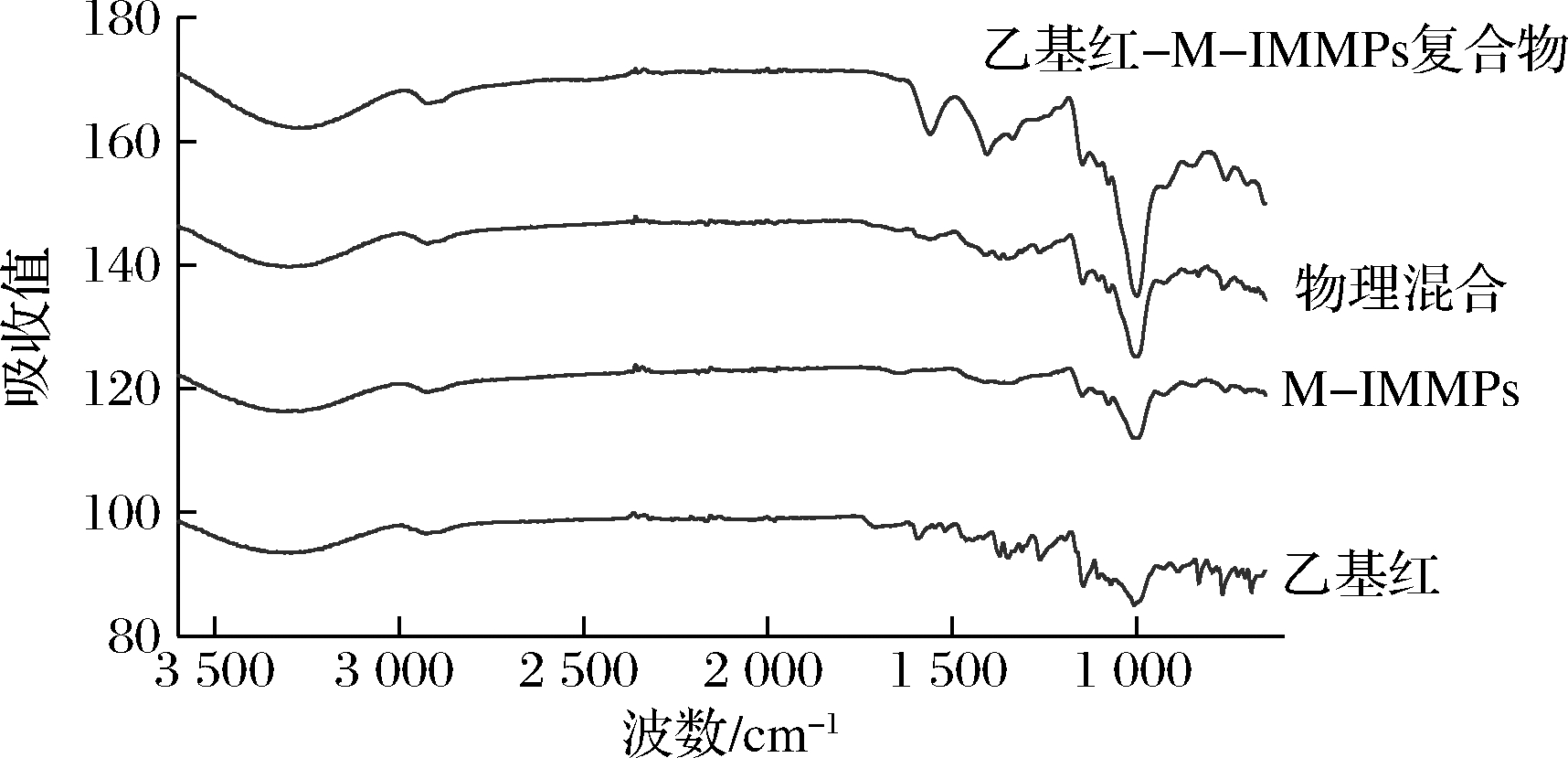
图6 乙基红、M-IMMPs、物理混合、乙基红- M-IMMPs(10 g/L)复合物的傅里叶红外光谱图
Fig.6 FTIR spectra of ethyl red, M-IMMPs, physical mixture, and ethyl red-M-IMMPs (10 g/L) complex
3 结论
采用控制直链糊精和麦芽糖受体比例的方式合成了一系列具有梯度分子质量的M-IMMPs,测定表征了其乙基红的助溶效果和所形成的复合物。对于M-IMMPs,分子质量越高,其助溶效果越好,且该助溶效果来自M-IMMPs的独特结构,并非只来自于高α1→6键含量和分子质量。M-IMMPs通过疏水相互作用实现助溶功能,同时,氢键可能也贡献了助溶效果。随着乙基红-M-IMMPs复合物的形成,颗粒形态逐渐向无定形糊状片层转化。由于疏水相互作用的非特异性,M-IMMPs对其他偶氮染料具有助溶潜力,有助于难溶性食品包装染料的生物降解。
[1] 柏玉香, 吴浩.γ-环糊精工业化生产的研究进展[J].食品与发酵工业, 2021, 47(22):279-287.
BAI Y X, WU H.Research progress in industrial production of γ-cyclodextrin[J].Food and Fermentation Industries, 2021, 47(22):279-287.
[2] 任敏, 孙希阳, 贺丰洋, 等.β-环糊精包合物的研究进展[J].山东化工, 2020, 49(18):77-78.
REN M, SUN X Y, HE F Y, et al.Research progress of β-cyclodextrin inclusion complex[J].Shandong Chemical Industry, 2020, 49(18):77-78.
[3] TAKEDA S, NISHIMURA T, UMEZAKI K, et al.Synthesis and function of amphiphilic glucan dendrimers as nanocarriers for protein delivery[J].Biomaterials Science, 2019, 7(4):1 617-1 622.
[4] SHI Y N, YE F, LU K Y, et al.Characterizations and bioavailability of dendrimer-like glucan nanoparticulate system containing resveratrol[J].Journal of Agricultural and Food Chemistry, 2020, 68(23):6 420-6 429.
[5] OBIRO W C, SINHA RAY S, EMMAMBUX M N.V-amylose structural characteristics, methods of preparation, significance, and potential applications[J].Food Reviews International, 2012, 28(4):412-438.
[6] LIU J L, BAI Y X, JI H Y, et al.Controlling the fine structure of glycogen-like glucan by rational enzymatic synthesis[J].Journal of Agricultural and Food Chemistry, 2021, 69(49):14 951-14 960.
[7] JOE G H, ANDOH M, SHINOKI A, et al.Megalo-type α-1, 6-glucosaccharides induce production of tumor necrosis factor α in primary macrophages via toll-like receptor 4 signaling[J].Biomedical Research, 2016, 37(3):179-186.
[8] LEEMHUIS H, DIJKMAN W P, DOBRUCHOWSKA J M, et al.4, 6-α-Glucanotransferase activity occurs more widespread in Lactobacillus strains and constitutes a separate GH70 subfamily[J].Applied Microbiology and Biotechnology, 2013, 97(1):181-193.
[9] LANG W, KUMAGAI Y, SADAHIRO J, et al.Different molecular complexity of linear-isomaltomegalosaccharides and β-cyclodextrin on enhancing solubility of azo dye ethyl red:Towards dye biodegradation[J].Bioresource Technology, 2014, 169:518-524.
[10] 陈萌萌. 芳香胺异构体的同时定量分析研究[D].杭州:杭州师范大学, 2018.
CHEN M M.Simultaneous quantitative analysis of aromatic amine isomers[D].Hangzhou:Hangzhou Normal University, 2018.
[11] RUFCHAHI E O M, GILANI A G, TAGHVAEI V, et al.Synthesis, structural elucidation, solvatochromism and spectroscopic properties of some azo dyes derived from 6-chloro-4-hydroxyquinoline-2(1H)-one[J].Journal of Molecular Structure, 2016, 1108:623-630.
[12] JI Q Y, LIU G F, ZHOU J T, et al.Removal of water-insoluble Sudan dyes by Shewanella oneidensis MR-1[J].Bioresource Technology, 2012, 114:144-148.
[13] GEORGIOU D, METALLINOU C, AIVASIDIS A, et al.Decolorization of azo-reactive dyes and cotton-textile wastewater using anaerobic digestion and acetate-consuming bacteria[J].Biochemical Engineering Journal, 2004, 19(1):75-79.
[14] ZHAO L D, SUN Q M, PU H Y, et al.Experimental and computer simulation investigations of ethyl red with modified β-cyclodextrins:Inclusion mechanism and structure characterization[J].Chemical Physics Letters, 2020, 754:137725.
[15] HARA H, KUME S, IIZUKA T, et al.Enzymatically synthesized megalo-type isomaltosaccharides enhance the barrier function of the tight junction in the intestinal epithelium[J].Bioscience, Biotechnology, and Biochemistry, 2018, 82(4):629-635.
[16] BAI Y X, VAN DER KAAIJ R M, LEEMHUIS H, et al.Biochemical characterization of the Lactobacillus reuteri glycoside hydrolase family 70 GTFB type of 4, 6-α-glucanotransferase enzymes that synthesize soluble dietary starch fibers[J].Applied and Environmental Microbiology, 2015, 81(20):7 223-7 232.
[17] GU F J, BOREWICZ K, RICHTER B, et al.In vitro fermentation behavior of isomalto/malto-polysaccharides using human fecal inoculum indicates prebiotic potential[J].Molecular Nutrition & Food Research, 2018, 62(12):1800232.
[18] LANG W, SIRISANSANEEYAKUL S, NGIWSARA L, et al.Characterization of a new oxygen-insensitive azoreductase from Brevibacillus laterosporus TISTR1911:Toward dye decolorization using a packed-bed metal affinity reactor[J].Bioresource Technology, 2013, 150:298-306.
[19] VAN DER ZAAL P H, SCHOLS H A, BITTER J H, et al.Isomalto/malto-polysaccharide structure in relation to the structural properties of starch substrates[J].Carbohydrate Polymers, 2018, 185:179-186.
[20] DOBRUCHOWSKA J M, GERWIG G J, KRALJ S, et al.Structural characterization of linear isomalto-/ malto-oligomer products synthesized by the novel GTFB 4, 6-α-glucanotransferase enzyme from Lactobacillus reuteri 121[J].Glycobiology, 2011, 22(4):517-528.
[21] XUE N X, SVENSSON B, BAI Y X.Structure, function and enzymatic synthesis of glucosaccharides assembled mainly by α1 → 6 linkages: A review[J].Carbohydrate Polymers, 2022, 275:118705.
[22] VAN DER ZAAL P H, KLOSTERMANN C E, SCHOLS H A, et al.Enzymatic fingerprinting of isomalto/malto-polysaccharides[J].Carbohydrate Polymers, 2019, 205:279-286.
[23] NASONGKLA N, WIEDMANN A F, BRUENING A, et al.Enhancement of solubility and bioavailability of β-lapachone using cyclodextrin inclusion complexes[J].Pharmaceutical Research, 2003, 20(10):1 626-1 633.
[24] CHEN F, HUANG G L, HUANG H L.Preparation and application of dextran and its derivatives as carriers[J].International Journal of Biological Macromolecules, 2020, 145:827-834.
[25] SUNDARI C S, RAMAN B, BALASUBRAMANIAN D.Hydrophobic surfaces in oligosaccharides:Linear dextrims are amphiphilic chains[J].Biochimica et Biophysica Acta (BBA) - Biomembranes, 1991, 1065(1):35-41.
[26] SHINOKI A, LANG W, THAWORNKUNO C, et al.A novel mechanism for the promotion of quercetin glycoside absorption by megalo α-1, 6-glucosaccharide in the rat small intestine[J].Food Chemistry, 2013, 136(2):293-296.
[27] GAFNI A, COHEN Y.Complexes of macrocycles with γ-cyclodextrin as deduced from NMR diffusion measurements[J].The Journal of Organic Chemistry, 1997, 62(1):120-125.
[28] LIU K, ZHA X Q, SHEN W D, et al.The hydrogel of whey protein isolate coated by lotus root amylopectin enhance the stability and bioavailability of quercetin[J].Carbohydrate Polymers, 2020, 236:116009.