食盐是肉类加工中最重要的添加剂之一,对肉制品有增加保存时间、提高风味,增加柔软度、持水力、及多汁性等方面的作用[1-2];还能提供人体必须的Na+。但随着社会的发展,人们食入越来越多的加工食品,因此体内钠钾比在增加[3]。如在欧洲、北美和澳大利亚,约70%的食盐来自加工食品,其中20%来自肉类产品[4]。高盐摄入被公认为全球两大高饮食风险之一,过量摄入钠盐可能造成高血压、增加心血管疾病的发病率,还与一些肿瘤的发生密切相关[5]。食物中减盐的方法包括寻找一些替代物,如钾盐、钙盐、镁盐[6];加入一些增味剂,如谷氨酸钠或酵母提取物[5];或采用一些新的技术,如超高压技术[7-8]。现在研究较多的主要是使用KCl部分替代NaCl,因KCl与NaCl性质相似,并在浓度较高时具有抗微生物等作用。关于KCl部分替代NaCl后对肉制品质量的影响,很多学者都开展了研究,如对肉制品感官、质构、水分活度、pH、脂肪氧化、离子含量、色泽、盐渗透动力学、微生物、挥发性物质等方面的影响[9-11]。
脂肪氧化一方面对肉制品风味形成至关重要,很多特征风味物质都源于不饱和脂肪酸的氧化;另一方面,若氧化过度,会对产品品质造成负面影响,某些挥发性成分的浓度超过一定阈值时会产生异味,且脂肪氧化形成的大量游离基对人的健康不利[12]。关于肉制品中食盐对脂肪氧化的影响有很多研究,大都认为食盐在一定范围内会促进脂肪氧化,超过一定浓度则会抑制脂肪氧化,如RHEE等[13]发现2.5%的食盐有最大促氧化效果;MIN等[1]报道NaCl在2%左右促氧化作用最强,此后,随浓度增加,促氧化作用逐渐减小甚至被抑制。关于KCl部分替代NaCl后对脂肪氧化的影响也有一些报道,这些报道的结果并不一致,有的认为可以降低脂肪氧化[14-15],有的认为可以促进氧化[9,16],还有的认为对脂肪氧化影响不大[17],这些差异可能与加工条件、食盐浓度、原料不同等有关。
KCl部分替代NaCl后必定对脂肪氧化产生影响,而脂肪氧化对肉制品质量至关重要,但目前这方面还缺乏系统、深入研究。为降低肉品中食盐含量和进一步寻找替代品奠定更好的理论依据,有必要对KCl部分替代NaCl后脂肪氧化的动力学变化进行研究,但目前尚没有相关报道。根据一些文献,KCl替代量超过40%~50%后会显著降低肉制品质量[18-19],因此本文拟研究在1%~5%食盐质量分数内,40%的NaCl被KCl取代后,猪肉肌内脂肪氧化的动力学变化规律,包括初级氧化与次级氧化。
1 材料与方法
1.1 材料与试剂
猪背最长肌,购于当地超市,于冷藏条件下运回实验室,去掉表面可见脂肪、筋膜和结缔组织,真空包装后于-18 ℃保藏待用。
NaCl、KCl,均为食品级;三氯乙酸、乙二胺四乙酸二钠、硫代巴比妥酸、1,1,3,3-四乙氧基丙烷、冰乙酸、三氯甲烷、KI、Na2S2O3、石油醚、Na2SO4,均为分析纯。
1.2 仪器与设备
FSH-2A匀浆机,上海梅香仪器有限公司;BSC-259恒温恒湿箱,上海博迅实业有限公司;U-3900H分光光度计,日本Hitachi公司;JYS-A800绞肉机,山东九阳电器有限公司;RE-52AA旋转蒸发仪,上海亚荣生化仪器厂。
1.3 实验方法
1.3.1 样品处理
样品于4 ℃解冻24 h,绞碎并混匀,然后随机平分为11组,每组约1 200 g,NaCl处理组分别加入质量分数1%、2%、3%、4%和5%的NaCl(以原料肉质量计)并拌匀,KCl部分替代组分别加入1%、2%、3%、4%和5%的混合盐(KCl占40%,NaCl占60%),对照组不加盐。然后各组平均分成60份,每份20 g左右,分别用铝箔袋包装,不封口。每组的60份平均分成4组,分别于15、20、25、30 ℃恒温箱中保温,每个温度条件下分别于5个时间点取样,每次取样3份,作为3个重复,具体每个处理的5个时间点根据预备试验确定,温度高的处理时间相对较短,反之时间较长,以使每个时间点都能观察到明显的脂肪氧化,即过氧化值(peroxide value,POV)和硫代巴比妥酸反应产物(thiobarbituric acid reactive substances, TBARS)值的明显上升,以利于计算脂肪氧化速率常数,如15 ℃的保温时间分别为0、20、40、60、80 h,而30 ℃的保温时间分别为0、5、10、15、20 h。处理结束后,马上分析各样品的POV和TBARS值。
1.3.2 脂肪氧化测定
脂肪氧化程度用POV和TBARS值来衡量,其中POV表示脂肪初级氧化,其测定根据GB 5009.227—2016的滴定法;TBARS值表示脂肪次级氧化,其测定根据GB 5009.181—2016的分光光度法。
1.3.3 脂肪氧化动力学研究
根据预备试验和文献显示[20],在一定温度下,脂肪氧化动力学变化规律可以用一级反应动力学方程(1)进行描述。
ln(A/A0)=kt
(1)
式中:A、A0分别为处理时间为t和0时的POV或TBARS值;t,保温时间,h;k,脂肪氧化速率常数,h-1。
因此,利用SPSS的线性回归程序,可从脂肪氧化值(POV或TBARS)的自然对数In(A/A0)与时间t的一次回归直线斜率得到某一特定盐含量、温度条件下的脂肪氧化速率常数k。
Arrhenius方程(2)经常用来评价温度对反应速率常数k的影响,因此在本试验中也用来评定温度对脂肪氧化速率常数的影响,具体影响程度用反应活化Ea(kJ/mol)来衡量。
(2)
式中:R,通用气体常数,8.314 J/(mol·K);T,温度,K;k0,指前因子。
同样,利用SPSS的线性回归程序,在不同盐含量或组成条件下,以lnk为因变量,-1/RT为自变量作线性回归分析,所得斜率即为不同盐含量和组成条件下的Ea。
1.4 数据统计分析
实验重复测定3 次,采用SPSS软件对数据进行处理,结果表示为平均值±标准差。
2 结果与分析
2.1 脂肪氧化速率常数
2.1.1 脂肪初级氧化速率常数
根据方程(1),在某一特定处理温度、盐含量和组成条件下,测得不同时间点样品的POV后,作ln(A/A0)对时间t的线性回归,得到各处理样品初级脂肪氧化速率常数。图1为不添加盐的对照样在不同处理温度条件下POV随时间的变化,可以看出,各温度条件下都能用一级反应动力学方程进行拟合,各回归方程均极显著(P<0.01)。在食品加工或贮藏中,大多与质量有关的品质变化都遵循零级或一级反应动力学规律[20],特别是一级动力学是目前评价肉制品品质变化动力学特性的最常用模型[21]。关于脂肪氧化速率常数,学者们也进行了研究,王强[20]用一级动力学模型拟合了香肠贮藏过程中的脂肪氧化,靳国锋[12]用零级模型对五花肉的脂肪氧化速率常数进行了拟合。本实验在预备试验中,也同时用2种模型进行了拟合,虽然零级模型也能较好地拟合,但总体效果不及一级动力学模型,可能是脂肪氧化启动相对较慢,而本研究选取的时间点都比较靠前,以确保脂肪氧化呈上升趋势;也可能是由于脂肪氧化是介于零级与一级反应之间的一种混合模型。其他处理条件下脂肪初级氧化速率常数也可用同样的方法求得,如表1所示。

图1 未添加食盐条件下温度对猪肉POV的影响
Fig.1 Effect of temperature on POV in pork without NaCl
注:图中点为实测POV,实线为根据方程1拟合的回归方程
表1 不同含量及组成的盐对脂肪氧化(以POV衡量)速率常数和活化能的影响单位:10-3h-1
Table 1 Estimated reaction rate constant and activation energy for lipid oxidation measured by POV with different content and component of salt
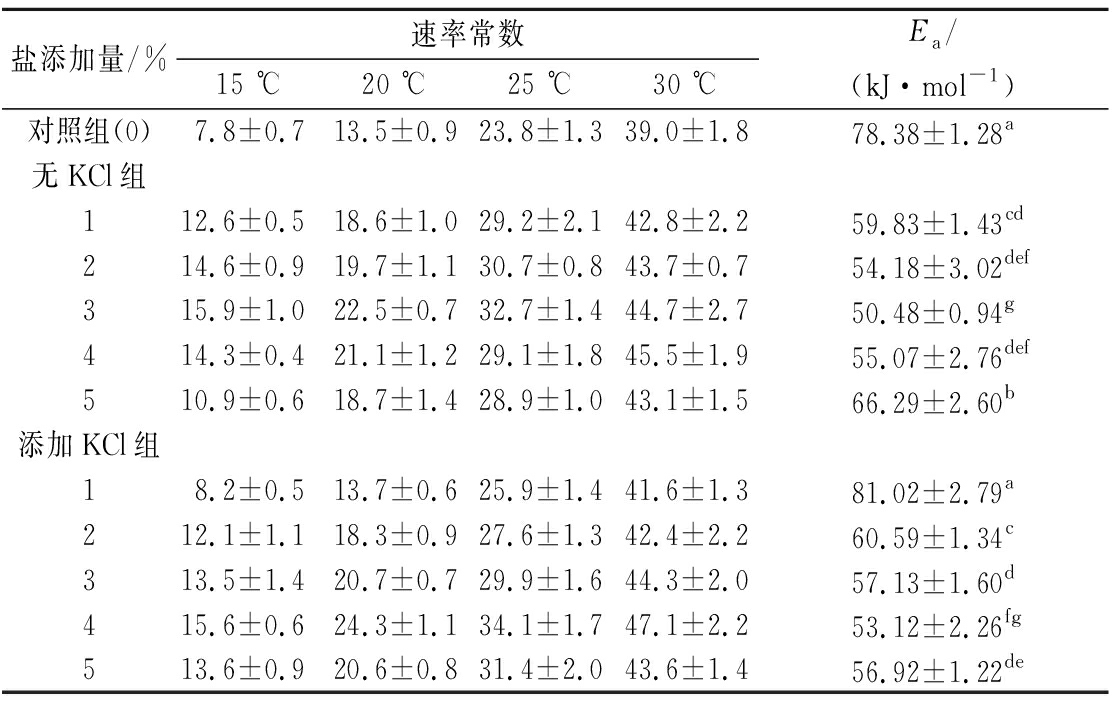
盐添加量/%速率常数15 ℃20 ℃25 ℃30 ℃Ea/(kJ·mol-1)对照组(0)7.8±0.713.5±0.923.8±1.339.0±1.878.38±1.28a无KCl组112.6±0.518.6±1.029.2±2.142.8±2.259.83±1.43cd214.6±0.919.7±1.130.7±0.843.7±0.754.18±3.02def315.9±1.022.5±0.732.7±1.444.7±2.750.48±0.94g414.3±0.421.1±1.229.1±1.845.5±1.955.07±2.76def510.9±0.618.7±1.428.9±1.043.1±1.566.29±2.60b添加KCl组18.2±0.513.7±0.625.9±1.441.6±1.381.02±2.79a212.1±1.118.3±0.927.6±1.342.4±2.260.59±1.34c313.5±1.420.7±0.729.9±1.644.3±2.057.13±1.60d415.6±0.624.3±1.134.1±1.747.1±2.253.12±2.26fg513.6±0.920.6±0.831.4±2.043.6±1.456.92±1.22de
注:不同小写字母表示活化能间显著差异(P<0.05)(下同)
从表1可以看出,不添加KCl且盐浓度不变时,脂肪氧化速率常数随温度的增加而增加,表明温度的提高可以增加脂肪氧化,这与很多研究的结论是一致的[12,20-21]。在固定温度条件下,脂肪氧化速率常数随盐含量的增加先增加后减少,其中在15、20、25 ℃时在食盐质量分数3%时达最大值,30 ℃时则在食盐质量分数4%时达最高点。这说明食盐浓度较低时,盐浓度的增加会促进猪肉初级脂肪氧化,但当食盐超过一定含量时,又会降低脂肪的氧化。这与张东等[22]和MIN等[1]的研究结果是一致的。研究发现NaCl含量对肉中脂肪氧化具有二次效应,脂肪氧化值先随食盐浓度增加而增加,达到最大值后逐渐减小,5%食盐可促进肉中脂肪氧化,RHEE等[13]的研究中2.5%食盐脂肪氧化达最高程度,而靳国锋[12]的研究中为3.1%左右。当40%的KCl替代NaCl后,脂肪氧化速率常数总体上与未替代组相当,变化规律也相似,但盐质量分数1%~3%时,替代组的脂肪氧化速率常数不同程度低于100%NaCl组,而4%或5%质量分数时高于100%NaCl组,特别是在15~25 ℃这些规律更明显。另外,在各温度下,替代组均是在盐质量分数4%下速率常数达最大值。
2.1.2 脂肪次级氧化速率常数
测得各处理样品不同时间点TBARS值后,运用方程(1)可求得各样品脂肪次级氧化速率常数(表2)。除个别处理外,脂肪次级氧化速率常数均低于相对应的初级氧化速率常数,这可能是由于次级氧化是在初级氧化之后发生,且初级氧化的产物——氢过氧化物只有一部分分解为次级氧化产物,次级氧化产物主要是一些小分子的醛、酮类。次级氧化速率常数变化规律与初级氧化速率常数相似,在相同盐含量条件下随温度的增加而增加;在同一温度下,随盐含量的增加先增加再减小,其中无替代组在食盐质量分数3%时达最大值,而替代组除20 ℃在3%达最大值外,其余温度下均在4%达最大值。另外,1%~3%盐含量条件下,100% NaCl组的脂肪氧化速率常数高于替代组,而在盐质量分数4%~5%条件下相反,这也与初级氧化速率常数的规律一致。
表2 不同含量及组成的盐对脂肪氧化(以TBARS衡量)速率常数和活化能的影响 单位:10-3h-1
Table 2 Estimated reaction rate constant and activation energy for lipid oxidation measured by TBARS value with different content and component of salt
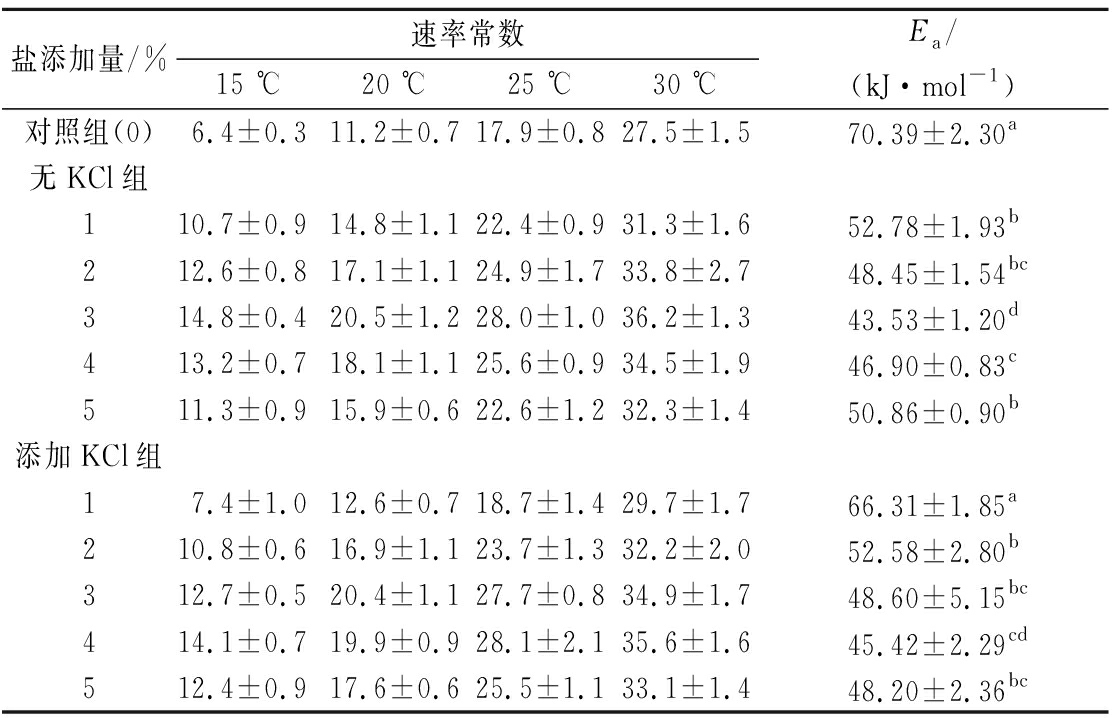
盐添加量/%速率常数15 ℃20 ℃25 ℃30 ℃Ea/(kJ·mol-1)对照组(0)6.4±0.311.2±0.717.9±0.827.5±1.570.39±2.30a无KCl组110.7±0.914.8±1.122.4±0.931.3±1.652.78±1.93b212.6±0.817.1±1.124.9±1.733.8±2.748.45±1.54bc314.8±0.420.5±1.228.0±1.036.2±1.343.53±1.20d413.2±0.718.1±1.125.6±0.934.5±1.946.90±0.83c511.3±0.915.9±0.622.6±1.232.3±1.450.86±0.90b添加KCl组17.4±1.012.6±0.718.7±1.429.7±1.766.31±1.85a210.8±0.616.9±1.123.7±1.332.2±2.052.58±2.80b312.7±0.520.4±1.127.7±0.834.9±1.748.60±5.15bc414.1±0.719.9±0.928.1±2.135.6±1.645.42±2.29cd512.4±0.917.6±0.625.5±1.133.1±1.448.20±2.36bc
2.2 NaCl含量对脂肪氧化速率常数的影响
从表1、表2可以看出,在NaCl含量固定时,脂肪初级和次级氧化的速率常数均随温度的增加而增加,具体增加规律可用Arrhenius方程进行评价。利用SPSS的线性回归程序(方程2)可以求得各食盐含量条件下脂肪初级与次级氧化的活化能,分别如表1和表2所示,利用方程(2)求出的各活化能均显著(P<0.05)。从表1可见,对照组活化能显著高于添加食盐组(P<0.05),达到78.38 kJ/mol,说明在本试验研究范围内,1%~5%的食盐添加量均能促进猪肉中脂肪初级氧化;即使1%的食盐也能明显降低脂肪初级氧化活化能,促进脂肪氧化,这与一些报道的结果是一致的[12,15]。具体来看,随食盐含量的增加,活化能先显著减小,在3%时达最小值,然后显著增加。将活化能随食盐含量的变化用SPSS的曲线回归进行拟合,发现二次模型效果最好,如图2所示,拟合的模型为:Ea=3.389X2-19.188X+77.605(X为盐质量分数),模型决定系数为0.988,根据该模型,可求得当食盐质量分数X=2.83%,活化能有最小值50.45 kJ/mol,因此当NaCl质量分数为2.83%时,脂肪初级氧化需要克服的能量障碍最低,对猪肉脂肪初级氧化有最大促进效果,这与靳国锋[12]研究五花肉时得到的结论基本一致,该研究发现食盐质量分数3.1%有最低活化能54.75 kJ/mol。
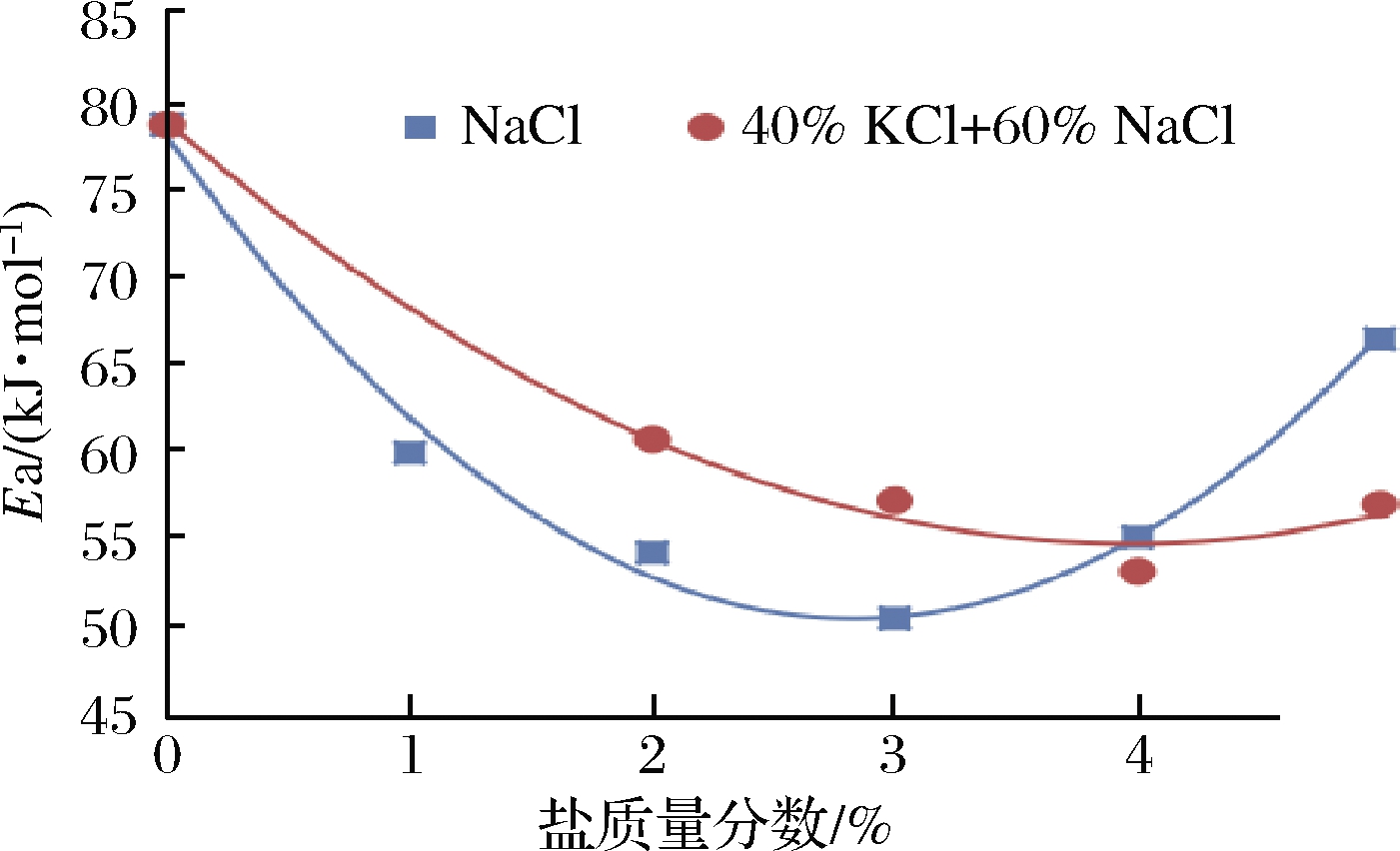
图2 盐含量对猪肉脂肪初级氧化活化能的影响
Fig.2 Effect of salt content on activation energy of lipid primary oxidation in pork
从表2可以看出,在相同的食盐含量条件下,次级氧化的活化能变化规律与初级氧化相似,但活化能值均低于初级氧化,这说明脂肪初级氧化比次级氧化有更高的温度敏感性;也说明次级氧化需要克服的能量障碍低于初级氧化,一旦初级氧化启动后,次级氧化会自然而然的发生。这与靳国锋[12]研究五花肉脂肪氧化的结果是一致的;但与王强[20]研究香肠中脂肪氧化时得到的结果不一致,这可能是试验材料或试验条件的差异所引起的。同样,次级氧化活化能随食盐浓度的变化可用二次模型进行拟合,如图3所示,拟合的模型为Ea=2.476X2-15.814X+68.991,模型的决定系数为0.967,根据该模型,可以求得当食盐质量分数X=3.19%时,活化能有最小值43.74 kJ/mol,得到的食盐浓度值大于初级氧化模型的值,这可能是由于次级氧化的滞后性引起的。
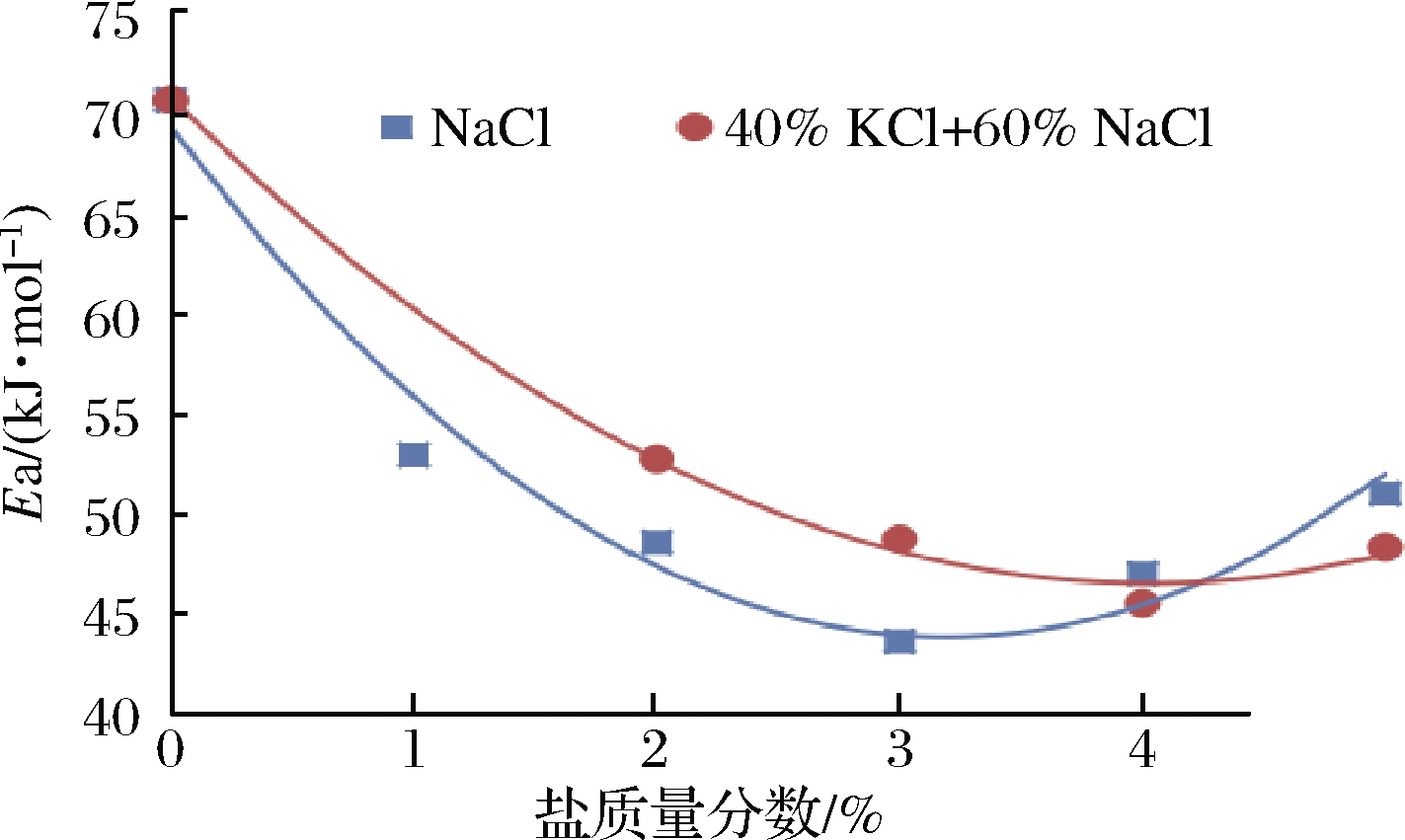
图3 盐含量对猪肉脂肪次级氧化活化能的影响
Fig.3 Effect of salt content on activation energy of lipid secondary oxidation in pork
一些研究者也报道过肉中脂肪氧化的活化能,靳国锋[12]测得无盐条件下,五花肉的一级、二级脂肪氧化活化能分别为92.35、65.66 kJ/mol,1%、3%、5%食盐质量分数下一级氧化活化能分别为68.29、54.75、67.01 kJ/mol,二级氧化活化能分别为50.30、45.82、46.97 kJ/mol,与本研究结果基本一致。王强[20]报道香肠贮藏过程中初级和次级氧化的活化能分别为37.68、51.38 kJ/mol,其中初级氧化的活化能显著低于本研究的结果。
2.3 KCl部分替代NaCl后混合盐含量对脂肪氧化速率常数的影响
当40%的KCl替代NaCl后,可用SPSS的线性回归程序(方程2)求得不同混合盐含量下脂肪初级与次级氧化的活化能。从表1和表2可以看出,各活化能值的整体范围与100% NaCl组相当。从表1可以看出,当混合盐含量为1%时,初级氧化的活化能达81.02 kJ/mol,高于对照组的78.38 kJ/mol,而未替代组中添加1%的NaCl可以显著降低活化能(59.83 kJ/mol),这可能是由于替代组中NaCl的实际浓度只有0.6%,对脂肪氧化的促进效果有限,或在一定的低浓度范围内,NaCl或KCl可能对肉中的一些抗氧化酶有激活作用,从而增加脂肪的氧化稳定性。这与KING等[15]的研究结果有所差异,他发现火鸡加工中1%食盐就有明显的促氧化作用,当25%或50%的KCl取代NaCl时,虽氧化作用减弱,但仍有明显的促氧化,这可能由于火鸡中不饱和脂肪酸含量高,更易氧化所致。当混合盐质量分数在2%以上时,活化能变化规律与未替代组相似,先随盐质量分数的增加显著减少,在4%时达最低值,然后再增加;其中盐质量分数2%或3%时,替代组的活化能值高于对照组,而盐质量分数在4%及以上时相反,说明盐质量分数较低时,部分KCl替代NaCl后脂肪氧化稳定性提高,而盐质量分数超过4%时替代则可能降低脂肪氧化稳定性。同样,用二次曲线对活化能随盐质量分数的变化进行拟合,由于盐质量分数为1%时可能存在酶激活等现象与对照组活化能无显著差异,因此拟合过程中排除了盐含量1%的点,拟合结果如图2所示,拟合模型为:Ea=1.509X2-11.985X+78.491(X为盐质量分数),模型的决定系数为0.990,根据该模型,可求得当盐质量分数X=3.97%,活化能有最小值54.69 kJ/mol,因此当混合盐质量分数为3.97%时,脂肪初级氧化需要克服的能量障碍最低,对猪肉脂肪初级氧化有最大促进效果。前面研究未替代组时,当食盐质量分数为2.83%时对脂肪氧化有最大促进效果,这种差异可能与40%的NaCl被替代有关,此时,肉中总的离子强度降低,总的渗透压也降低;另外,在相同离子浓度条件下,KCl对脂肪氧化的促进效果低于NaCl[23],但其对抗氧化酶特别是谷胱甘肽氧化酶的活性保持高于NaCl[24]。关于KCl部分替代NaCl后对肉中脂肪氧化的影响,很多学者都进行了研究,但结果并不一致,有的认为可以降低脂肪氧化[14-15],有的认为可以促进脂肪氧化[9,16],还有的认为对脂肪氧化影响不大[17]。分析原因,一是他们的研究均是在实际加工中,由于加入了亚硝酸盐等辅料,因此脂肪氧化的影响因素更复杂;另外,根据本文的研究发现与盐的含量有关,在总盐质量分数为1%~3%时,40%的KCl替代NaCl会降低脂肪氧化,而在4%或5%质量分数时,会促进脂肪氧化。食盐促进肉中脂肪氧化可能主要受以下因素影响:(1)食盐能使肉品中的亚铁血红素或其他与血红素结合的分子释放游离Fe3+[12];(2)食盐会影响脂肪酶和脂肪氧化酶的活性,从而也会影响脂肪氧化[25];(3)食盐会影响抗氧化酶的活性[26]。部分KCl替代NaCl后,因K+和Na+在离子强度、促进Fe3+释放、对酶活性影响方面存在一些差异,因此导致在脂肪氧化方面的差异。
从表2可以看出,在相同的混合盐含量条件下,次级氧化的活化能值均低于初级氧化。前面观察到当混合盐质量分数为1%时,初级氧化的活化能值比对照样略有升高,而次级氧化中未观察到升高现象,但仍显著高于100%NaCl组,且与对照组差异较小,因此1%的混合盐对脂肪次级氧化的作用十分有限,未观察到像初级氧化活化能升高的现象,可能是初级氧化更能反映脂肪氧化规律,也可能是抗氧化酶的激活与盐的轻微促氧化作用相互抵消了,还有可能是试验误差引起的。同样,次级氧化活化能随食盐质量分数的变化可用二次模型进行拟合,如将混合盐质量分数1%的数据也包括在内,拟合程度较差,决定系数为0.947,排除1%数据后,拟合情况如图3,拟合的模型为Ea=1.478X2-11.927X+70.467,模型的决定系数为0.996,根据该模型,可求得当盐质量分数X=4.03%时,活化能有最小值46.41 kJ/mol,盐质量分数与初级氧化模型得到的3.97%基本一致。
根据建立的初级氧化活化能回归模型和图2,可以计算出当盐质量分数>3.9%时,KCl替代组的脂肪初级氧化活化能低于100%NaCl组;根据建立的次级氧化活化能回归模型和图3,可以计算出当盐质量分数>4.2%时,KCl替代组的脂肪次级氧化活化能低于100%NaCl组。因此,可以推测猪肉加工中当总盐质量分数在4%以下时,相对于100%食盐组,40%KCl替代组会提高肉的脂肪氧化稳定性,而当盐质量分数高于4%时则相反。
3 结论
在1%~5%盐质量分数(以原料肉质量计)和15~30 ℃条件下,猪肉脂肪初级氧化速率常数大于次级氧化;1%~3%盐质量分数时,替代组(即40%NaCl被KCl替代)脂肪氧化速率常数不同程度低于100%食盐组,而4%或5%质量分数时则相反;当盐的组成和质量分数不变时,脂肪氧化速率常数随温度而增加;当温度不变时,其随盐质量分数先增加再减小,100%食盐组大都在3%盐质量分数时达最大值,而替代组大都在4%盐质量分数时达最大值。
初级氧化的活化能大于次级氧化;100%NaCl组脂肪氧化活化能随盐含量的变化遵循二次曲线,先随盐浓度的增加而降低,然后增加,脂肪初级氧化、次级氧化分别在食盐质量分数2.83%、3.19%时有最低活化能值。
40%NaCl被KCl替代后,当盐质量分数为1%时,对脂肪初级氧化有一定的抑制作用;除去1%盐质量分数外,脂肪氧化活化能随盐含量的变化也遵循二次曲线,脂肪初级、次级氧化分别在盐质量分数3.97%和4.03%时有最低活化能值。
肉制品加工中当40%的NaCl被KCl取代后,当总盐质量分数在4%以下时,相对于100%食盐组,肉的脂肪氧化稳定性提高,而当盐质量分数超过此值时,会降低脂肪氧化稳定性。
[1] MIN B, AHN D U.Mechanism of lipid peroxidation in meat and meat products:A review[J].Food Science and Biotechnology, 2005, 14(1):152-163.
[2] 马晓丽, 黄雅萍, 张龙涛, 等.肉制品加工中的低钠策略研究[J].食品与发酵工业, 2019, 45(14):256-262.
MA X L, HUANG Y P, ZHANG L T, et al.Strategies for sodium reduction in meat products:A review[J].Food and Fermentation Industries, 2019, 45(14):256-262.
[3] MES AS M, HOLGADO F, M
AS M, HOLGADO F, M RQUEZ-RUIZ G, et al.Effect of sodium replacement in cookies on the formation of process contaminants and lipid oxidation[J].LWT - Food Science and Technology, 2015, 62(1):633-639.
RQUEZ-RUIZ G, et al.Effect of sodium replacement in cookies on the formation of process contaminants and lipid oxidation[J].LWT - Food Science and Technology, 2015, 62(1):633-639.
[4] RUUSUNEN M, PUOLANNE E.Reducing sodium intake from meat products[J].Meat Science, 2005, 70(3):531-541.
[5] INGUGLIA E S, ZHANG Z H, TIWARI B K, et al.Salt reduction strategies in processed meat products:A review[J].Trends in Food Science & Technology, 2017, 59:70-78.
[6] JIN S K, HWANG J W, HUR S J, et al.Quality changes in fat-reduced sausages by partial replacing sodium chloride with other chloride salts during five weeks of refrigeration[J].LWT, 2018, 97:818-824.
[7] O’NEILL C M, CRUZ-ROMERO M C, DUFFY G, et al.The application of response surface methodology for the development of sensory accepted low-salt cooked ham using high pressure processing and a mix of organic acids[J].Innovative Food Science and Emerging Technologies, 2018, 45:401-411.
[8] RODRIGUES F M, ROSENTHAL A, TIBURSKI J H, et al.Alternatives to reduce sodium in processed foods and the potential of high pressure technology[J].Food Science and Technology, 2015, 36(1):1-8.
[9] ZANARDI E, GHIDINI S, CONTER M, et al.Mineral composition of Italian salami and effect of NaCl partial replacement on compositional, physico-chemical and sensory parameters[J].Meat Science, 2010, 86(3):742-747.
[10] LORENZO J M, BERM DEZ R, DOM
DEZ R, DOM NGUEZ R, et al.Physicochemical and microbial changes during the manufacturing process of dry-cured lacón salted with potassium, calcium and magnesium chloride as a partial replacement for sodium chloride[J].Food Control, 2015, 50:763-769.
NGUEZ R, et al.Physicochemical and microbial changes during the manufacturing process of dry-cured lacón salted with potassium, calcium and magnesium chloride as a partial replacement for sodium chloride[J].Food Control, 2015, 50:763-769.
[11] DOS SANTOS B A, CAMPAGNOL P C B, FAGUNDES M B, et al.Generation of volatile compounds in Brazilian low-sodium dry fermented sausages containing blends of NaCl, KCl, and CaCl2 during processing and storage[J].Food Research International, 2015, 74:306-314.
[12] 靳国锋. 干腌培根加工过程中脂质氧化调控机制研究[D].南京:南京农业大学, 2011.
JIN G F.Studies on the regulation mechanism of lipid oxidation during dry-cured bacon processing[D].Nanjing:Nanjing Agricultural University, 2011.
[13] RHEE K S, ZIPRIN Y A.Pro-oxidative effects of NaCl in microbial growth-controlled and uncontrolled beef and chicken[J].Meat Science, 2001, 57(1):105-112.
[14] 张维悦, 夏杨毅, 侯佰慧, 等.KCl部分替代NaCl对腊肉脂肪氧化和脂肪酸变化的影响[J].食品与发酵工业, 2018, 44(9):156-162.
ZHANG W Y, XIA Y Y, HOU B H, et al.Influence of partial replacement of NaCl with KCl on lipid oxidation and fatty acid composition of cured meat[J].Food and Fermentation Industries, 2018, 44(9):156-162.
[15] KING A J, EARL L A.Effect of selected sodium and potassium salts on TBA values of dark meat Turkey patties[J].Journal of Food Science, 1988, 53(3):723-726.
[16] RIPOLLÉS S, CAMPAGNOL P C B, ARMENTEROS M, et al.Influence of partial replacement of NaCl with KCl, CaCl2 and MgCl2 on lipolysis and lipid oxidation in dry-cured ham[J].Meat Science, 2011, 89(1):58-64.
[17] 甘潇, 李洪军, 王兆明, 等.KCl部分替代NaCl对腊肉蛋白质氧化、降解及质构的影响[J].食品与发酵工业, 2019, 45(4):167-173.
GAN X, LI H J, WANG Z M, et al.Effect of partial replacement of NaCl by KCl on protein oxidation, proteolysis and texture of bacon[J].Food and Fermentation Industries, 2019, 45(4):167-173.
[18] WU H Z, ZHANG Y Y, LONG M, et al.Proteolysis and sensory properties of dry-cured bacon as affected by the partial substitution of sodium chloride with potassium chloride[J].Meat Science, 2014, 96(3):1 325-1 331.
[19] PARK J N, HWANG K T, KIM S B, et al.Partial replacement of NaCl by KCl in salted mackerel (Scomber japonicus) fillet products:Effect on sensory acceptance and lipid oxidation[J].International Journal of Food Science and Technology, 2009, 44(8):1 572-1 578.
[20] 王强. 香肠脂肪氧化动力学特性及温度对其影响研究[J].食品科学, 2013, 34(11):130-133.
WANG Q.Kinetic characteristics of lipid oxidation in sausages as affected by temperature[J].Food Science, 2013, 34(11):130-133.
[21] OILLIC S, LEMOINE E, GROS J B, et al.Kinetic analysis of cooking losses from beef and other animal muscles heated in a water bath:Effect of sample dimensions and prior freezing and ageing[J].Meat Science, 2011, 88(3):338-346.
[22] 张东, 李洪军, 王鑫月, 等.食盐添加量对腊肉品质的影响[J].食品与发酵工业, 2017, 43(11):159-164;171.
ZHANG D, LI H J, WANG X Y, et al.Effect of different amounts of salt on the quality of Chinese bacon[J].Food and Fermentation Industries, 2017, 43(11):159-164;171.
[23] RHEE K S, SMITH G C, TERRELL R N.Effect of reduction and replacement of sodium chloride on rancidity development in raw and cooked ground pork[J].Journal of Food Protection, 1983, 46(7):578-581.
[24] HERN NDEZ P, PARK D, RHEE K S.Chloride salt type/ionic strength, muscle site and refrigeration effects on antioxidant enzymes and lipid oxidation in pork[J].Meat Science, 2002, 61(4):405-410.
NDEZ P, PARK D, RHEE K S.Chloride salt type/ionic strength, muscle site and refrigeration effects on antioxidant enzymes and lipid oxidation in pork[J].Meat Science, 2002, 61(4):405-410.
[25] ZHANG Y W, ZHANG L, HUI T, et al.Influence of partial replacement of NaCl by KCl, L-histidine and L-lysine on the lipase activity and lipid oxidation in dry-cured loin process[J].LWT-Food Science and Technology, 2015, 64(2):966-973.
[26] GHEISARI H R, MOTAMEDI H.Chloride salt type/ionic strength and refrigeration effects on antioxidant enzymes and lipid oxidation in cattle, camel and chicken meat[J].Meat Science, 2010, 86(2):377-383.