近年来,成熟度高、口感好的“即食”鲜果成为水果行业新宠[1]。“即食”意味着消费者购买后可立即食用,新鲜度高、口感好,在一定时间内保持可食窗口期。猕猴桃是一种高营养密度的水果,深受全世界消费者的青睐。“红阳”猕猴桃为中国自主选育的中华系红肉品种,具有可食糖度高(20%左右),风味浓郁的特点[2]。猕猴桃为典型的呼吸跃变型果实,具有后熟生理特性。果实采摘后无法立即食用,直接降低消费者体验感、回购率。因此,“即食”猕猴桃鲜果制备工艺的研发极具实际意义。
乙烯和1-MCP是果蔬采后处理中重要的生理调节剂,在猕猴桃、香蕉等水果的采后生理调节领域得到广泛使用[3]。乙烯具有促进果实成熟的作用,并促进果实产生更佳的风味[4]。GÜNTHER等[5]用100 μL/L乙烯催熟1.5 ℃贮藏2个月的“Hort16A”猕猴桃。结果表明,相对于对照组,乙烯处理组果实具有明显的“果糖味”,原因是苯甲酸甲酯、丁酸甲酯、丁酸乙酯和己酸甲酯等酯类成分的含量更高。1-MCP作为一种乙烯受体阻断剂[6],可抑制猕猴桃、苹果等呼吸跃变型水果采后内源性乙烯的生成及乙醇代谢,上调抗坏血酸合成通路关键酶基因AdGME1、AdGME2的表达,从而延缓果实品质的劣变[7]。
猕猴桃供应链体系中,鲜果采收后一部分直接流通,而更大比例为入库贮藏、出库后进入流通。因此本研究以经气调、低温贮藏45、60 d的红阳猕猴桃果实为研究对象,探讨“即食”猕猴桃制备工艺。首先使用1-MCP对不同成熟度的果实进行处理,以可溶性固形物(soluble solids content,SSC)为判断标准,探究1-MCP作用阈值;随后,为提高催熟效率,考察高含量乙烯对低温气调贮藏45 d果实的催熟效果;最后考察不同含量1-MCP对可食窗口期果实的保鲜效果。由此得到一套系统的 “即食”红阳猕猴桃制备工艺,为“即食”猕猴桃的制备、贮运提供理论支持。
1 材料与方法
1.1 材料与试剂
“红阳”猕猴桃(Actinidia chinensis)于2020年8月12日采摘自水城县宏兴绿色农业投资有限公司种植基地(104.95°E,26.38°N),选择80~100 g表面完好的果实当天运回贵阳学院(贵州省农产品产地初加工关键技术研发与应用科技创新基地),果实SSC(7.2±0.68)%,干物质含量(20.2±1.26)%(n=18)。
乙烯气体(纯度为99.99%),大连大特气体有限公司;1-MCP(有效体积分数为0.33%),美国罗门哈斯公司;DP432植物总RNA提取试剂盒,天根生化科技(北京)有限公司;Prime ScriptTM RT reagent Kit with gDNA Eraser(Perfect Real Time)试剂盒,TaKaRa宝日医生物技术(北京)有限公司;Luna® Universal qPCR Master Mix试剂盒,美国New England Biolabs公司。
1.2 仪器与设备
TA.XT.Plus质构仪,英国SMS公司;GC-14气相色谱仪,日本Shimazhu公司;PEG-20M(交联)毛细管柱(15 m×0.25 mm×0.4 μm),大连中汇达科学仪器有限公司;PAL-1迷你数显折射计,日本ATAGO公司;PHS-3c数显酸度计,上海仪电科学仪器股份有限公司;Check PointⅡ便携式残氧仪,丹麦Dansensor公司;YS3060光栅分光测色仪,深圳市三恩时科技有限公司;LYQT-400果蔬气调实验箱,天津利源捷能气调保鲜设备有限公司;CFX ConnectTM荧光定量PCR检测系统,美国Bio-Rad公司。
1.3 实验方法
1.3.1 实验方案
果实经室温愈伤24 h后分为两部分:(1)1-MCP阈值试验。挑选1 566个猕猴桃果实[SSC(7.2±0.68)%,果肉硬度(57±4.89)N]均分于开一圆孔(φ=20 mm)塑料箱中,置于(25±2)℃空气流通房间。15箱果实分别放置0、3、6、9、12 d后使用0.5 μL/L的1-MCP密闭处理24 h[(25±2)℃],标记为F0、F3、F6、F9和F12(n=3)。另3箱果实于(25±2) ℃环境放置24 h,为对照(CK)组。所有果实在处理结束后转入(25±2) ℃的通风环境中,在1、3、6、9、12 d进行指标检测,处理结束当天定为1 d。(2)低温、气调贮藏。按胡花丽等[8]的方法操作。根据实验设计,果实经气调贮藏45 d及60 d后出库,分别用于乙烯催熟实验和1-MCP保鲜试验。
“即食”工艺实验由乙烯催熟、1-MCP保鲜两部分组成:(1)乙烯催熟。果实经气调贮藏45 d后出库[SSC(11.58±1.01)%,果肉硬度(51.41±5.35)N(n=18)],25 ℃静置24 h后进行乙烯催熟处理。每个安装橡胶塞的密封箱(60 L,55 cm×40 cm×31.5 cm,φ=20 mm)内装入120个完好果实,每箱猕猴桃质量相近(±5 g)。将乙烯气体通过注射器经橡胶塞注入箱内并立即密封。CK组及处理组箱内乙烯气体体积分数分别为0、100、250、500、1 000 μL/L(分别命名为CK、E1、E2、E3、E4),(25±2) ℃催熟24 h。然后于(25±2) ℃摆放1、3、5、7、9 d进行相关指标测定。催熟处理当天定为0 d,结束当天定为1 d;(2)1-MCP保鲜。选择气调贮藏60 d的果实[SSC(12.03±1.06)%,果肉硬度(49.86±4.36)N],25 ℃通风静置24 h后用进行“即食”处理,即经250 μL/L乙烯催熟24 h后[(25±2) ℃]均分为CK、M1(0.25 μL/L 1-MCP)、M2(0.5 μL/L 1-MCP)3个处理(360个/处理)。然后在1 m3的密封塑料帐内经1-MCP处理24 h[(25±2) ℃]。处理结束后,果实进行(4±0.5) ℃货架14 d、(25±2) ℃货架7 d实验。
1.3.2 硬度测定
果肉、果心硬度测定参照BURDON等[9]的方法并修改,分别使用P/2和P/4探头测定前、中、后速度为5 mm/s,触发力5 g,穿刺深度为2 mm(n=18)。
1.3.3 SSC、淀粉、色差、可滴定酸、固酸比、抗坏血酸、叶酸和腐烂率测定
SSC使用数显折射计进行测定(n=18)。淀粉含量使用碘-淀粉比色法测定(n=3)[10]。将猕猴桃果实赤道部位相隔180°位置去厚度为1 mm,1 cm2的果皮,分别测定两点的L*、a*和b*值(n=18),参照WANG等[11]的方法计算猕猴桃果肉的色相角(h°)。可滴定酸(titratable acid,TA)、抗坏血酸(ascorbic acid,ASA)及叶酸含量测定参照文献[12](n=3)。固酸比为SSC与TA的比值。腐烂率参照文献[13]的方法测定(n=18)。
1.3.4 呼吸强度和乙烯生成速率测定
每组挑选27个果实,均分为3组,固定用于呼吸强度、乙烯生成速率测定。参照KOU等[14]的方法测定。
1.3.5 总RNA提取及cDNA合成方法
保存于-80 ℃的样品在研钵中与液氮混合后迅速研磨成粉末。然后使用植物RNA提取试剂盒提取猕猴桃果肉总RNA,以OD260/OD280值检验RNA纯度,通过1.5 %的琼脂糖凝胶电泳检测总RNA完整性。使用Prime ScriptTM RT reagent Kit with gDNA Eraser (Perfect Real Time)试剂盒,参照说明书将RNA逆转录为cDNA。
1.3.6 实时荧光定量PCR分析
18 s1、AcACO1和AcACO2基因引物序列参考文献[15-16],AcACS1及AcAMY3基因引物序列通过检索NCBI数据库获得引物信息,利用在线网站http://primer3.ut.ee/软件设计引物,交由生工生物工程股份有限公司合成(表1)。采用SYBR Green荧光染料法进行相对荧光定量PCR反应,反应体系为20 μL:Luna® Universal qPCR Master Mix 10 μL、cDNA模板5 μL、Nuclease-free Water 4 μL、上下游引物各1 μL。操作步骤参照Luna® Universal qPCR Master Mix试剂盒说明书进行,q-PCR采用BIO-RAD CFX ConnectTM荧光定量PCR检测系统进行测定。PCR反应程序:95 ℃预变性3 min,95 ℃变性10 s,55 ℃退火20 s,72 ℃延伸20 s,75 ℃保持5 s,重复40个循环,每次反应均以18 s1为内参基因,并设置阴性对照。q-PCR的数据分析采用2-△△CT方法,每组实验设置3个生物重复和3个技术重复。
表1 引物序列
Table 1 Primer sequence

基因名称引物序列5'-3'来源18 s1F:CTGTGAAACTGCGAATG-GCTCR:TTCCA-GAAGTCGGGGTTTGTFERRADÁS等[15]AcACO1F:GCTCACGTTCATCAC-CTCGAR:GACTGTATACAATGT-GAACTAMPA等[16]AcACO2F:CGACATGGAGAAACT-TACTGGR:CAGCCTCTAGGCCTTTGGT-TGCFERRADÁS等[15]AcACS1F:AGCTCGCTCTGTTC-CAAGATR:GCGTCTCATTAGCG-GAAGTC登录号:U86865.1AcAMY3F:TCTTCACTGGGGCGTA-AACTR:AATCTCCTTCCACCACTG-CA登录号:AY939871.2
1.4 数据处理
采用SPSS 21.0软件进行统计处理,结果以平均值±标准差表示,采用Duncan多重性比较进行显著性分析(P<0.05),用Origin Pro 2017软件作图。
2 结果与分析
2.1 1-MCP对不同成熟度红阳猕猴桃的保鲜阈值
猕猴桃鲜果可食窗口期的SSC为14%~20%,果肉硬度为3.1~14 N[2, 17-18],此时为完熟生理阶段,找到1-MCP作用红阳猕猴桃的保鲜阈值对“即食”猕猴桃的制备具有重要意义。如图1所示,随着贮藏时间的增加,各组果实逐渐后熟。12 d时,F0、F3和F6组果实后熟程度较低,果肉色泽明亮。同时,CK和F9组果实品质相近,仅色泽偏暗,而F12组果实品质劣变严重,果肉软烂出汁且出现腐烂现象。
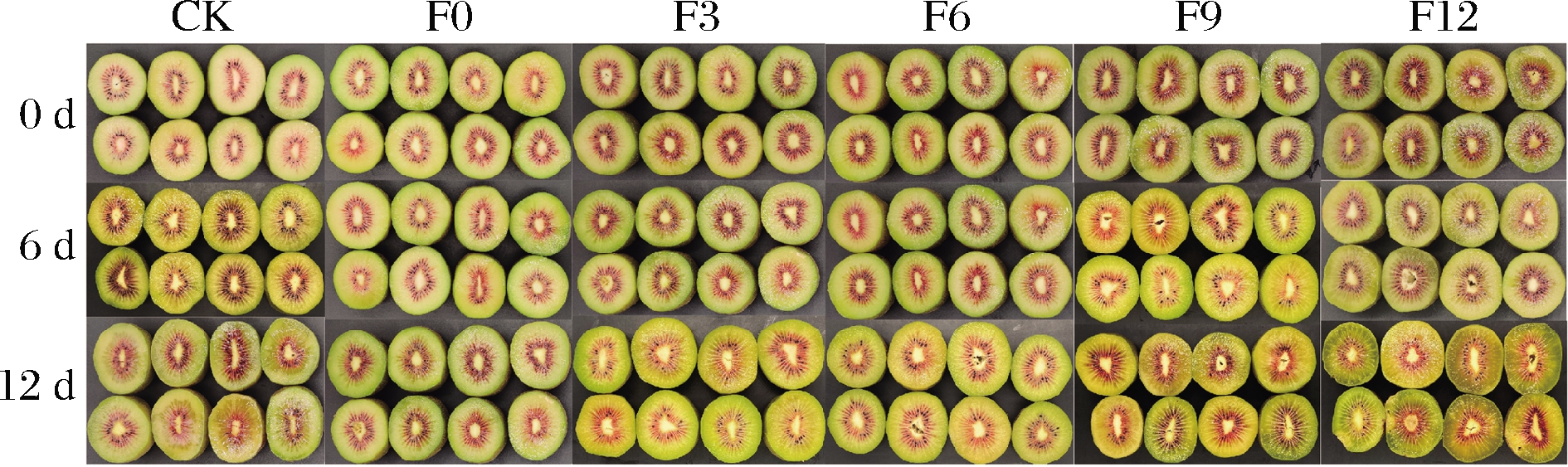
图1 1-MCP阈值试验货架期间果实横剖面
Fig.1 The fruit cross-cutting photos of 1-MCP threshold experiment in shelf-life
如图2-a、图2-b所示,CK及F0、F3、F6、F9和F12组果实的初始SSC分别为(7.61±0.69)%、(7.34±0.64)%、(9.91±0.95)%、(11.36±1.06)%、(14.01±0.92)%和(15.64±0.98)%,初始果肉硬度分别为(56.25±2.69)、(49.41±1.90)、(36.64±2.28)、(26.49±3.30)、(13.96±2.59)和(9.27±0.55) N。CK组果实9 d进入可食窗口期[SSC(14.33±0.60)%,果肉硬度(13.21±1.49) N]。而F0、F3和F6组果实9 d时的SSC为(10.79~12.86)%,均未进入可食窗口期。由此表明1-MCP对于F0、F3和F6组果实具有一定保鲜效果。如图2-a、图2-c所示,从3 d开始,F12组果实的果肉硬度迅速降低,在6 d时为(2.68±1.97)N,腐烂率为(12.20±1.90)%,12 d时腐烂率升至(46.7±3.35)%。而F9组果实6 d的果肉硬度为(10.89±0.71)N,未出现腐烂果,12 d时的腐烂率为(15.5±1.96)%,显著低于F12组(P<0.05)。由此可见,1-MCP对F9组果实仍有保鲜效果,而对F12组果实已失去作用。
如图2-d所示,F0组果实的呼吸峰在9 d出现,相比CK组延迟3 d,乙烯和呼吸峰值较CK组分别显著低85.34%和45.27%(P<0.05)。F3、F6、F9组也表现出相同趋势,乙烯、呼吸峰值均显著低于CK组(P<0.05)。F6和F9组果实在试验初始时的成熟度高于CK组,因此0 d时的呼吸和乙烯生成速率均显著高于CK组。而由于1-MCP的作用,此两组果实的呼吸和乙烯生成速率在6~9 d显著低于CK组(P<0.05)。整个货架期间,F12组乙烯生成速率呈降低趋势,呼吸强度总体平稳,但其0 d时的呼吸强度和乙烯生成速率高于CK组12 d时的数值,表明1-MCP使用后并未产生作用。同时,F12组果实在6 d时已开始腐烂。由此可进一步确定,1-MCP对于F0、F3、F6、F9组果实具有保鲜效果,而对F12组果实已失去作用。综上,1-MCP对红阳猕猴桃的作用阈值为SSC 15%。
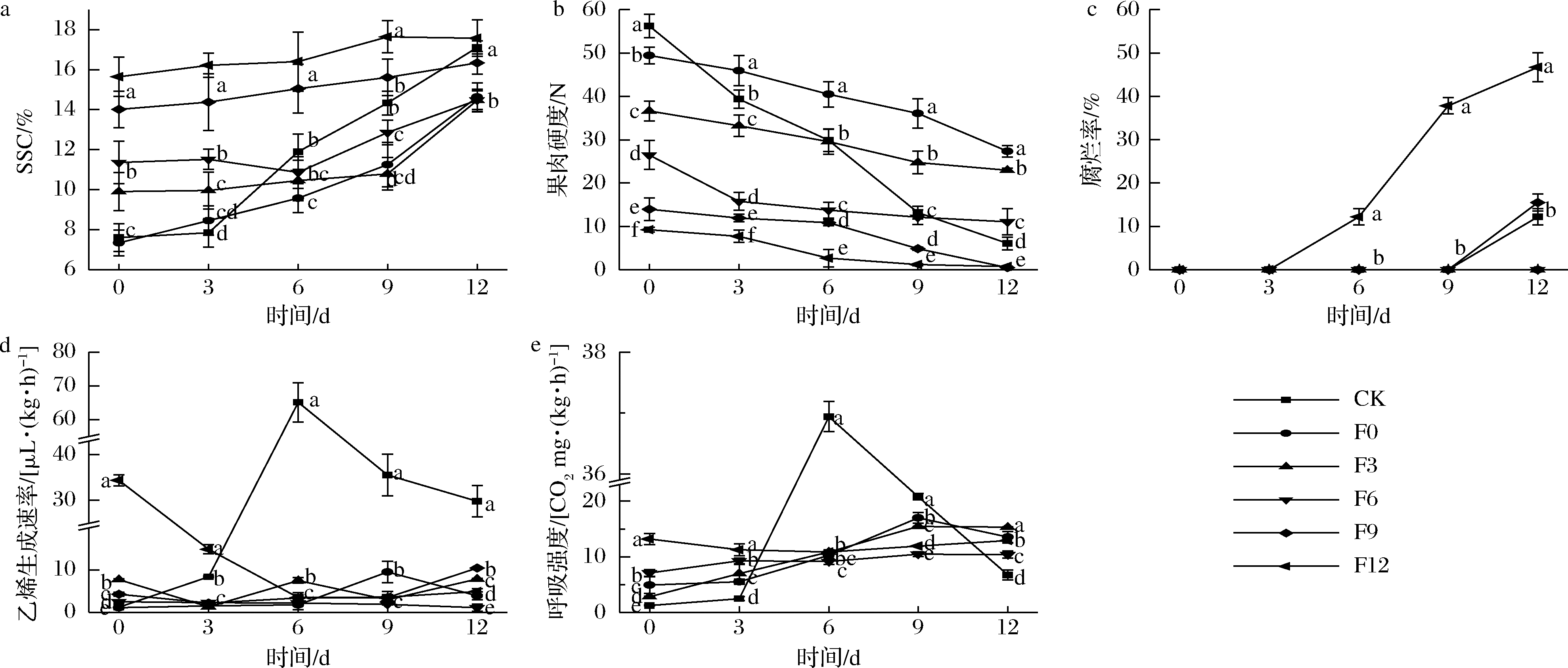
a-SSC;b-果肉硬度;c-腐烂率;d-乙烯生成速率;e-呼吸强度
图2 1-MCP处理对不同成熟度红阳猕猴桃果实SSC、果肉硬度、腐烂率、乙烯生成速率和呼吸强度的影响
Fig.2 Effects of 1-MCP treatment on SSC, pulp firmness, rotting rate, ethylene production rate and respiratory rate of Hongyang kiwifruit with different maturity
注:组间不同字母表示差异显著(P<0.05)(下同)
2.2 不同体积分数乙烯催熟对红阳猕猴桃后熟速率及品质的影响
已见报道的研究中,猕猴桃经乙烯催熟至可食状态时间较长,研究者分别使用1、100、200 μL/L乙烯催熟猕猴桃,分别在催熟后10、3、4 d达到可食状态[13,19-20]。为提高催熟效率,本试验考察了高体积分数(100、250、500、1 000 μL/L)乙烯对红阳猕猴桃的催熟效果。如图3-a所示,各处理果实从5 d开始出现腐烂现象,而CK组果实在整个货架期间未出现腐烂现象,与各处理组差异显著(P<0.05)。如图3-b、图3-c和图4-a所示,经高浓度乙烯催熟后,所有处理组果实硬度迅速降低,SSC迅速升高。直至货架结束,处理组果实的果肉和果心硬度均显著低于CK组(P<0.05)。但各处理组间并无显著差异(P>0.05)。硬度和SSC是判断猕猴桃成熟度的重要指标,红阳猕猴桃的可食硬度为3.1~14 N,可食SSC为14%~20%[2,17-18]。如图3-b所示1 d(催熟结束)时,E1~E4组果肉已接近于可食硬度(14.00~15.60 N)和可食SSC(13.51%~14.25%)(图4-a),相比CK组提前至少8 d。货架3 d时,各处理组果实的SSC均已超过18%,果肉硬度已降至3.63~5.19 N。由此可见,高体积分数乙烯可进一步缩短红阳猕猴桃进入可食窗口期的时间。

a-腐烂率;b-果肉硬度;c-果心硬度
图3 不同体积分数乙烯处理对红阳猕猴桃果肉硬度、果心硬度的影响
Fig.3 Effect of ethylene concentrations on the pulp firmness and core firmness of Hongyang kiwifruit
近年来,猕猴桃后熟“硬心”现象引起国内外研究者的关注。BURDON等[9]研究表明,猕猴桃果实各部位的软化速率不同。果肉硬度变化曲线呈S型,果心硬度则近似线性降低,通常果心的软化速率滞后于果肉,从而出现“硬心”现象。比较图3-b、图3-c中各处理组果实果肉与果心硬度可发现,1 d时E1和E3组果实的果心硬度[(28.86±2.80)、(24.61±2.54)N]远高于可食硬度(3.1~14 N)[17-18],且显著高于其果肉硬度[(14.00±2.57)、(15.61±3.96)N](P<0.05),但E2和E4组果实的果心[(17.43±2.34)、(16.80±2.11) N)]与果肉硬度[(14.59±3.80)、(14.39±6.04)N]均接近于可食硬度。在本研究中,CK、E1和E3组果实在衰老腐烂(5 d)前果心硬度线性降低,而E2和E4组果实果心的软化趋势与果肉相似。综上,E2和E4组催熟效果最好。
如图4-b所示,TA的变化趋势与硬度、SSC相似。1 d(催熟结束)时,各处理组果实TA含量与CK组差异显著(P<0.05),且E4组果实TA含量最低[(0.98±0.02)%],其次为E2组[(1.04±0.01)%]。1 d时E2和E4组果实未出现“硬心”现象且TA含量显著低于CK、E1和E3组(P<0.05),催熟效果最佳。猕猴桃采后可通过淀粉降解为生理代谢活动提供能量。如图4-c所示,CK及处理组果实淀粉含量均呈先快后慢的趋势降低,但CK组在数值上显著更高(P<0.05)。3 d时各处理组果实淀粉含量为0.57~1.27 mg/g,均显著低于CK组[(3.03±0.02) mg/g],其中E2组果实的淀粉含量显著低于所有处理组(P<0.05)。
PRANAMORNKITH等[13]在1.5 ℃下用1 μL/L乙烯处理‘Hort16A’猕猴桃3周,处理组果实的h°显著低于对照组,表明乙烯促进“Hort16A”果实的色泽变化。如图4-d所示,3~9 d时所有处理组果实果肉h°均显著低于CK(P<0.05),表明果实果肉色泽更红。3 d时所有处理组果实已进入可食窗口期,此时h°为98.17~100.59,各处理组间差异不显著(P>0.05)。处理组果实在5 d时的h°进一步降低,此时果实出现腐烂现象(图3-a),且果肉硬度低于3.1 N(图3-b)。CK组在9 d进入可食窗口期,果肉硬度(13.39±1.49) N,SSC(17.85±1.5)%(图3-b和图4-a),h°值为99.24±0.54,与处理组3 d时差异不显著(P>0.05)。由此可知,乙烯加速了红阳猕猴桃果实果肉色泽的变化,且处理组处于可食窗口期期间(3~5 d)的果肉色泽与自然成熟果实相近。

a-SSC;b-TA;c-淀粉;d-h°
图4 不同体积分数乙烯处理对红阳猕猴桃SSC、TA、淀粉、h°的影响
Fig.4 Effect of ethylene concentrations on the SSC, h°, TA and starch content of Hongyang kiwifruit
如图5所示,0~5 d时各处理组果实的乙烯生成速率呈上升趋势且与外源乙烯体积分数呈正相关,均在5 d出现乙烯峰值[23.93~30.48 μL/(kg·h)]。CK组果实的乙烯生成速率在3~7 d内逐渐上升,7 d出现最大值[(12.62±1.06) μL/(kg·h)],比处理组低58.59%(P<0.05)。所有处理组果实在1 d和5 d均出现呼吸峰,5 d时出现的呼吸峰是猕猴桃后熟过程中的呼吸跃变现象所致,而1 d出现的呼吸峰是由于处理组果实在催熟处理过程中直接接触外源乙烯,导致其呼吸强度迅速升高,这与SHIN等[21]的研究结果一致。如图3-a、图3-b和图4-a所示,相比CK组,各处理组果实果肉硬度、果心硬度、SSC和TA在1~5 d内变化迅速,这与呼吸强度和乙烯生成速率的变化趋势相吻合。而在5 d时,呼吸强度和乙烯生成速率及SSC开始降低,果实硬度低于可食硬度,淀粉含量降至0.42~0.52 mg/g且降低速率趋于平缓,所有处理组果实开始出现腐烂现象,腐烂率为13.33%~18.51%(图3-a),表明果实进入衰老阶段。
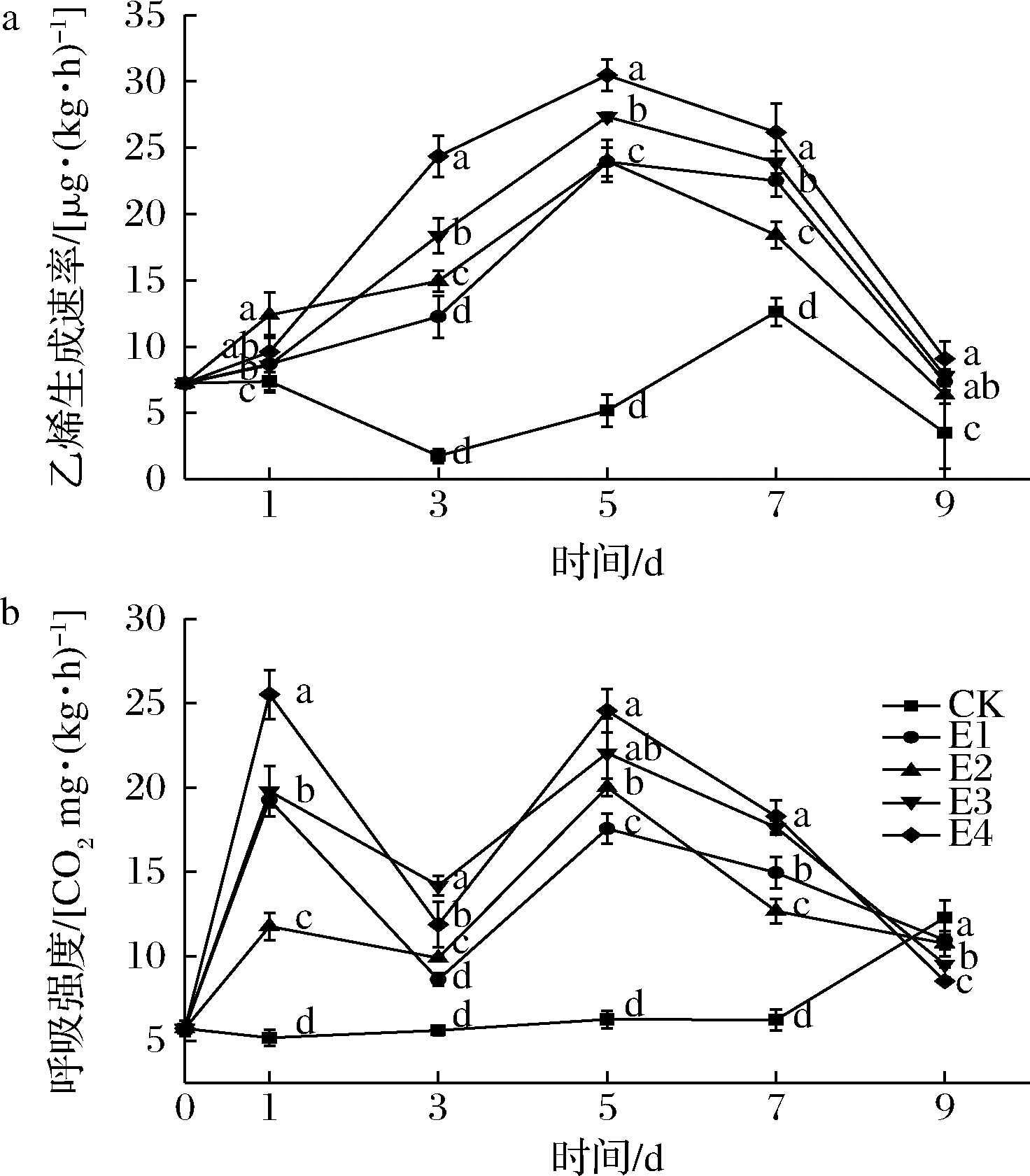
a-乙烯生成速率;b-呼吸强度
图5 不同体积分数乙烯处理对红阳猕猴桃乙烯生成速率、呼吸强度的影响
Fig.5 Effect of ethylene concentrations on the respiration rate and ethylene production rate of Hongyang kiwifruit
基于催熟后果实的货架品质(SSC、TA、果肉硬度、果心硬度等)及腐烂率结果,推荐使用250 μL/L乙烯催熟红阳猕猴桃果实,催熟后果实需在5 d内食用。但5 d的可食窗口期不利于猕猴桃鲜果的流通及销售,因此有必要对催熟后红阳猕猴桃进行保鲜处理。
2.3 不同体积分数1-MCP对催熟后红阳猕猴桃货架品质影响
为确保催熟后红阳猕猴桃果实的可食窗口期,使用CK、M1(0.25 μL/L)、M2(0.5 μL/L)3个体积分数1-MCP对果实进行保鲜处理,4 ℃货架14 d后再进行20 ℃货架7 d试验。如图6-a所示,CK和M1组果实在20 ℃货架3、5 d时均出现腐烂现象,分别为(12.50±4.16)%和(5.56±2.41)%。M2组在20 ℃货架7 d时出现腐烂现象,腐烂率为(6.94±2.40)%,显著低于CK和M1组(P<0.05)。如图6-b、图6-c所示,各组果实果肉、果心硬度均呈先快后慢的下降趋势。整个货架期间,M2组果实的果肉和果心硬度显著高于CK和M1组(P<0.05)。4 ℃货架7 d时各组果实的果肉均处于可食硬度(5.87~9.20) N。CK和M1组果实的果肉在4 ℃货架14 d时低于可食硬度,而M2组在20 ℃货架7 d(货架结束)时仍为(3.48±0.27) N,在可食硬度(3.1~14 N)范围内[17-18]。图5-a表明,20 ℃、5 d时,CK和M1组中出现腐烂果[腐烂率(12.50±4.16)%、(5.55±2.40)%],M2组在20 ℃货架7 d时果实开始腐烂,腐烂率为(6.94±2.41)%,显著低于CK和M1组(P<0.05)。因此,红阳猕猴桃催熟后使用0.5 μL/L的1-MCP处理可有效延缓果实腐烂及其果肉和果心硬度的降低,20 ℃条件下,至少可在5 d内维持其可食硬度。

a-腐烂率;b-果肉硬度;c-果心硬度
图6 不同体积分数1-MCP处理对催熟后红阳猕猴桃腐烂率、果肉硬度、果心硬度的影响
Fig.6 Effect of 1-MCP concentrations on the rotting rate pulp firmness, core firmness of Hongyang kiwifruit after ripening
固酸比是影响水果口感的重要参数[12]。如图7-a所示,M2组果实的SSC均呈先快后慢的上升趋势,CK和M1组果实SSC呈先上升后降低的变化趋势。20 ℃货架5 d时CK组果实SSC出现最大值[(18.37±0.96)%]后开始降低。20 ℃货架7 d时,M2组果实SSC出现最大值[(18.59±1.33)%]且显著高于CK和M1组(P<0.05)。1-MCP处理对催熟后红阳猕猴桃果实TA的代谢有明显抑制作用。4 ℃条件下,M2组果实TA含量始终高于CK和M1组,且差异显著(P<0.05)。转入20 ℃货架后,M2组果实的TA含量迅速降低,在3~7 d时显著高于CK组,7 d时显著高于M1组(P<0.05)。如图7-b所示,4 ℃货架7 d开始,CK组果实的TA含量更低,使其固酸比高于各处理组(P<0.05)。进入20 ℃货架后,M2组果实的固酸比迅速升高,但与CK组差异仍显著(P<0.05)。在果实出现腐烂现象前,CK和M2组的最大固酸比分别为20.34±1.23和18.15±1.11,差异不显著(P>0.05)。表明0.5 μL/L的1-MCP处理后,果实的固酸比接近于对照组。如图7-c所示,果实的初始淀粉含量为(2.29±0.03)mg/g,后逐渐降低。4 ℃条件下,处理组果实淀粉含量均显著高于CK组(P<0.05)。20 ℃货架5 d时,M2组果实淀粉含量[(0.41±0.03) mg/g]显著高于CK和M1组[(0.31±0.01)和(0.33±0.03) mg/g](P<0.05)。
如图7-d所示,所有组果实的h°均呈下降趋势。4 ℃条件下,M2组果实h°的下降趋势更为平缓,且在14 d时显著高于CK和M1组(P<0.05)。在果实出现腐烂现象前,CK组果实的h°与M2组差异不显著(P>0.05),分别为92.93±1.17和93.44±0.86。由此可知,催熟后1-MCP处理延缓了果实果肉色泽的变化,处理组果实果肉色泽在果实出现腐烂现象前与CK组差异不显著(P>0.05)。

a-SSC、TA;b-固酸比;c-淀粉;d-h°
图7 不同体积分数1-MCP处理对催熟后红阳猕猴桃SSC、TA、固酸比、淀粉、h°的的影响
Fig.7 Effect of 1-MCP concentrations on the SSC, TA, solidity-acid ratio, starch, h° of Hongyang kiwifruit after ripening
ASA和叶酸是猕猴桃果实中重要的营养功能物质,1-MCP可抑制猕猴桃果实中ASA和叶酸的代谢[22]。如图8所示,ASA和叶酸的初始含量分别为(87.2±0.48) mg/100 g和(73.6±1.98) μg/100 g,催熟结束后分别降至(85.50±0.98) mg/100 g和(68.25±3.32) μg/100 g。4 ℃货架14 d、20 ℃货架5 d和7 d时,CK组果实ASA含量显著低于各处理组(P<0.05),表明1-MCP处理可有效延缓果实ASA的降解。20 ℃货架7 d时,M2组果实ASA含量显著高于M1组,分别为(63.4±1.70) mg/100 g和(59.2±1.45) mg/100 g(P<0.05)。
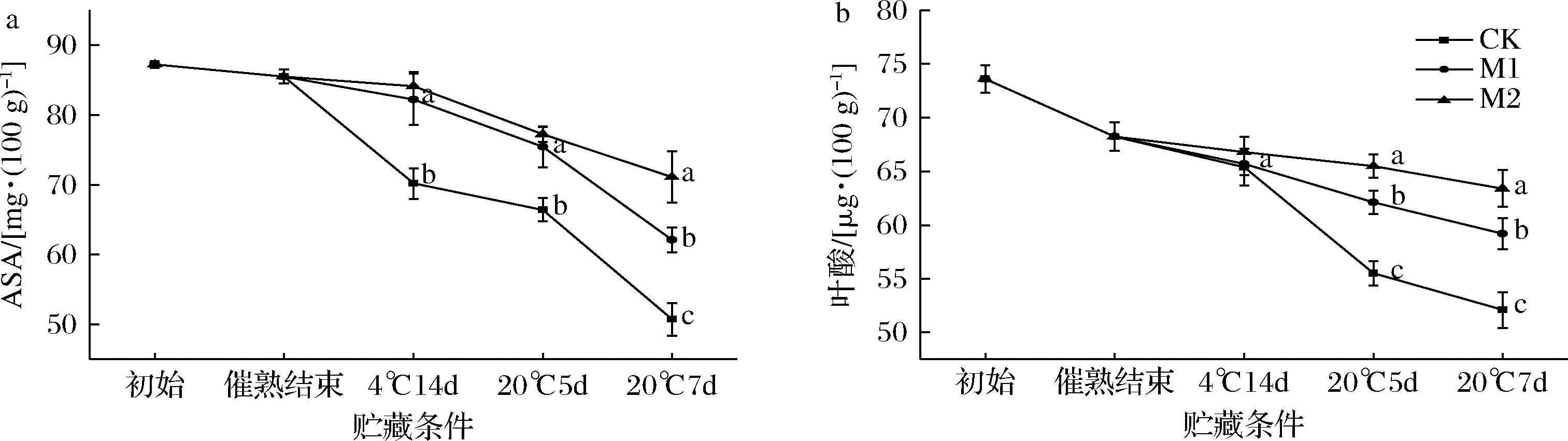
a-ASA;b-叶酸
图8 不同体积分数1-MCP处理对催熟后红阳猕猴桃ASA、叶酸的影响
Fig.8 Effect of 1-MCP concentrations on the ASA, folic acid of Hongyang kiwifruit after ripening
如图8-b所示,4 ℃货架14 d时,各组果实叶酸含量为65 μg/100 g左右,无显著差异(P>0.05)。20 ℃货架5~7 d时,M2组叶酸含量始终处于最高水平,分别为(65.5±2.09) μg/100 g和(63.4±1.70) μg/100 g,显著高于其余两组(P<0.05)。因此,0.5 μL/L的1-MCP处理可有效延缓催熟后红阳猕猴桃果实ASA和叶酸的降解。
红阳猕猴桃经250 μL/L乙烯催熟后5 d出现乙烯和呼吸峰(图5),本节实验中各组果实乙烯和呼吸峰最大值在4 ℃货架7 d出现(图9-a、图9-b)。由此,推断各组果实的乙烯和呼吸峰在4 ℃货架7 d前已出现。4 ℃条件下,各组果实的呼吸和乙烯生成速率迅速降低,而果实进入20 ℃货架后,CK和M1组果实的乙烯生成速率出现上升趋势,这是因为低温可抑制猕猴桃果实的呼吸降低乙烯生成速率[23]。这一现象在呼吸强度(图9-b)的变化上更为明显。20 ℃货架3 d开始,CK和M1组果实的呼吸强度迅速上升,显著高于M2组(P<0.05),同时各组的淀粉含量进一步降低(图7-d)。20 ℃条件下,CK和M1组果实在5 d时腐烂率为(12.50±4.16)%、(5.55±2.40)%,出现腐烂现象(图6-a)。而M2组果实在7 d时呼吸强度迅速上升同时部分果实开始出现腐烂[(7.79±0.77)%]。因此,在整个货架期间,0.5 μL/L的1-MCP处理均可有效抑制催熟后红阳猕猴桃果实的生理代谢,保证品质。
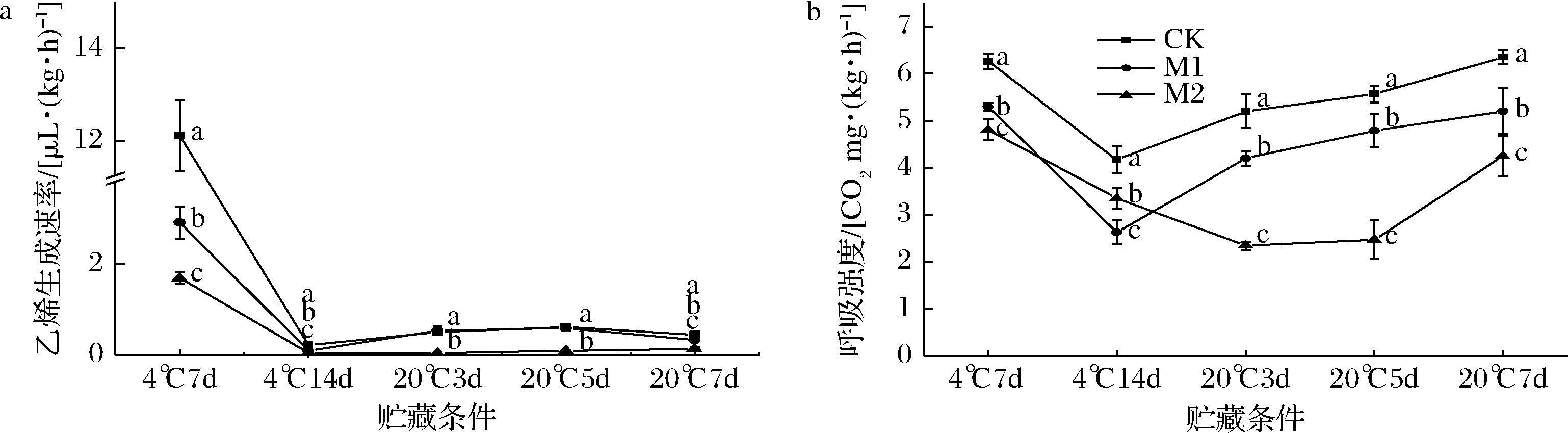
a-乙烯生成速率;b-呼吸强度
图9 不同浓度1-MCP处理对催熟后红阳猕猴桃乙烯生成速率、呼吸强度的影响
Fig.9 Effect of 1-MCP concentrations on the ethylene production rate, respiratory rate of Hongyang kiwifruit after ripening
2.4 不同体积分数乙烯催熟及1-MCP保鲜处理对红阳猕猴桃后熟基因表达影响
乙烯诱导猕猴桃成熟信号通路网络中相关基因的表达,如乙烯生物合成通路中的1-氨基环丙烷-1-羧酸氧化酶(1-aminocyclopropane-1-carboxylic acid oxidase,ACO)和合成酶(1-aminocyclopropane-1-carboxylate synthase,ACS)基因,以及淀粉降解代谢途径中α-淀粉酶(α-amylases,AMY)基因。经高体积分数乙烯处理后,各处理组果实AcACO1、AcACO2和AcACS1的相对表达量(图10-b~图10-d)在3~5 d显著高于CK组。同时,其乙烯生成速率(图5-a、图5-b)在3~5 d时显著高于CK组(P<0.05),两者呈高度正相关(图11)。各处理组果实的果肉和果心硬度在3~5 d均迅速降低(图3-a、图3-b),与AcACO1、AcACO2和AcACS1基因的相对表达量呈负相关。由此可知,高浓度乙烯处理上调红阳猕猴桃果实乙烯生物合成通路中关键信号基因的表达,诱导内源性乙烯生成并加速生理代谢,使果实在1 d时接近于可食硬度(14.00~15.60) N(图3-a),5 d时出现腐烂现象(13.33~26.67 %)。如图10-a所示,3 d时除E3组外,其余处理组果实的AcAMY3相对表达量与CK组无显著差异,5 d时各处理组与CK组差异显著(P<0.05)。这与陈景丹等[24]的研究结果相一致,乙烯处理会在成熟后期推动AcAMY3基因的表达。本实验出现高体积分数乙烯催熟后AcAMY3基因上调并不明显(图10-a),且基因表达量与淀粉含量弱相关(图11),推测原因为猕猴桃中含有直链和支链淀粉,AMY对于支链淀粉的降解更加有效且AcAMY3更多的是辅助β-淀粉酶降解淀粉[25]。另外,ASA、叶酸、淀粉和TA均与AcACO1、AcACO2和AcACS1基因的相对表达量呈负相关(图11)。由此可知,高体积分数乙烯诱导AcACO1、AcACO2和AcACS1的表达,显著提升各处理组果实呼吸和乙烯生成速率,加速果实后熟,在1 d接近可食窗口期,但在5 d出现腐烂,需使用1-MCP进行保鲜处理,以延长可食窗口期。
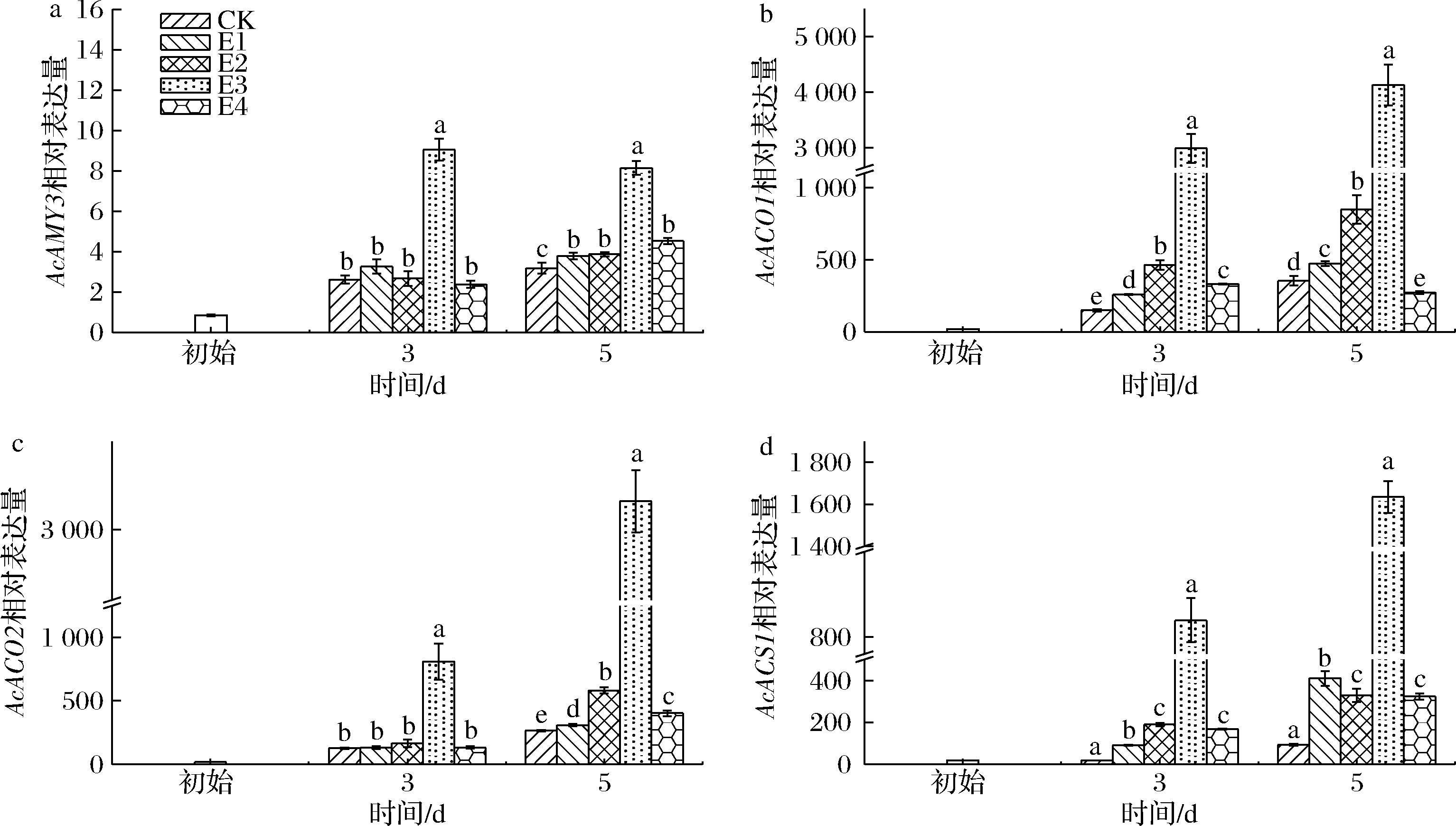
a-AcAMY3;b-AcACO1;c-AcACO2;d-AcACS1
图10 不同体积分数乙烯处理对红阳猕猴桃AcAMY3、AcACO1、AcACO2、AcACS1相对表达量的影响
Fig.10 Effect of ethylene concentrations on the relative expression levels of AcAMY3, AcACO1, AcACO2, AcACS1 of Hongyang kiwifruit
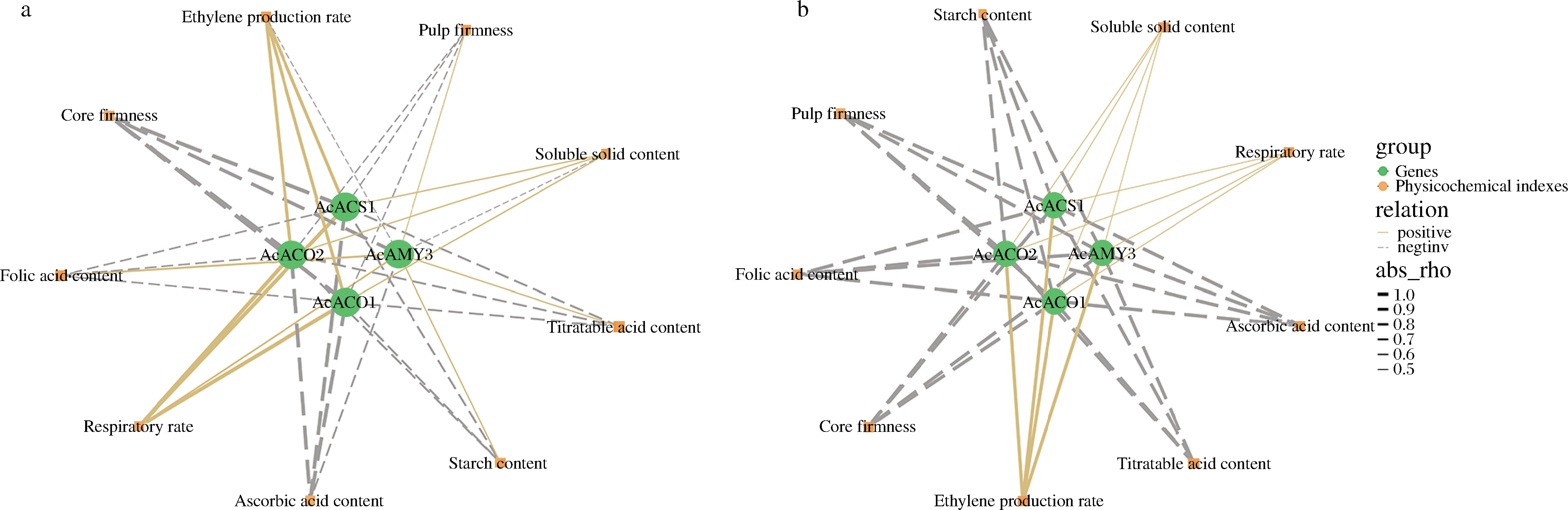
a-乙烯催熟处理;b-1-MCP保鲜处理
图11 乙烯催熟处理和1-MCP保鲜处理的相关性网络图
Fig.11 Correlation network diagram of ethylene ripening treatment and 1-MCP preservation treatment
如图12所示,20 ℃条件下,M2组果实的AcACO1、AcACO2和AcACS1相对表达量显著升高(P<0.05),淀粉含量加速降低,但AcAMY3表达量同样降低,表明货架温度升高能抑制AcAMY3的表达且AcAMY3在红阳猕猴桃淀粉降解途径中仅为辅助作用,由此推断淀粉的降解可能与乙烯和其他淀粉酶的作用相关,这与朱婷婷等[26]的研究结论相一致。如图12所示,整个货架期间M2组果实AcACO1、AcACO2、AcACS1和AcAMY3的相对表达量显著低于其余组(P<0.05),再结合相关性网络图(图11)分析可推断,1-MCP与乙烯受体发生结合的同时下调了乙烯生物合成通路中关键信号基因的表达,由此抑制了乙烯诱导的呼吸作用,延缓果实品质劣变。这一结论与XU等[27]研究结果相一致。
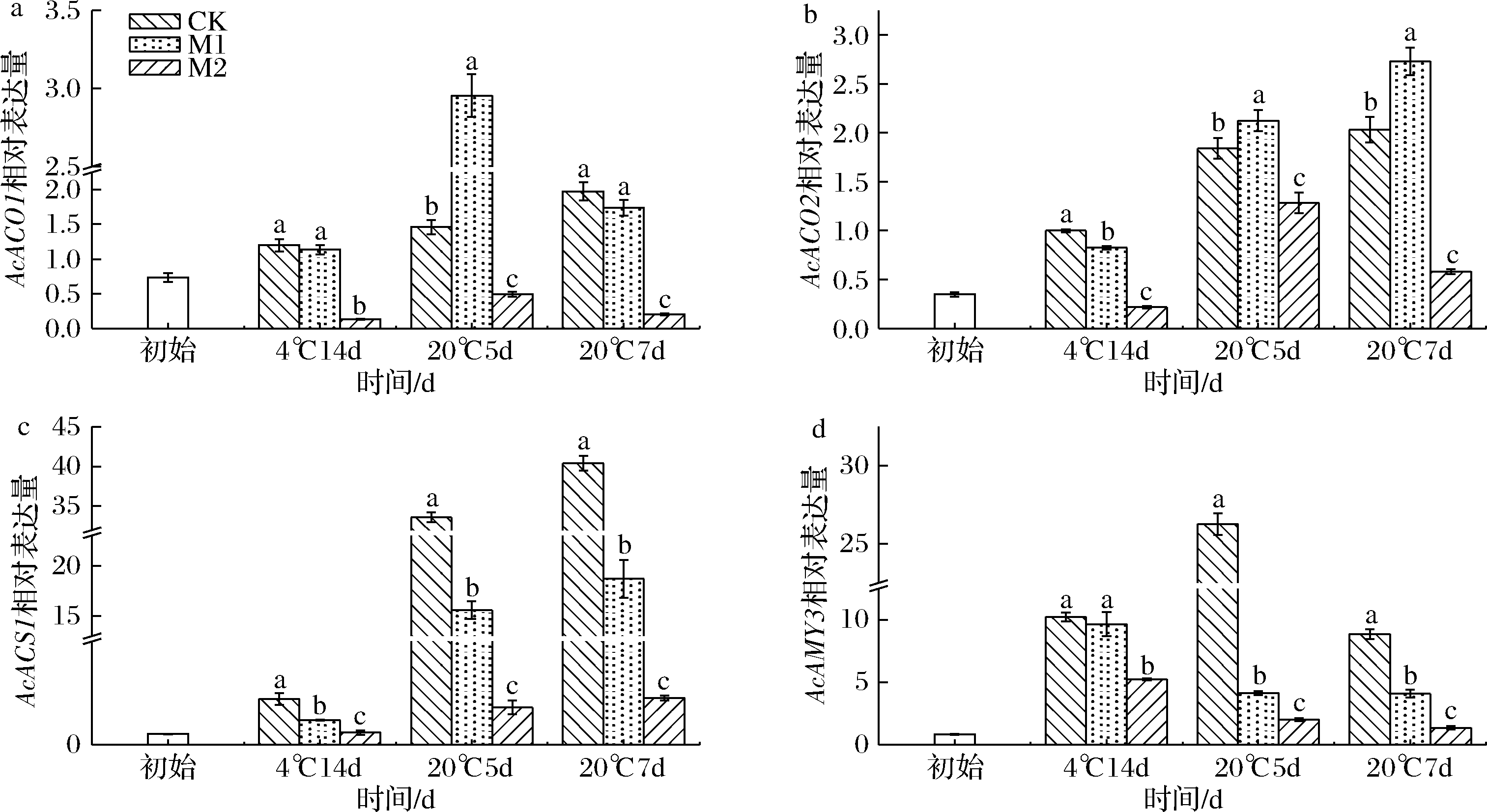
a-AcAMY3;b-AcACO1;c-AcACO2;d-AcACS1
图12 不同体积分数1-MCP处理对催熟后红阳猕猴桃AcAMY3、AcACO1、AcACO2、AcACS1相对表达量的影响
Fig.12 Effect of 1-MCP concentrations on the relative expression levels of AcAMY3, AcACO1, AcACO2, AcACS1 of Hongyang kiwifruit after ripening
3 结论
本研究通过阈值实验发现,0.5 μL/L的1-MCP对红阳猕猴桃的保鲜阈值为SSC 15%;乙烯催熟实验结果表明,对于SSC为(11.58±1.01)%、果肉硬度为(51.41±5.35)N的猕猴桃果实,高体积分数乙烯(100、250、500、1 000 μL/L)可提高催熟效率,各处理组果实均在1 d时接近可食窗口期,即果肉硬度(14.00~15.60) N,SSC(13.51~14.25)%],综合比较,推荐以250 μL/L乙烯催熟红阳猕猴桃;1-MCP保鲜实验结果表明,0.5 μL/L的1-MCP处理可有效延长可食窗口期。整个货架期间果实无“硬心”现象,其腐烂前最大固酸比(18.15±1.10)与CK组(20.34±1.64)无显著差异(P>0.05),在果肉、果心硬度和固酸比上接近未处理果实。同时,ASA和叶酸含量比CK组可食状态时显著高16.26%和18.02%(P<0.05),维持了果实的营养品质。
综上,“即食”红阳猕猴桃的优化制备工艺为:首先使用250 μL/L乙烯催熟果实24 h(25±2) ℃,然后使用0.5 μL/L 1-MCP处理24 h、(25±2) ℃。通过验证AcACO1、AcACO2、AcACS1等基因表达量与果实货架生理、品质的关系,确证了该工艺的可靠性并为其提供了理论支持。
[1] PAULSEN E, BARRIOS S, LEMA P.Ready-to-eat cherry tomatoes:Passive modified atmosphere packaging conditions for shelf life extension[J].Food Packaging and Shelf Life, 2019, 22:100407.
[2] WANG S N, QIU Y, ZHU F.Kiwifruit (Actinidia spp.):A review of chemical diversity and biological activities[J].Food Chemistry, 2021, 350:128469.
[3] FABI J P, DO PRADO S.Fast and furious:Ethylene-triggered changes in the metabolism of papaya fruit during ripening[J].Frontiers in Plant Science, 2019, 10:535.
[4] TOKALA V Y, SINGH Z, KYAW P N.Postharvest fruit quality of apple influenced by ethylene antagonist fumigation and ozonized cold storage[J].Food Chemistry, 2021, 341:128293.
[5] GÜNTHER C S, MARSH K B, WINZ R A, et al.The impact of cold storage and ethylene on volatile ester production and aroma perception in ‘Hort16A’ kiwifruit[J].Food Chemistry, 2015, 169:5-12.
[6] BLANKENSHIP S M, DOLE J M.1-methylcyclopropene:A review[J].Postharvest Biology and Technology, 2003, 28(1):1-25.
[7] BASWAL A K, RAMEZANIAN A.1-methylcyclopropene potentials in maintaining the postharvest quality of fruits, vegetables, and ornamentals:A review[J].Journal of Food Processing and Preservation, 2021, 45(1):e15129.
[8] 胡花丽, 王毓宁, 李鹏霞.气调贮藏对猕猴桃抗坏血酸-谷胱甘肽代谢的影响[J].现代食品科技, 2015, 31(7):152-159.
HU H L, WANG Y N, LI P X.Effect of controlled-atmosphere storage on ascorbate-glutathione metabolism in kiwifruit[J].Modern Food Science and Technology, 2015, 31(7):152-159.
[9] BURDON J, PIDAKALA P, MARTIN P, et al.Softening of ‘Hayward’ kiwifruit on the vine and in storage:The effects of temperature[J].Scientia Horticulturae, 2017, 220:176-182.
[10] LI D X, ZHU F.Starch structure in developing kiwifruit[J].International Journal of Biological Macromolecules, 2018, 120:1 306-1 314.
[11] WANG T, YUN J M, ZHANG Y, et al.Effects of ozone fumigation combined with nano-film packaging on the postharvest storage quality and antioxidant capacity of button mushrooms (Agaricus bisporus)[J].Postharvest Biology and Technology, 2021, 176:111501.
[12] SIVAKUMARAN S, HUFFMAN L, SIVAKUMARAN S, et al.The nutritional composition of Zespri® SunGold Kiwifruit and Zespri® Sweet Green Kiwifruit[J].Food Chemistry, 2018, 238:195-202.
[13] PRANAMORNKITH T, EAST A, HEYES J.Influence of exogenous ethylene during refrigerated storage on storability and quality of Actinidia chinensis (cv.Hort16A)[J].Postharvest Biology and Technology, 2012, 64(1):1-8.
[14] KOU J J, WEI C Q, ZHAO Z H, et al.Effects of ethylene and 1-methylcyclopropene treatments on physiological changes and ripening-related gene expression of ‘Mopan’ persimmon fruit during storage[J].Postharvest Biology and Technology, 2020, 166:111185.
[15] FERRAD S Y, REY L, MART
S Y, REY L, MART NEZ
NEZ  , et al.Identification and validation of reference genes for accurate normalization of real-time quantitative PCR data in kiwifruit[J].Plant Physiology and Biochemistry, 2016, 102:27-36.
, et al.Identification and validation of reference genes for accurate normalization of real-time quantitative PCR data in kiwifruit[J].Plant Physiology and Biochemistry, 2016, 102:27-36.
[16] AMPA K, IKEURA H, SAITO T, et al.Effects of pre-harvest application of ethephon or abscisic acid on ‘Kohi’ kiwifruit (Actinidia chinensis) ripening on the vine[J].Scientia Horticulturae, 2016, 209:255-260.
[17] TESTOLIN R, HUANG H W, FERGUSON A R.The Kiwifruit Genome[M].Cham:Springer International Publishing, 2016.
[18] QUILLEHAUQUY V, FASCIGLIONE M G, MORENO A D, et al.Effects of cold storage duration and 1-MCP treatment on ripening and ‘eating window’ of ‘Hayward’ kiwifruit[J].Journal of Berry Research, 2020, 10(3):419-435.
[19] 袁沙, 李华佳, 朱永清, 等.‘红阳’猕猴桃乙烯催熟特性[J].食品科学, 2018, 39(9):244-251.
YUAN S, LI H J, ZHU Y Q, et al.Ripening characteristics of ‘Hongyang’ kiwifruits following postharvest ethylene treatment[J].Food Science, 2018, 39(9):244-251.
[20] LIM S, LEE J G, LEE E J.Comparison of fruit quality and GC-MS-based metabolite profiling of kiwifruit ‘Jecy green’:Natural and exogenous ethylene-induced ripening[J].Food Chemistry, 2017, 234:81-92.
[21] SHIN M H, MUNEER S, KIM Y H, et al.Proteomic analysis reveals dynamic regulation of fruit ripening in response to exogenous ethylene in kiwifruit cultivars[J].Horticulture, Environment, and Biotechnology, 2020, 61(1):93-114.
[22] XU F X, LIU S Y, LIU Y F, et al.Effectiveness of lysozyme coatings and 1-MCP treatments on storage and preservation of kiwifruit[J].Food Chemistry, 2019, 288:201-207.
[23] SUO J T, LI H, BAN Q Y, et al.Characteristics of chilling injury-induced lignification in kiwifruit with different sensitivities to low temperatures[J].Postharvest Biology and Technology, 2018, 135:8-18.
[24] 陈景丹, 许凤, 陈伟, 等.猕猴桃果实采后软化期间淀粉降解关键基因表达分析[J].核农学报, 2018, 32(2):236-243.
CHEN J D, XU F, CHEN W, et al.Starch degradation and analysis of key-gene expression during postharvest kiwifruit softening[J].Journal of Nuclear Agricultural Sciences, 2018, 32(2):236-243.
[25] SOARES C A, PERONI-OKITA F H G, CARDOSO M B, et al.Plantain and banana starches:Granule structural characteristics explain the differences in their starch degradation patterns[J].Journal of Agricultural and Food Chemistry, 2011, 59(12):6 672-6 681.
[26] 朱婷婷, 陈景丹, 方筱琴, 等.低温贮藏对猕猴桃果实成熟软化相关基因表达影响[J].核农学报, 2020, 34(10):2 199-2 208.
ZHU T T, CHEN J D, FANG X Q, et al.Effects of low temperature storage on the expression of genes involved in maturation and softening of kiwifruit fruits[J].Journal of Nuclear Agricultural Sciences, 2020, 34(10):2 199-2 208.
[27] XU F X, LIU S Y, XIAO Z G, et al.Effect of ultrasonic treatment combined with 1-methylcyclopropene (1-MCP) on storage quality and ethylene receptors gene expression in harvested apple fruit[J].Journal of Food Biochemistry, 2019, 43(8):e12967.