四川泡菜是中国泡菜的典型代表,被誉为“川菜之骨”,堪称“国粹”[1],其历史可追溯到商朝。可用作四川泡菜原料的蔬菜多种多样,在我国西南地区,萝卜、豇豆、辣椒是常用的制作四川泡菜的蔬菜原料[2]。不同种类的新鲜蔬菜在6%~8%的盐水泡渍下,经蔬菜表面或外接乳酸菌发酵5~7 d后,即可得到四川泡菜[3]。以乳酸菌为优势菌主导发酵而成的四川泡菜不仅质地鲜嫩、味道酸咸,而且含有丰富的益生菌,经常食用可改善肠道微生物菌群结构[4]。
微生物作为四川泡菜发酵的关键因子,近年来备受国内外学者关注。传统研究四川泡菜中微生物多样性的方法主要是利用可培养法,但实际上四川泡菜中还有大量的不可培养微生物,随着现代分子生物学方法的不断发展,高通量测序技术被广泛用于多种生态系统的微生物多样性研究中[5],该法具有高准性、高通量、高灵敏度和低运行成本等特点,非常适合于四川泡菜中微生物多样性的研究[6]。目前,研究者对四川泡菜中的微生物研究多关注于不同的温度、盐浓度、季节等条件下微生物菌群结构的不同[7-8],实际上,泡菜中的微生物多样性与蔬菜原料种类有很大关系[9]。有研究表明Lactobacillus、Leuconostoc、Achromobacter和Pediococcus主导了白菜泡菜的发酵[10],Lactobacillus、Serratia、Enterobacter和Pediococcus是四川萝卜泡菜中的主要微生物[11],Lactobacillus、Pseudomonas、Vibrio和Halomonas是青菜泡菜中的主要微生物[6]。
鉴于此,本研究选取萝卜、豇豆、辣椒以及3种蔬菜按比例混合为四川泡菜原料,利用高通量测序技术分析比较不同蔬菜原料四川泡菜中微生物多样性差异,通过对数据进一步挖掘,深入分析不同蔬菜种类四川泡菜中微生物和理化因子的相关性。这对指导四川泡菜工业化生产,丰富四川泡菜产品种类具有重要意义,同时也为四川泡菜产业的现代化升级提供理论基础。
1 材料与方法
1.1 材料与试剂
新鲜红皮萝卜、辣椒(二荆条)、豇豆,均购于超市;泡菜老卤,取自于四川本地常年制作四川泡菜家庭(卤水已循环使用8年);亚硝酸钠、亚铁氰化钾、对氨基苯磺酸、盐酸萘乙二胺,科龙化工试剂厂;乳酸、乙酸,色谱纯,美仑生物科技有限公司;琼脂糖,美国Sigma公司;PowerSoil DNA提取试剂盒,美国Mobio公司;胶回收试剂盒,美国OMEGA公司;TruSeq DNA PCR-Free Sample Prep Kit、Hiaeq Rapid SBS Kit v2,Illumina公司。
1.2 仪器与设备
pH S-3C型酸度计,成都世纪方舟科技有限公司;SpectraMax® i3x酶标仪,美谷分子仪器(上海)有限公司;冷冻离心机,美国Thermo Fisher Scientific公司;超低温冰箱,Heo Ultra Freeze;凝胶成像系统,美国Bio-Rad公司;电泳仪,北京六一仪器厂;PCR仪,美国Eppendorf公司;Waters2695 HPLC系统,沃特世科技(上海)有限公司。
1.3 实验方法
1.3.1 四川泡菜的制作及样品采集
将新鲜红皮萝卜、豇豆和辣椒用自来水冲洗干净,自然晾干。萝卜泡菜,豇豆泡菜和辣椒泡菜需分别称取1 kg洗净晾干的萝卜、豇豆和辣椒加入到3 L玻璃坛中,混合泡菜则需取3种蔬菜各1 kg混合加入到10 L玻璃坛中。将煮沸的开水冷却后配成质量分数为6%的盐溶液,并按1∶500的比例向盐溶液中接种泡菜老卤制成新盐卤。将新盐卤加入泡菜坛中至没过蔬菜,加盖,并在坛沿加水密封,每种四川泡菜制作3坛,于室温(25~30 ℃)发酵6 d。发酵完成后分别取泡菜坛上、中、下3层盐卤各10 mL,混合均匀后于4 ℃冷冻离心机4 000 r/min离心10 min,将沉淀重悬于10 mL无菌生理盐水中用于高通量测序分析,上清液用于理化特性测定。
1.3.2 不同蔬菜种类四川泡菜的理化特性测定
每2 d对四川泡菜的pH和亚硝酸盐含量进行测定,其中,pH的测定使用pH S-320酸度计进行,亚硝酸盐含量参照GB 5009.33—2016《食品中亚硝酸盐与硝酸盐的测定》中的第二法分光光度法进行测定。
对发酵完成后的四川泡菜进行有机酸测定,测定方法如下,样品处理:取2 mL样品8 000 r/min离心2 min,取上清液1 mL于0.22 μm滤膜过滤,进样体积为10 μL。检测条件:使用美国Bio-Rad125-0140酸柱(300 mm×7.8 mm),以0.005 6 mol/L的稀硫酸为流动相(流速0.5 mL/min),检测波长210 nm,冲洗时间60 min[12]。
1.3.3 总DNA的提取和扩增
使用PowerSoil DNA提取试剂盒对不同蔬菜种类泡菜盐卤样品中的总DNA进行提取,通过扩增引物515F(5′-GTGCCAGCMGCCGCGGTAA-3′)和806R(5′-GGACTACHVGGGTWTCTAAT-3′)对细菌16S rRNA V4~V5区进行扩增,扩增得到的PCR产物用2%琼脂凝胶在5 V/cm的条件下电泳检测20 min,切胶回收PCR产物,使用TE缓冲液洗脱回收目标DNA片段,Qubit 2.0对PCR回收产物进行检测定量,并按照每个样本的测序质量要求,进行相应比列的混合。
1.3.4 高通量测序及生物信息分析
高通量测序以及微生物多样性分析在成都罗宁生物科技有限公司进行。本次测序采用的是PE250测序方式,测序试剂盒采用Hiseq Rapid SBS Kit v2。双端测序得到的PE reads首先使用FLASH进行拼接,同时对序列质量进行质控,在去除低质量碱基及接头污染序列等操作过程后完成数据过滤,得到可供后续分析的高质量目标序列。后续生物信息学操作使用QIIME、Usearch、Mothur等完成,统计和作图主要使用R、python和java等软件完成。
1.3.5 数据处理及分析
通过Origin 2018、IBM SPSS Statistics 20、GraphPad Prism等软件对3个平行实验得到的数据进行处理。利用Omicshare所提供的典型相关分析(canonical correlation analysis,CCA)计算工具,分析理化因子和样品中微生物菌群的关系;利用Omicshare所提供的组间相关性分析计算不同蔬菜种类四川泡菜中微生物与理化因子的相关系数(ρ),该分析工具主要利用R包进行分析,本研究采用spearman系数法专门用于计算等级数据的相关性。通过计算得到的相关系数为正即表示正相关,为负即表示负相关,相关系数的绝对值越大,表明相关性越强。通常认为0.0<|ρ|<0.2为极弱相关或无相关,0.2<|ρ|<0.4为弱相关,0.4<|ρ|<0.6为中等程度相关,0.6<|ρ|<0.8为强相关,0.8<|ρ|<1.0为极强相关。
2 结果与分析
2.1 不同蔬菜种类四川泡菜的理化特性分析
pH和亚硝酸盐含量是四川泡菜成熟的2个主要指标[13],通常情况下,当四川泡菜的pH降至4.5以下时表明泡菜已经基本成熟。由图1-a和图1-b可以看出,发酵6 d后,不同蔬菜种类四川泡菜的pH均降至4.5以下,亚硝酸盐含量也降至安全低水平范围内(小于20 mg/kg),此时豇豆泡菜的亚硝酸盐含量为(1.14±1.08) mg/kg,是4种泡菜中亚硝酸盐含量最低的,并且与辣椒泡菜和萝卜泡菜具有显著性差异(P<0.05)。有研究表明,四川泡菜的pH降低主要是由于乳酸菌代谢产生乳酸和醋酸引起的[14],不同蔬菜种类四川泡菜发酵第6天的有机酸测定结果见图1-c和图1-d,可以发现,辣椒泡菜具有最低的乳酸和醋酸浓度,其中,乳酸浓度与萝卜泡菜和混合泡菜具有显著性差异(P<0.05),醋酸浓度与混合泡菜具有显著性差异(P<0.05),且辣椒泡菜具有最高的pH。豇豆泡菜和萝卜泡菜均有最低的pH和较高的有机酸总浓度,而混合蔬菜由于受辣椒原料的影响,虽具有最高的有机酸总浓度,但其pH和辣椒泡菜无显著性差异(P>0.05)。由此可知,蔬菜种类不同四川泡菜所表现出的理化特性也有所差异。

a-pH;b-亚硝酸盐含量;c-乳酸浓度;d-醋酸浓度
图1 不同蔬菜种类四川泡菜的理化性质
Fig.1 Physicochemical properties of the Sichuan Paocai with different vegetable species
2.2 不同蔬菜种类四川泡菜中细菌群落高通量测序质量分析
本实验要求每个样本测序深度>10 000条序列,12个样本共获得816 897条序列,平均长度为310 bp,能够覆盖16S rRNA V4~V5区域长度。序列经过过滤和质量控制后,每个泡菜样本可用序列深度均在10 000条以上。去掉低质量序列后,在97%的相似性水平上使用UPARSE算法进行OTU的聚类,泡菜盐卤样品中的细菌总共划分为445个OTUs,从表1中可以发现,每个泡菜盐卤样本中OTUs的划分情况各不相同,基于此可以对泡菜盐卤发酵过程中物种多样性进行分析。
表1 四川泡菜盐卤中细菌群落高通量测序情况
Table 1 Summary of the high-throughput sequencing reads in Sichuan Paocai brine
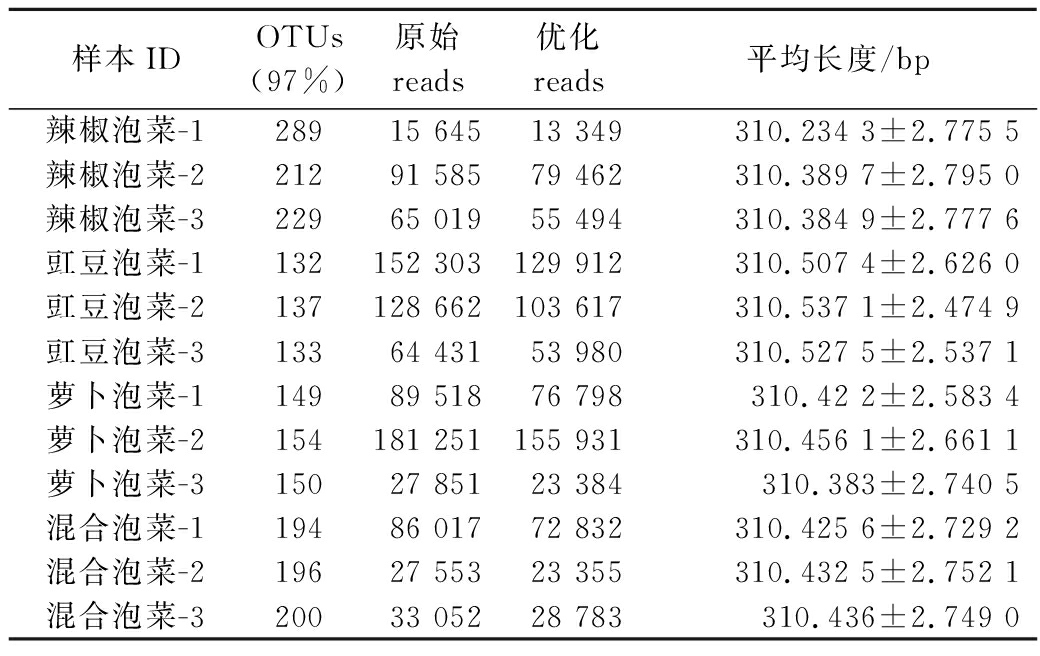
样本IDOTUs(97%)原始reads优化reads平均长度/bp辣椒泡菜-128915 64513 349310.234 3±2.775 5辣椒泡菜-221291 58579 462310.389 7±2.795 0辣椒泡菜-322965 01955 494310.384 9±2.777 6豇豆泡菜-1132152 303129 912310.507 4±2.626 0豇豆泡菜-2137128 662103 617310.537 1±2.474 9豇豆泡菜-313364 43153 980310.527 5±2.537 1萝卜泡菜-114989 51876 798310.42 2±2.583 4萝卜泡菜-2154181 251155 931310.456 1±2.661 1萝卜泡菜-315027 85123 384310.383±2.740 5混合泡菜-119486 01772 832310.425 6±2.729 2混合泡菜-219627 55323 355310.432 5±2.752 1混合泡菜-320033 05228 783310.436±2.749 0
稀释曲线是从样本中随机抽取一定数量的个体样本,统计这些个体所代表的物种数目,并以个体数(横坐标)和物种数(纵坐标)来构建曲线。通过绘制稀释曲线可间接反映样本中物种的丰富程度。当曲线趋于平缓时可认为测序深度已经基本覆盖到样品
中所有的物种,测序已趋于饱和,能代表样本中绝大多数的微生物信息[15]。由图2-a可知,随着测序深度的增加,OTU的数目增加量逐渐减少,但仍未达到饱和和平坦状态,但从图2-b来看,随着测序量的扩大,多样性指数增加的趋势逐渐变慢,并且达到了饱和状态,这说明目前的测序量是合理的,四川泡菜盐卤中的细菌群落多样性已经基本都能检测到。
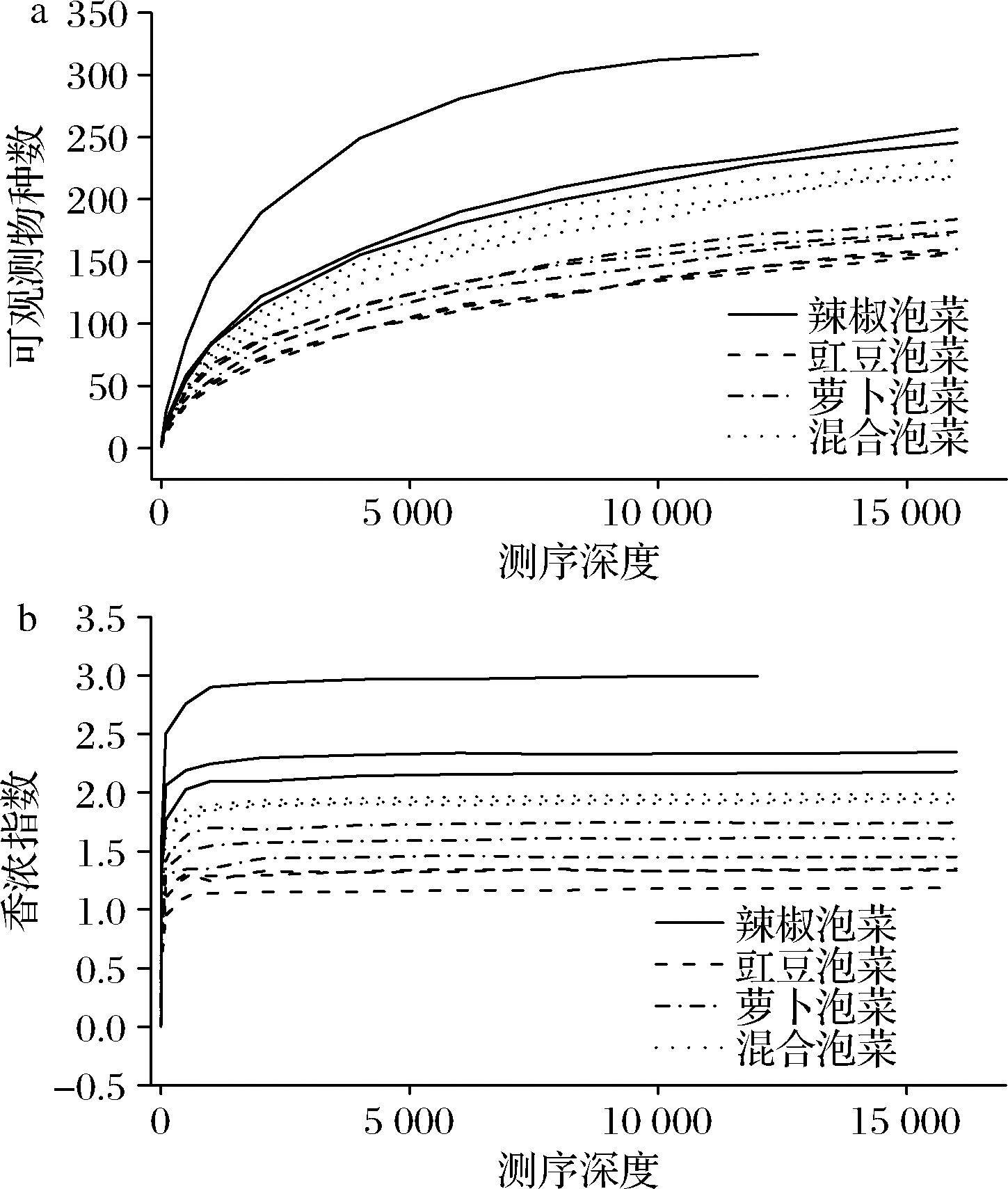
a-可观测物种数;b-香浓指数
图2 不同蔬菜种类四川泡菜盐卤中细菌菌群稀释曲线
Fig.2 Curves of bacterial populations of Sichuan Paocai brine samples with different vegetable species
2.3 不同蔬菜种类四川泡菜中细菌群落α多样性分析
对不同蔬菜种类四川泡菜中细菌物种数目进行α多样性分析,结果如表2所示。其中,Observed代表观测到的OTU数目,Chao1通常用于估计微生物群落的丰富度,Shannon通常用于估计微生物的多样性,Faith’s PD是α水平上常用的系统发育多样性度量方法。由表2可以看出,不同蔬菜种类的四川泡菜中微生物多样性有所不同,在α水平上辣椒泡菜与豇豆泡菜和萝卜泡菜具有显著差异(P>0.05),说明辣椒泡菜中微生物多样性最为丰富。混合泡菜的Chao1指数和Faith’s PD指数也同豇豆泡菜和萝卜泡菜有显著差异(P<0.05),而与辣椒泡菜无显著差异(P>0.05),究其原因可能是受辣椒原料影响所致。相较于辣椒泡菜和混合泡菜,豇豆泡菜和萝卜泡菜中的微生物多样性稍低。蔬菜种类不同,其组织结构和营养成分也有所差异,根据《中国食物成分表》可知[16],3种蔬菜中的营养物质含量各不相同,这些营养物质的差异导致了不同蔬菜种类四川泡菜中微生物生长的差异,因此在α水平上表现出了不同的微生物多样性。
表2 不同蔬菜种类四川泡菜中细菌群落的α多样性评估
Table 2 α Diversity of the bacterial community in Sichuan Paocai with different vegetable species
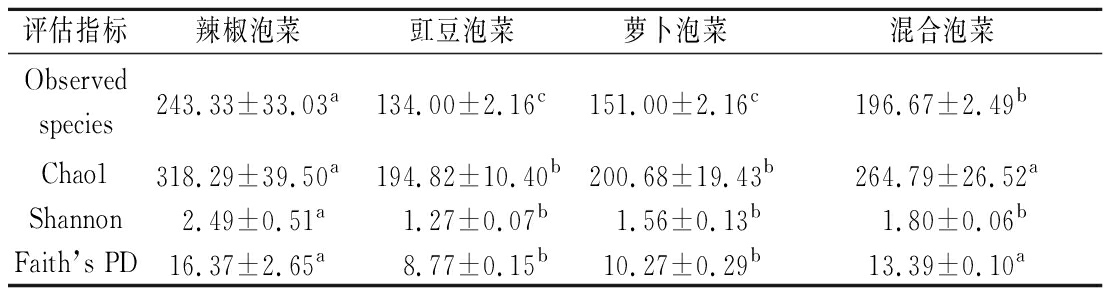
评估指标辣椒泡菜豇豆泡菜萝卜泡菜混合泡菜Observed species243.33±33.03a134.00±2.16c151.00±2.16c196.67±2.49bChao1318.29±39.50a194.82±10.40b200.68±19.43b264.79±26.52aShannon2.49±0.51a1.27±0.07b1.56±0.13b1.80±0.06bFaith’s PD16.37±2.65a8.77±0.15b10.27±0.29b13.39±0.10a
2.4 不同蔬菜种类四川泡菜中细菌群落β多样性分析
通过β分析可以分析不同蔬菜种类四川泡菜中微生物群落组成的差异性。从图3主成分分析(principal component analysis,PCA)结果可以看出,在第一主成分(PC1)上辣椒泡菜与豇豆泡菜和萝卜泡菜相距较远,说明辣椒泡菜中的微生物群落组成与其他2种泡菜中的微生物群落组成相差较大,但无论是从PC1还是PC2上分析,混合泡菜与其他3种泡菜都相距较近,说明混合泡菜中微生物菌落和其他3种泡菜中的微生物菌群都有交集,这主要是因为混合泡菜所用的蔬菜原料为其他3种泡菜原料所混合。由上述分析可知,四川泡菜的蔬菜原料种类对其微生物菌群结构有一定影响,不同蔬菜种类四川泡菜中的细菌菌群存在差异。

图3 不同蔬菜种类四川泡菜中细菌菌群PCA
Fig.3 Principal component analysis (PCA) results of bacterial communities in Sichuan Paocai with different vegetable species
2.5 不同蔬菜种类四川泡菜中细菌群落组成分析
为进一步明确不同蔬菜种类四川泡菜中细菌群落组成的差异,对微生物多样性数据进行分析,结果如图4-a所示。在门水平上,Firmicutes、Proteobacteria、Bacteroidetes是4种泡菜中主要的门(相对丰度>1%),图中每个散点代表1个样品,从样品的分散情况可知,同种门类在不同的泡菜中相对丰度存在差异。进一步分析图4-b可知,Firmicutes的相对丰度在4种泡菜中的占比均为最大,分别为65.61%(辣椒泡菜)、98.66%(豇豆泡菜)、91.99%(萝卜泡菜)、89.13%(混合泡菜);虽然Proteobacteria在4种泡菜中的相对丰度均位居第二,但它仅在辣椒泡菜中的相对丰度较高(30.70%),而其他3种泡菜中Proteobacteria的相对丰度均未超过10%;Bacteroidetes是辣椒泡菜和混合泡菜中主要的门,其相对丰度分别为3.37%和1.30%。
由图4-c可知,在属水平上,Lactobacillus、Pediococcus、unclassified Enterobacteriaceae、Lactococcus、Enterobacter是4种泡菜中主要的属,同一细菌属在不同蔬菜种类四川泡菜中的相对丰度略有差异。进一步分析图4-d可知,辣椒泡菜中相对丰度>1%的属数量最多,包括Lactobacillus(58.76%)、Pediococcus(2.46%)、unclassified Enterobacteriaceae(17.95%)、Lactococcus(1.63%)、Enterobacter(5.04%)、Pectobacterium(1.79%)、Citrobacter(0.84%)、Sphingomonas(0.76%)、Aeromonas(0.99%)9个属;豇豆泡菜中相对丰度>1%的属数量最少,仅有Lactobacillus(91.41%)、Pediococcus(5.26%)、unclassified Enterobacteriaceae(0.84%)3个属;萝卜泡菜中相对丰度>1%的属为Lactobacillus(82.68%)、Pediococcus(1.92%)、unclassified Enterobacteriaceae(6.02%)、Lactococcus(4.69%)、Enterobacter(0.83%)、unclassified Streptococcaceae(0.54%)等6个属;混合泡菜中相对丰度>1%的属为Lactobacillus(81.48%)、Pediococcus(2.98%)、unclassified Enterobacteriaceae(6.47%)、Lactococcus(1.59%)、Enterobacter(1.40%)、Fructobacillus(0.58%)等6个属。

a,b-门水平;c,d-属水平
图4 不同蔬菜种类四川泡菜中细菌群落结构分布
Fig.4 Distribution of bacterial community structure during fermentation of different vegetable species in Sichuan Paocai
综上,不同蔬菜原料四川泡菜中主要微生物的种类和数量都有所不同,辣椒泡菜中微生物种类最为丰富,豇豆泡菜中微生物种类最少,Lactobacillus是四川泡菜中的优势细菌属,这与CAO等[17]的研究结果一致。不同蔬菜种类四川泡菜的细菌结构中除相对丰度>1%的主要属外,也包括一些低丰度的细菌属,如:Weissella、Burkholderia、Cronobacter、Pantoea、Pseudomonas、Arthrobacter等,某些细菌属还是不同蔬菜种类四川泡菜的特有的细菌属,如Arthrobacter(0.01%)仅在豇豆泡菜检测到。有研究表明[18-19],细菌是影响风味形成的主要微生物,四川泡菜中的低丰度微生物与泡菜风味的形成有密切关系,不同蔬菜种类四川泡菜中微生物存在差异,导致了不同蔬菜种类四川泡菜在具有四川泡菜特有的鲜香味的同时也富含各自独有的风味。
2.6 四川泡菜中微生物与理化因子的相关性分析
CCA常用来分析微生物菌群与理化因子的关系[20-21],本研究采用此法分析不同蔬菜种类四川泡菜中属水平细菌菌群与理化因子(pH、亚硝酸盐、乳酸和醋酸含量)的关系。从图5可知,在第一主坐标上四川泡菜中属水平细菌菌群主要和乳酸正相关,和pH负相关,在第二主坐标上,四川泡菜中属水平细菌菌群主要和醋酸正相关,和亚硝酸盐负相关。进一步分析可知,不同蔬菜种类四川泡菜中属水平细菌菌群和理化因子的相关性不同,辣椒泡菜中属水平细菌菌群主要与pH具有极强的相关性(R2=0.97,P=0.000 5),豇豆泡菜中属水平细菌菌群主要和醋酸具有强相关性(R2=0.77,P=0.000 5),萝卜泡菜中属水平细菌菌群主要和乳酸具有强相关性(R2=0.70,P=0.000 5),混合泡菜中属水平细菌菌群和pH、乳酸、醋酸都有一定相关性,但亚硝酸盐和4种泡菜中属水平细菌菌群的相关性都较低。
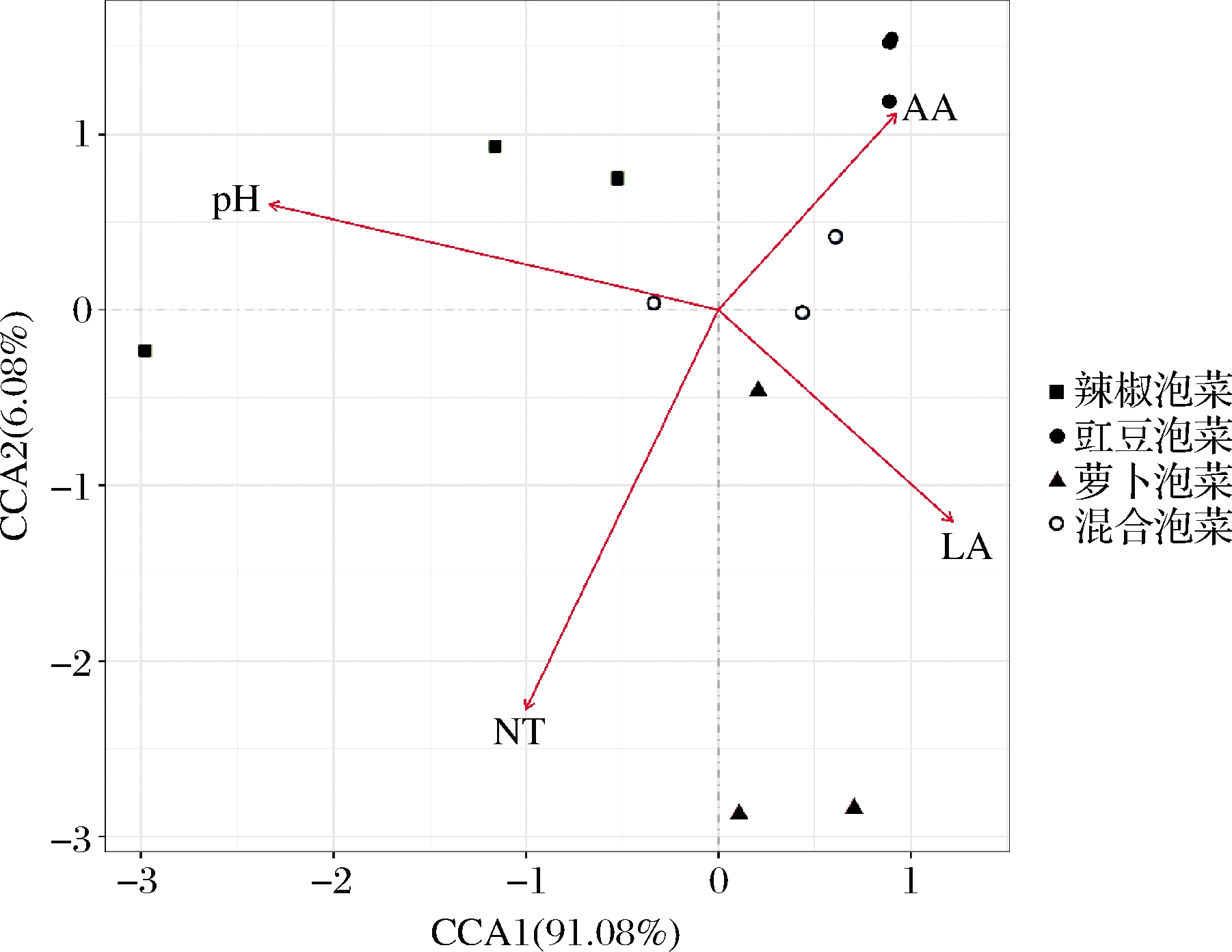
NT-亚硝酸盐;LA-乳酸;AA-醋酸
图5 细菌群落和理化因子间的CCA
Fig.5 CCA between bacterial and physicochemical factors
为进一步探究四川泡菜中细菌群落与理化因子的相关性,采用Spearman系数法分析四川泡菜中主要属水平微生物(相对丰度>1%)和pH、亚硝酸盐、乳酸以及醋酸的相关性,结果如图6所示。在11个被分析的主要细菌属中,共有9个细菌属与理化因子表现出了显著相关性(P<0.05),其中与pH呈负相关的细菌属有Lactobacillus(P<0.01),呈正相关的细菌属主要是unclassified Enterobacteriaceae、Enterobacter、Bacteroidales S24-7 group uncultured、Citrobacter、Sphingomonas、Aeromonas(P<0.01);与亚硝酸盐呈负相关的是Pediococcus(P<0.05),呈正相关的是Sphingomonas(P<0.05);与醋酸呈正相关的是Lactobacillus(P<0.05),呈负相关的是unclassified Enterobacteriaceae(P<0.05);仅有Fructobacillus与乳酸呈正相关(P<0.01)。

图6 四川泡菜中微生物与理化因子的相关性分析
Fig.6 Correlation analysis between microbial flora and physicochemical factors in Sichuan Paocai
Lactobacillus是4种泡菜中主要的细菌属,它能够产生大量有机酸降低四川泡菜的pH增加其酸度[22],本研究中Lactobacillus与pH呈负相关,与醋酸呈正相关,4种泡菜中Lactobacillus的相对丰度均在50%以上,说明Lactobacillus在四川泡菜发酵过程中占主导地位,是导致4种泡菜pH下降的主要细菌属。豇豆泡菜中Lactobacillus(91.41%)的相对丰度最高,在图5的分析结果中也显示豇豆泡菜中的微生物与醋酸具有强相关性。与pH呈正相关的6个细菌属均在辣椒泡菜中有检测到,其中unclassified Enterobacteriaceae、Enterobacter、Citrobacter、Sphingomonas和Aeromonas是辣椒泡菜中的主要细菌属,这些细菌属的存在导致了辣椒泡菜的pH为4种泡菜中最高(4.17±0.24),这与图5中辣椒泡菜属水平细菌菌群与pH具有强相关性结果一致。Enterobacter已被证明与泡菜中生物胺的产生有关[23],也有研究表明Enterobacter能够将发酵蔬菜中的乳酸转化成丙酸,导致发酵蔬菜的pH升高[24],因此,辣椒泡菜的pH较高可能与其细菌菌群中Enterobacter(5.04%)的相对丰度较高有密切关系。
3 结论
本研究通过高通量测序技术分析了不同蔬菜种类四川泡菜中微生物的多样性,并结合理化特性分析,探究了四川泡菜中微生物和理化因子间的相关性。本研究中,辣椒泡菜中的微生物多样性最为丰富,共检测到234个OTUs,其中Lactobacillus、Pediococcus、 unclassified Enterobacteriaceae、Lactococcus、Enterobacter、Pectobacterium、Citrobacter、Sphingomonas、Aeromonas为辣椒泡菜中的主要细菌属;豇豆泡菜中的微生物多样性最低,仅检测到134个OTUs,其主要细菌属仅有Lactobacillus、Pediococcus和unclassified Enterobacteriaceae;萝卜泡菜中共检测到151个OTUs,Lactobacillus、Pediococcus、unclassified Enterobacteriaceae、Lactococcus、Enterobacter和unclassified Streptococcaceae是萝卜泡菜中主要的细菌属;混合泡菜中共检测到196个OTUs,其中Lactobacillus、Pediococcus、unclassified Enterobacteriaceae、Lactococcus、Enterobacter和Fructobacillus是混合泡菜中的主要细菌属。
不同蔬菜种类四川泡菜中属水平细菌菌群和理化因子的相关性不同,辣椒泡菜中属水平细菌菌群主要与pH具有极强的相关性,豇豆泡菜中属水平细菌菌群主要和醋酸具有强相关性。在本研究中,Lactobacillus、Pediococcus和unclassified Enterobacteriaceae是4种泡菜共有的主要细菌属,其中,Lactobacillus与pH呈负相关,与醋酸呈正相关;Pediococcus与亚硝酸盐呈负相关;unclassified Enterobacteriaceae与pH呈正相关,与醋酸呈负相关。本研究明确了不同蔬菜种类四川泡菜中微生物多样性的差异,探究了四川泡菜中微生物和理化因子的相关性,这对指导四川泡菜工业化生产,丰富四川泡菜产品种类具有重要意义,同时也为四川泡菜产业的现代化升级提供理论基础。
[1] 刘蕾, 李娅琳, 聂蓉, 等.D-核糖及肉桂醛对四川泡菜菌群多样性和生物被膜的影响[J].食品科学, 2019, 40(22):53-61.
LIU L, LI Y L, NIE R, et al.Effects of D-ribose and cinnamaldehyde on microbial diversity of Sichuan pickle and biofilm formation of spoilage microorganisms isolated from it[J].Food Science, 2019,40(22):53-61.
[2] 陈功. 泡菜加工学[M].成都:四川科技出版社, 2018.
CHEN G.Paocai Processing[M].Chengdu:Sichuan Science and Technology Press, 2018.
[3] 厍晓, 钱杨, 李娅琳, 等.不同品种豇豆发酵过程中质构品质变化及产植物细胞壁降解酶微生物种类分析[J].食品工业科技, 2019, 40(2):1-7;12.
SHE X, QIAN Y, LI Y L, et al.Texture changes and plant cell wall degrading enzymes producing microorganism diversity in different varieties of cowpea during fermentation[J].Science and Technology of Food Industry, 2019, 40(2):1-7;12.
[4] 罗强,李幸洋,陈炼红,等.传统发酵泡菜中乳酸菌种群组成及优良菌株产酸耐酸特性分析[J].食品科学, 2021,42(2):158-163.
LUO Q, LI X Y, CHEN L H, et al.Composition of lactic acid bacteria in traditional Chinese pickles and analysis of acid production and acid tolerance characteristics of excellent strains[J].Food Science, 2021,42(2):158-163.
[5] WANG L, ZHANG X, LI Y, et al.The drivers of bacterial community underlying biogeographical pattern in mollisol area of China[J].Ecotoxicology and Environmental Safety, 2019, 177:93-99.
[6] LIANG H P, YIN L G, ZHANG Y H, et al.Dynamics and diversity of a microbial community during the fermentation of industrialized Qingcai paocai, a traditional Chinese fermented vegetable food, as assessed by Illumina MiSeq sequencing, DGGE and qPCR assay[J].Annals of Microbiology, 2018, 68(2):111-122.
[7] LIANG H P, HE Z, WANG X Y, et al.Effects of salt concentration on microbial diversity and volatile compounds during Suancai fermentation[J].Food Microbiology, 2020, 91:103537.
[8] HE Z, CHEN H Y, WANG X Y, et al.Effects of different temperatures on bacterial diversity and volatile flavor compounds during the fermentation of suancai, a traditional fermented vegetable food from northeastern China[J].LWT, 2020, 118:108773.
[9] RAO Y, QIAN Y, TAO Y F, et al.Characterization of the microbial communities and their correlations with chemical profiles in assorted vegetable Sichuan pickles[J].Food Control, 2020, 113:107174.
[10] XIAO Y S, XIONG T, PENG Z, et al.Correlation between microbiota and flavours in fermentation of Chinese Sichuan Paocai[J].Food Research International, 2018, 114:123-132.
[11] YANG J X, CAO J L, XU H Y, et al.Bacterial diversity and community structure in Chongqing radish Paocai brines revealed using PacBio single-molecule real-time sequencing technology[J].Journal of the Science of Food and Agriculture, 2018, 98(9):3 234-3 245.
[12] RAO Y, QIAN Y, SHE X, et al.Pellicle formation, microbial succession and lactic acid utilisation during the aerobic deteriorating process of Sichuan pickle[J].International Journal of Food Science & Technology, 2018, 53(3):767-775.
[13] DU R P, SONG G, ZHAO D, et al.Lactobacillus casei starter culture improves vitamin content, increases acidity and decreases nitrite concentration during sauerkraut fermentation[J].International Journal of Food Science & Technology, 2018, 53(8):1 925-1 931.
[14] TOMITA S, NAKAMURA T, OKADA S.NMR- and GC/MS-based metabolomic characterization of sunki, an unsalted fermented pickle of turnip leaves[J].Food Chemistry, 2018, 258:25-34.
[15] TANG Y Y, ZHOU X R, HUANG S L, et al.Microbial community analysis of different qualities of pickled radishes by Illumina MiSeq sequencing[J].Journal of Food Safety, 2019, 39(2):e12596.
[16] 杨月欣. 中国食物成分表第一册(第二版)[M].北京:北京大学医学出版社, 2010.
YANG Y X.China Food Composition[M].Beijing:Peking University Medical Press, 2010.
[17] CAO J L, YANG J X, HOU Q C, et al.Assessment of bacterial profiles in aged, home-made Sichuan Paocai brine with varying titratable acidity by PacBio SMRT sequencing technology[J].Food Control, 2017, 78:14-23.
[18] LIU L, SHE X, QIAN Y, et al.Effect of different fermenting containers on the deterioration of Sichuan pickle[J].LWT, 2019, 111:829-836.
[19] RAO Y, TAO Y F, CHEN X, et al.The characteristics and correlation of the microbial communities and flavors in traditionally pickled radishes[J].LWT, 2020, 118:108804.
[20] GUAN Q Q, ZHENG W D, HUANG T, et al.Comparison of microbial communities and physiochemical characteristics of two traditionally fermented vegetables[J].Food Research International, 2020, 128:108755.
[21] LIU Z G, PENG Z, HUANG T, et al.Comparison of bacterial diversity in traditionally homemade Paocai and Chinese spicy cabbage[J].Food Microbiology, 2019, 83:141-149.
[22] LIANG H P, CHEN H Y, ZHANG W X, et al.Investigation on microbial diversity of industrial Zhacai Paocai during fermentation using high-throughput sequencing and their functional characterization[J].LWT, 2018, 91:460-466.
[23] 唐小曼, 唐垚, 张其圣, 等.四川工业泡豇豆主要生物胺的形成及降解分析[J].食品与发酵工业, 2019, 45(21):86-92.
TANG X M, TANG Y, ZHANG Q S, et al.Formation and degradation analysis of main biogenic amines in Sichuan industrial pickled cowpea[J].Food and Fermentation Industries, 2019, 45(21):86-92.
[24] ANTONIO B, MARIA R C, MILENA S.The Microbiological Quality of Food[M].Cambridge:Woodhead Publishing, 2017.