食品安全在全世界引起了越来越多的关注[1]。食源性疾病大多由食用了被15种致病菌污染的食物引起的[2]。其中,Escherichia coli O157∶H7是一种主要的食源性致病菌,常导致溶血性尿毒症综合征、血性腹泻等严重疾病,甚至导致死亡[3],特别是在不发达国家和地区[4]。感染极低剂量的活E.coli O157∶H7即可引起疾病并进一步引发疫情[5-7],对其快速、灵敏的检测方法有助于临床管理和预防传播。
现已发展了多种检测E.coli O157∶H7的方法,经典标准检测方法是琼脂平板培养法[8-9],该法简单可靠,但耗时长,可能延误患者治疗的时机和疫情的控制[10]。聚合酶链式反应因时间短、灵敏度高而被国家食品安全标准推荐,但往往需要训练有素的技术人员和复杂的DNA提取程序[11]。酶联免疫吸附试验具有快速检测和高通量的特点,但缺乏足够的灵敏度,检测限为104 CFU/mL[11-12]。电化学发光和表面等离子体共振也被用于病原体检测[13-14]。YU等[15]提出了一种检测E.coli O157∶H7的石英晶体微天平传感器,在50 min内可检测到低至1.46×103 CFU/mL的E.coli O157∶H7,灵敏度高,但整个过程步骤繁多。上述方法均难以满足E.coli O157∶H7现场检测的要求。因此,开发一种简单、灵敏、快速的细菌检测方法对保证食品安全有着至关重要的作用。
量子点又称纳米晶体,是粒子尺寸小于或接近激子玻尔半径的纳米晶体粒子,在被激发时能产生荧光发射。它们通常由第II-VI组、第III-V组或第IV-VI组元素组成。量子点具有斯托克斯位移大、激发光谱宽、发射光谱窄、光学稳定性好、量子产率高、发射波长可调等独特的光学特性[16-17],在食源性致病菌检测中具有很大的应用潜力[18]。免疫磁分离技术具有简单、快速、特异性强的优点[19]。
本研究建立了一种基于免疫磁珠富集和量子点发光的便捷、灵敏检测样品中E.coli O157∶H7的荧光免疫分析法。首先使用SiO2、羧基和E.coli O157∶H7抗体依次包覆Fe3O4纳米颗粒制得的免疫磁珠对样品中的E.coli O157∶H7进行富集,然后使用由量子点标记过的抗体,即荧光探针与E.coli O157∶H7结合,磁分离后,使用荧光光谱仪测定其发光强度,从而得到样品中E.coli O157∶H7的浓度。将SiO2包覆在磁珠表面,可以减少其非特异性吸附,从而提高对目标菌的选择性并且有效的阻止了三明治结构中量子点因电子转移至Fe3O4而引起的荧光猝灭,为分析方法的可行性提供了保证。
1 材料与方法
1.1 仪器与试剂
Pure扫描电子显微镜,荷兰Phenom公司;透射电子显微镜,荷兰Philips公司;Nicolet IS5傅立叶红外光谱仪,美国Thermo Fisher公司;荧光光谱光度计,日本Hitachi High-Tech公司。
乙酸钠、乙二醇、FeCl3·6H2O(生化试剂),上海生工有限公司;聚乙二醇2000(气相色谱)、正硅酸乙酯(分析纯)、异丙醇、油酸(分析纯),麦克林有限公司;二乙二醇(气相色谱)、1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐[1-ethyl-3-(3-dimethylaminopropyl) carbodiimide,EDC],阿拉丁有限公司;氨水(分析纯)、无水乙醇(>99.5%),西陇科学股份有限公司;N-羟基丁二酰亚胺(N-hydroxy succinimide,NHS),美国Aldrich公司;LB肉汤(生物试剂),海博生物计数有限公司;量子点,苏州星烁纳米科技有限公司;大肠杆菌O157∶H7 CICC 21530,广东省微生物菌种保藏中心;大肠杆菌O157∶H7抗体,武汉华美生物工程有限公司。
1.2 E.coli O157∶H7的培养
将细菌培养物储存在-20 ℃的甘油中,然后在LB肉汤中37 ℃过夜培养进行激活。取上述菌液100 μL加入到40 mL LB肉汤培养基中,37 ℃,160 r/min,摇匀2.5 h,去除培养基后,用无菌PBS连续10倍稀释使最终浓度为1.0×101~1.0×108 CFU/mL。将100 μL的稀释液涂布于LB琼脂平板表面上,37 ℃培养22~24 h,计数可见菌落。
1.3 免疫磁珠Fe3O4@SiO2@Ab1的制备
以FeCl3·6H2O为铁源,无水乙酸钠为沉淀剂,聚乙二醇2000为表面活性剂,在还原剂乙二醇和二乙二醇的混合溶液中,200 ℃反应12 h,制备了单分散性良好、粒径均一的Fe3O4纳米粒子。
将1.0 g粒径200 nm的Fe3O4分散在20 mL去离子水中,分散均匀后加入4 mL氨水(质量分数为32%)和120 mL异丙醇溶液。超声混匀25 min后,用分液漏斗将20 mL异丙醇和4 mL正硅酸乙酯的混合溶液逐滴加入到混合物中,调整水浴锅温度为35 ℃,氮气保护下连续搅拌20 h。待结束反应后,磁分离回收Fe3O4@SiO2,经过多次去离子水和乙醇洗涤后,真空干燥,储存备用[20]。
将100 mg的Fe3O4@SiO2分散在4 mL去离子水中,分散均匀后加入12 mL氨水和4 mL油酸。70 ℃反应1 h,使用无水乙醇清洗3次后,磁分离回收,随后加入30 mL 0.02 mol/L的KMnO4,快速机械搅拌8 h,磁分离,经过多次去离子水和乙醇洗涤后,真空干燥,储存备用[21]。
随后使用EDC和NHS对Fe3O4@SiO2上的羧基进行活化,加入E.coli O157∶H7的抗体,37 ℃空气浴振荡5 h制得免疫磁珠Fe3O4@SiO2@Ab1,合成路线如图1-a所示。
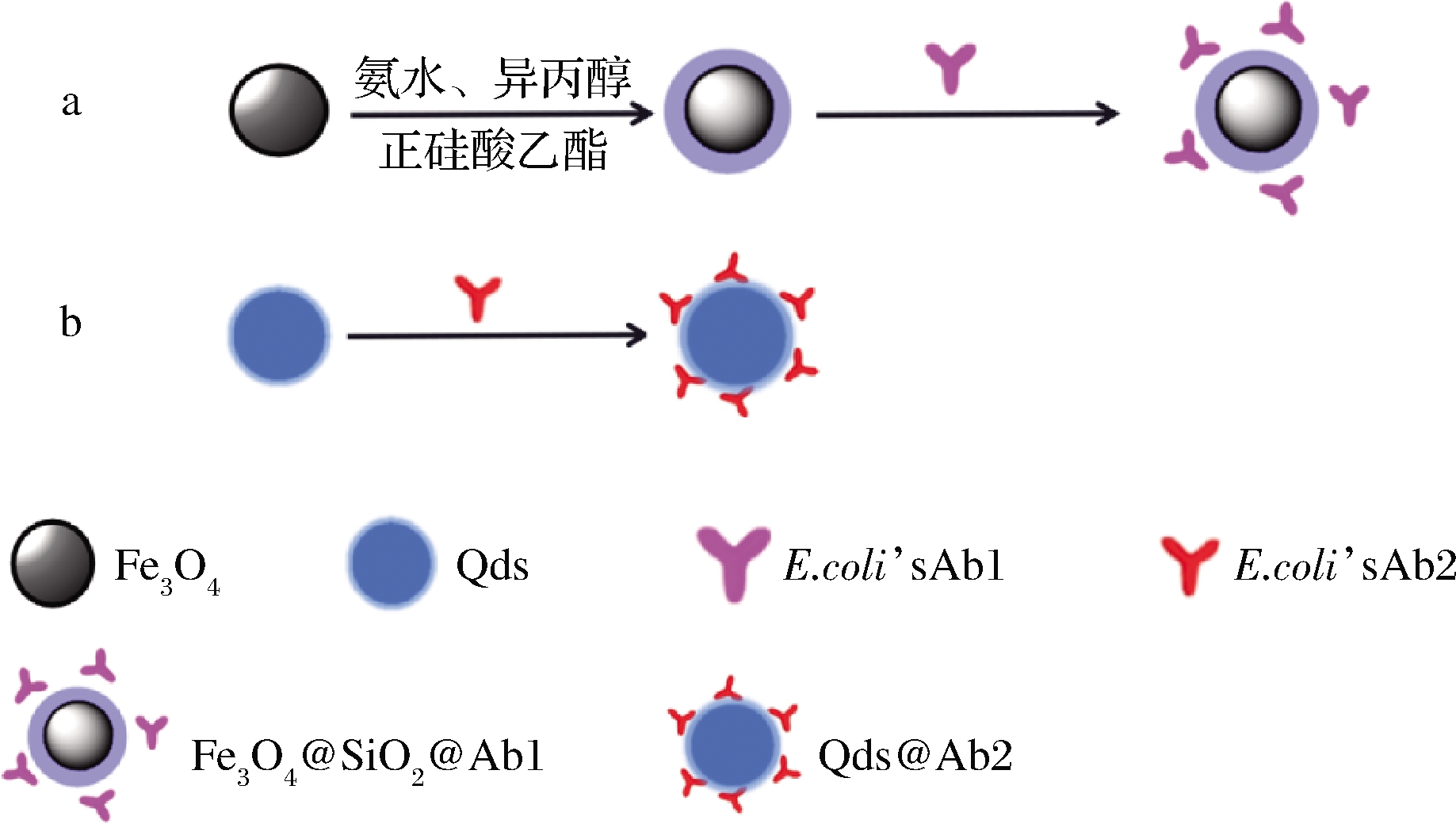
a-Fe3O4@SiO2@Ab1;b-Qds@Ab2
图1 Fe3O4@SiO2@Ab1和Qds@Ab2的合成路径图
Fig.1 Synthetic route of Fe3O4@SiO2@Ab1 and Qds@Ab2
使用扫描电子显微镜(scanning electron microscope, SEM)观察免疫磁珠形貌;采用溴化钾颗粒技术,在傅里叶光谱仪上获得免疫磁珠表面官能团性质;采用SEM对样品在10 kV加速电压下的形貌进行了表征;利用透射电镜(transmission electron microscopy, TEM)获得了纳米粒子的尺寸和结构细节,将纳米粒子悬浮液滴在碳涂层铜网格上,制得透射电镜样品。
1.4 荧光探针Qds@Ab2的制备
将量子点与E.coli O157∶H7的抗体置于室温下空气浴振荡30 min得到荧光探针Qds@Ab2,合成路线图如图1-b所示。
1.5 E.coli O157∶H7免疫捕获条件的优化
应用Miscellaneous设计和响应面方法,研究在105 CFU/mL的菌液浓度中免疫磁珠添加量、荧光探针添加量、孵育时间和磁分离时间4个自变量对E.coli O157∶H7的影响,因素和水平如表1所示。使用Design-Expert V8.0.6.1软件设计方案,建立回归模型,通过计算得到应用于实际样品时满足检测要求的最优组合。
表1 免疫磁分离体系检测E.coli O157∶H7荧光强度的试验因素水平表
Table 1 Factors and levels for fluorescence intensity of E.coli O157∶H7 by immunomagnetic separation system
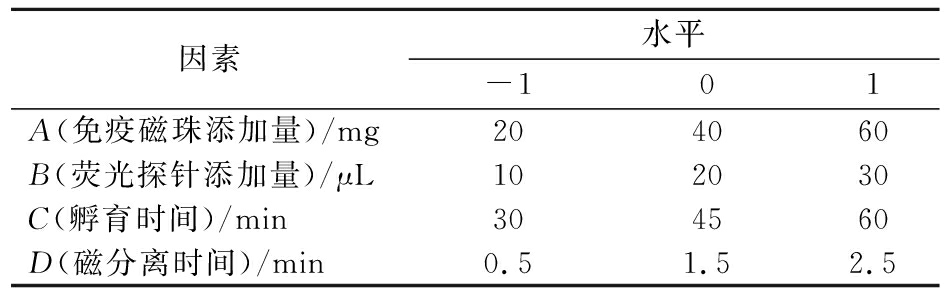
因素水平-101A(免疫磁珠添加量)/mg204060B(荧光探针添加量)/μL102030C(孵育时间)/min304560D(磁分离时间)/min0.51.52.5
1.6 E.coli O157∶H7的检测
在优化条件下,在离心管中分别加入40 μL免疫磁珠、100 μL菌液,37 ℃下孵育45 min,磁分离,使用PBS清洗3次后定容到100 μL;随后添加20 μL抗体-量子点复合物,室温下摇床反应30 min,反应完毕后,磁分离,并用100 μL PBS定容。如图2所示,游离的E.coli O157∶H7首先与免疫磁珠结合,然后由量子点标记的抗体与E.coli O157∶H7结合,形成一个三明治结构最后将“免疫纳米磁珠-菌-免疫量子点”复合物进行荧光检测。
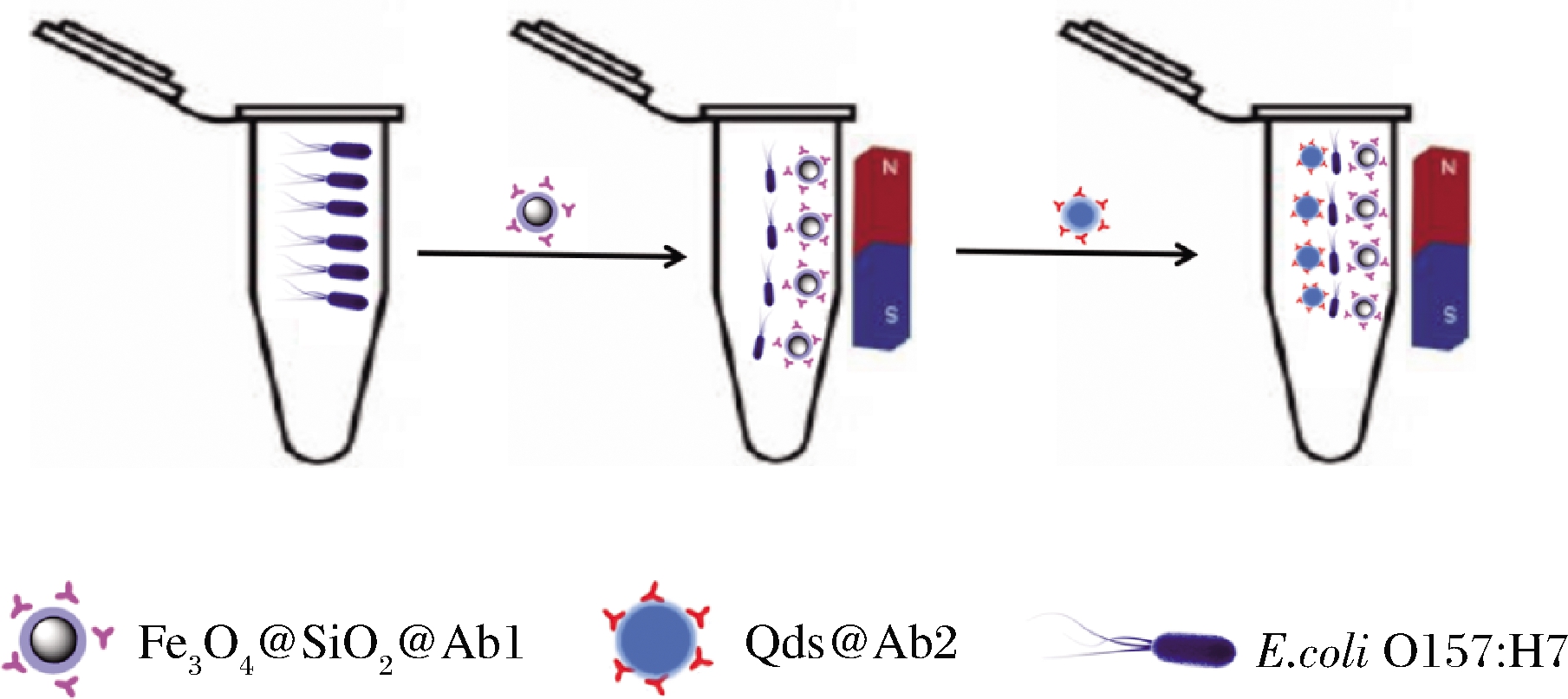
图2 反应原理图
Fig.2 Overall working principle of the approach
选择与E.coli O157∶H7相近的沙门氏菌、金黄色葡萄球菌、单增李斯特氏菌、阪崎肠杆菌和痢疾志贺氏菌等食源性致病菌对模型的特异性进行检测。
在1 g牛肉样品中加入1 mL一定浓度的菌液,等其自然风干后,在其中加入2 mL体积分数为3%三氯乙酸、7 mL PBS,涡旋后8 000 r/min离心10 min;取1 mL含有一定浓度菌液的牛奶、蜂蜜,在其中加入2 mL体积分数为3%三氯乙酸、7 mL PBS,混合均匀后在5 000 r/min离心10 min。将沉淀弃去,分别在上清液中加入1 mol/L NaOH调节pH至7.0,定容后用pH为7.4的PBS稀释上清液5~10倍,制备菌液终浓度为0~108 CFU/mL的加标牛肉、牛奶、蜂蜜样品。最后根据上述所提出的免疫磁分离体系对添加的样品进行检测。
2 结果与分析
2.1 免疫磁珠的表征
2.1.1 红外光谱表征
利用傅里叶变换红外光谱(Fourier-transform infrared spectroscopy,FT-IR)对Fe3O4、Fe3O4@SiO2和Fe3O4@SiO2@Ab1的结构进行了确证。如图3所示,Fe3O4纳米颗粒中589.14 cm-1处的峰归因于Fe—O官能团的振动[22]。包覆SiO2后,出现在1 077.0、945.91 cm-1处的SiO2主峰分别为Si—O—Si的拉伸振动和弯曲振动[23]。802.24 cm-1是Si—O单键的对称应力峰值。因此,将Fe3O4和Fe3O4@SiO2的FT-IR进行比较,可以认为Fe3O4@SiO2合成成功了。在Fe3O4@SiO2@Ab1纳米颗粒中,1 638.23 cm-1处的峰值被认为是C![]() O的振动。通过对Fe3O4@SiO2和Fe3O4@SiO2@Ab1的红外光谱的比较,抗体成功地附着在Fe3O4@SiO2上。
O的振动。通过对Fe3O4@SiO2和Fe3O4@SiO2@Ab1的红外光谱的比较,抗体成功地附着在Fe3O4@SiO2上。
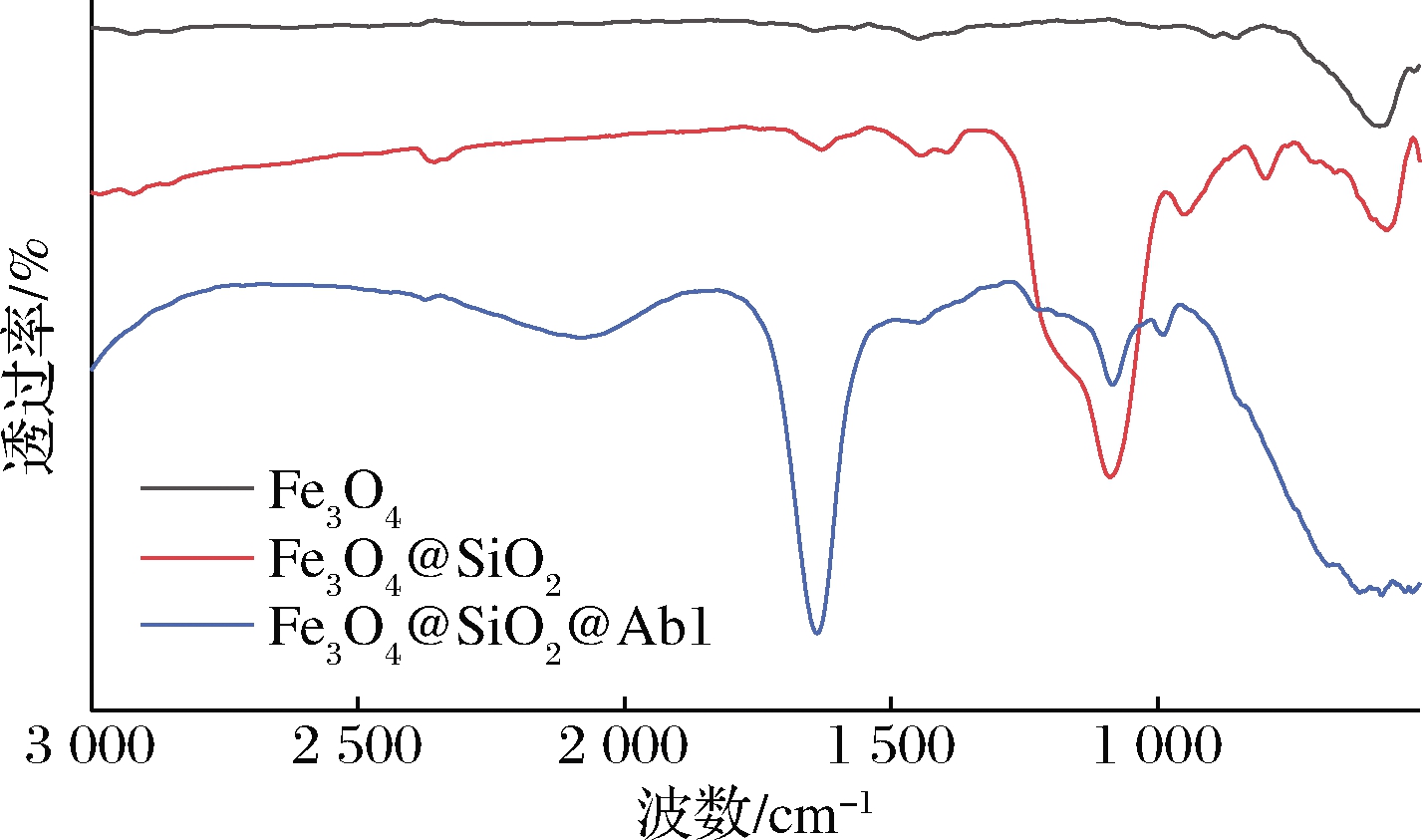
图3 Fe3O4、Fe3O4@SiO2和Fe3O4@SiO2@Ab1的红外光谱
Fig.3 FT-IR spectrogram of Fe3O4 particles, Fe3O4@SiO2and Fe3O4@SiO2@Ab1
2.1.2 SEM表征
如图4所示,对比Fe3O4和Fe3O4@SiO2的SEM图像,Fe3O4尺寸较小,表面粗糙(图4-a)。从图4-b可知,SiO2包覆Fe3O4后,颗粒团聚减少,表面光滑。结果表明,SiO2几乎均匀的分布在Fe3O4表面上。

a-Fe3O4;b-Fe3O4@SiO2
图4 Fe3O4和 Fe3O4@SiO2的SEM表征图
Fig.4 SEM graphs of Fe3O4 and Fe3O4@SiO2
2.1.3 TEM表征
如图5所示,Fe3O4纳米颗粒由许多纳米晶簇形成[24],形状为球形,表面粗糙,粒径约为200 nm,分散性均一性较好(图5-a)。SiO2包覆在Fe3O4颗粒表面之后,Fe3O4@SiO2的粒径增加至576 nm,SiO2的壳层厚度在376 nm左右(图5-b),与Fe3O4纳米粒子相比,Fe3O4@SiO2表面变为光滑的球形结构,可有效防止Fe3O4在空气中氧化。其次,SiO2层的引入增加了材料的生物相容性[25],同时也可以阻断Fe3O4上的电子转移,减少由于电子转移造成的量子点荧光猝灭。

a-Fe3O4;b-Fe3O4@SiO2
图5 Fe3O4和Fe3O4@SiO2的TEM表征图
Fig.5 TEM images Fe3O4, Fe3O4@SiO2
2.2 E.coli O157∶H7免疫捕获条件的优化
按照1.6节的实验方法,依照实验因素水平表1进行27次试验,以回收率为指标,各因素组合下E.coli O157∶H7回收率的结果如表2所示。
表2 E.coli O157∶H7试验设计方案与结果
Table 2 Miscellaneous test design scheme and results of E.coli O157∶H7
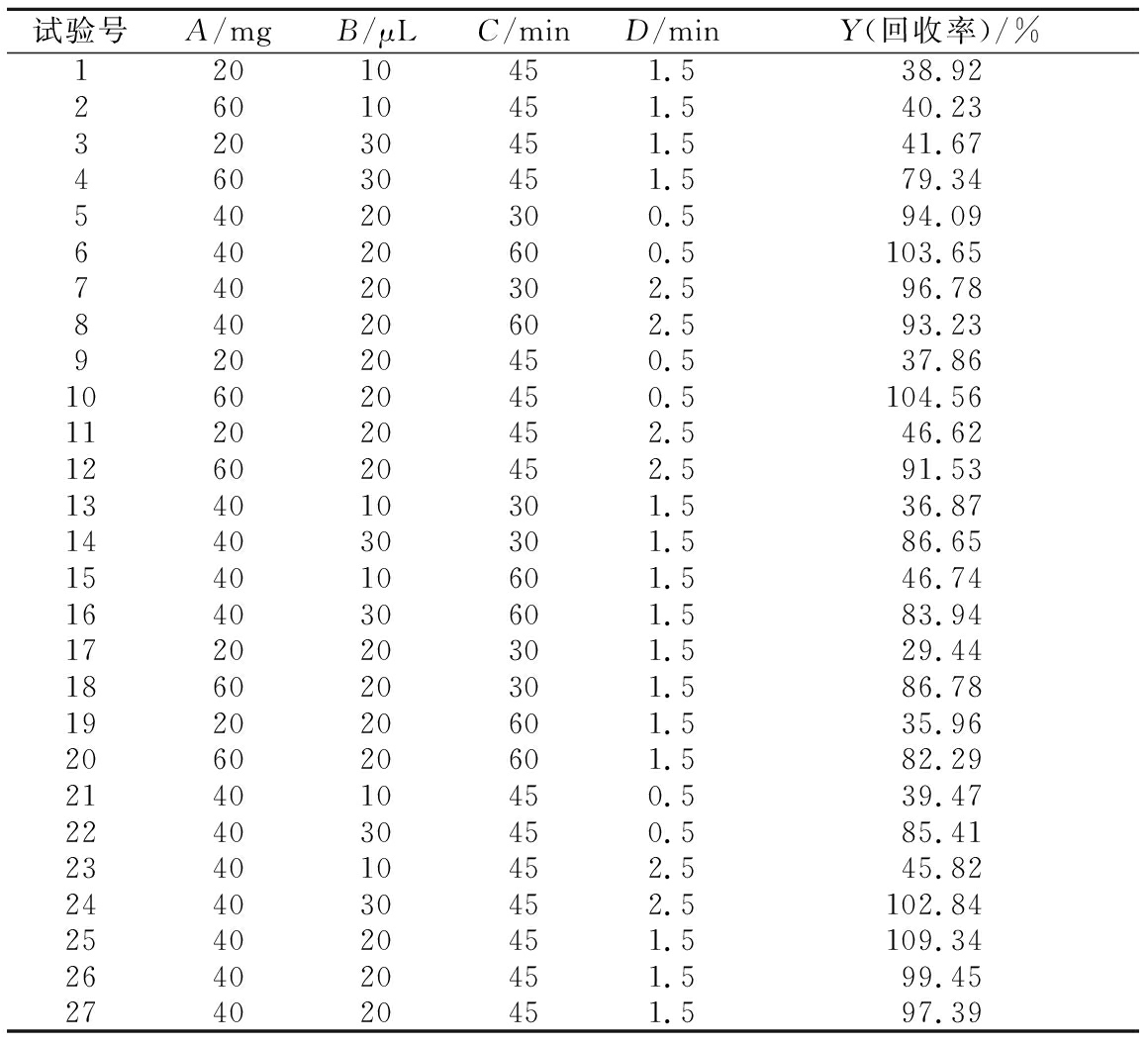
试验号A/mgB/μLC/minD/minY(回收率)/%12010451.538.9226010451.540.2332030451.541.6746030451.579.3454020300.594.0964020600.5103.6574020302.596.7884020602.593.2392020450.537.86106020450.5104.56112020452.546.62126020452.591.53134010301.536.87144030301.586.65154010601.546.74164030601.583.94172020301.529.44186020301.586.78192020601.535.96206020601.582.29214010450.539.47224030450.585.41234010452.545.82244030452.5102.84254020451.5109.34264020451.599.45274020451.597.39
(1)回归方程及方差分析
以回收率为响应值,各因素之间的关系建立的二次回归方程如下:
Y=102.06+21.19A+19.32B+1.27C+0.98D+9.09AB-2.75AC-5.45AD-3.15BC+2.77BD-3.28CD-29.58A2- 27.99B2-9.42C2-1.24D2
式中:Y,回收率;A,免疫磁珠添加量;B,荧光探针添加量;C,孵育时间;D,磁分离时间。
方差分析(表3)表明得到的回归方程极显著,模型的F值为8.06,模型P<0.05,表明模型具有统计学意义。Y的相关系数R2=0.903 8,表明实测值与预测值吻合较好。拟合损失值为0.373 2,>0.05,不存在拟合损失因子。因此,该模型可用于分析各种因素对免疫磁分离体系检测细菌的影响,优化和预测满足检测条件的最佳条件。
表3 响应面实验结果的方差分析
Table 3 Variance analysis of response surface experiments results
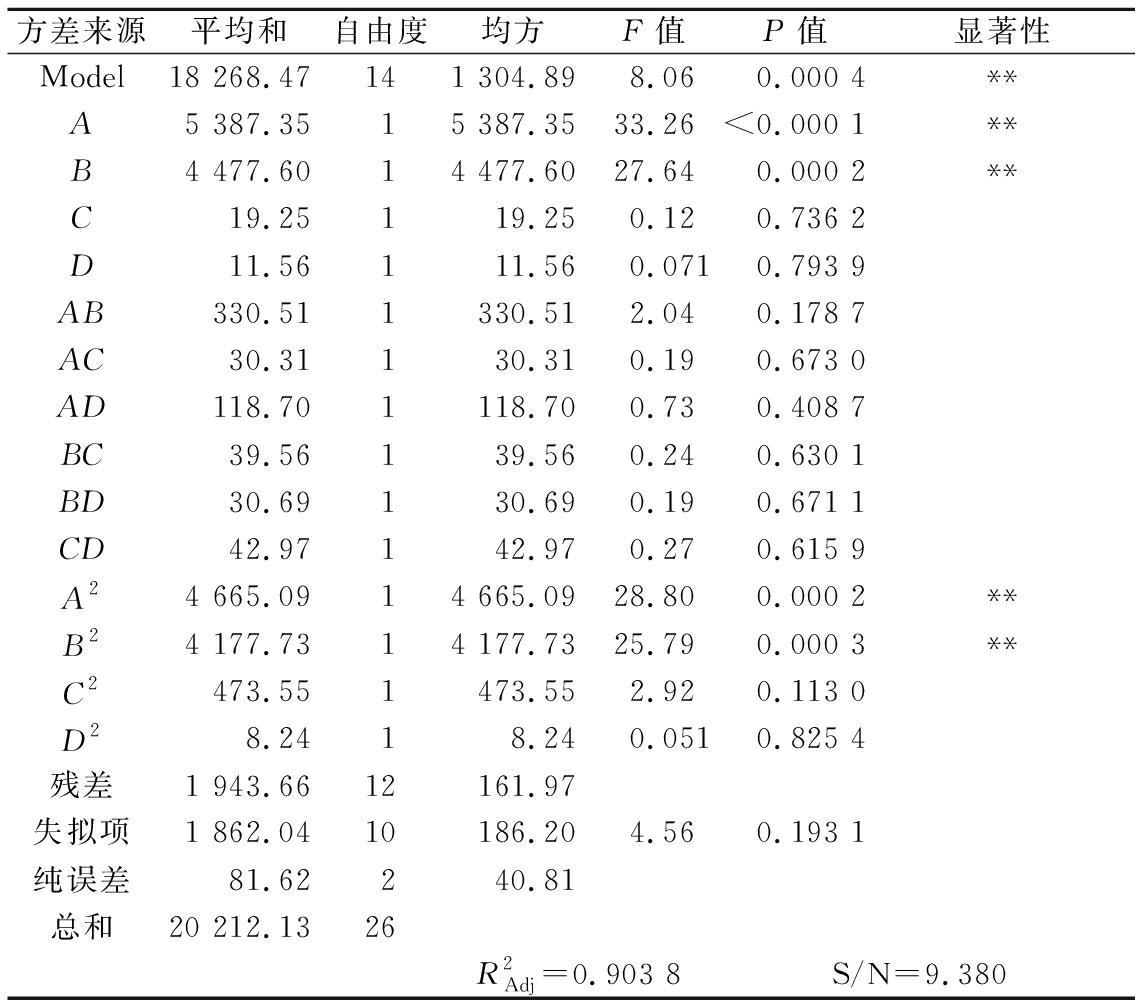
方差来源平均和自由度均方F值P值显著性Model18 268.47141 304.898.06 0.000 4**A5 387.3515 387.3533.26<0.000 1**B4 477.6014 477.6027.640.000 2**C19.25119.250.120.736 2D11.56111.560.0710.793 9AB330.511330.512.040.178 7AC30.31130.310.190.673 0AD118.701118.700.730.408 7BC39.56139.560.240.630 1BD30.69130.690.190.671 1CD42.97142.970.270.615 9A24 665.0914 665.0928.800.000 2**B24 177.7314 177.7325.790.000 3**C2473.551473.552.920.113 0D28.2418.240.0510.825 4残差1 943.6612161.97失拟项1 862.0410186.204.560.193 1纯误差81.62240.81总和20 212.1326R2Adj=0.903 8S/N=9.380
注:*,对结果影响显著(P<0.05);**,对结果极显著影响(P<0.01)
(2)各因素交互作用分析
回归方程模拟了4个因素对免疫磁分离体系检测E.coli O157∶H7回收率的影响,如图6所示,通过三维响应面图的分析,可以更直观地发现不同变量对免疫磁分离体系检测到的回收率的影响,表面高度越高、颜色越深,回收率越好。故免疫磁分离体系的最优条件为免疫磁珠添加量40 mg、荧光探针添加量20 μL、孵育时间45 min、磁分离时间1.5 min。

图6 免疫磁分离体系检测细菌响应面图
Fig.6 Response surface diagram of bacteria detected by immunomagnetic separation system
(3)实验验证
为使E.coli O157∶H7的回收率在80%~120%,目标值接近100%,利用本模型得出免疫磁珠最佳添加量为40 mg、荧光探针最佳添加量为20 μL。为了验证本模型预测值的准确性,进行回归模型的验证实验,进行3次平行实验,取平均值。实际测得E.coli O157∶H7的回收率为97%,与预测结果接近,说明优化结果可信,有实际指导作用。
2.3 E.coli O157∶H7的检测
细菌样品中472 nm处的荧光强度(fluorescence intensity,FI)与E.coli细胞数(N)的关系如图7所示。
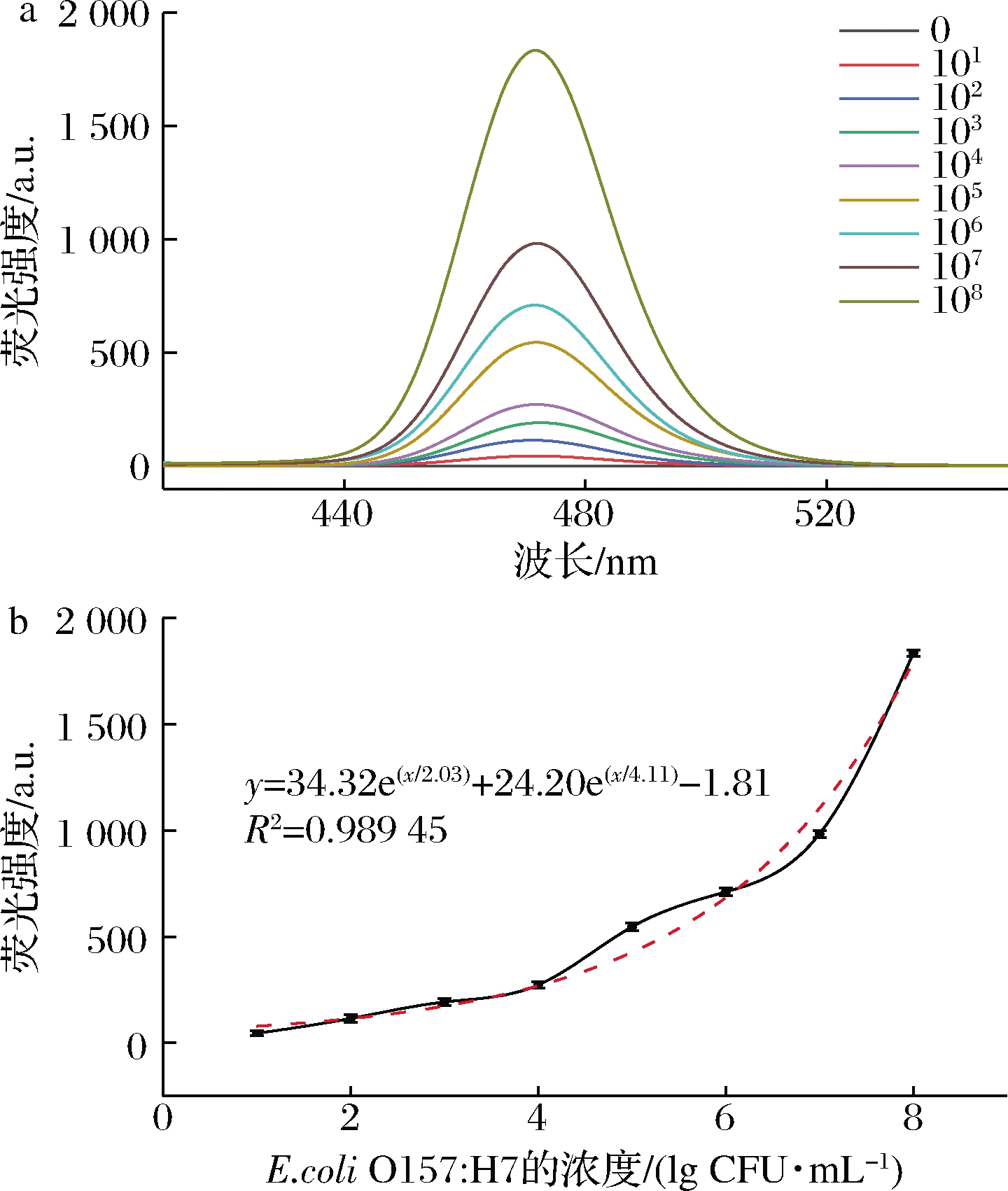
a-不同菌液浓度的荧光强度;b-标准曲线
图7 E.coli O157∶H7在472 nm处的荧光检测
Fig.7 The intensities of fluorescence peaks at 472 nm as functions of the concentrations of E.coli O157∶H7
细胞数在10~108 CFU/mL范围内时,E.coli O157∶H7的回归模型为:FI=34.32e(lgN/2.03)+24.20e(lgN/4.11)-1.81,R2=0.989 45。这些结果表明,通过测量472 nm处的荧光强度可以确定E.coli O157∶H7的细菌数量,检测可在2 h内完成且检测范围为10~108 CFU/mL,检出限为10 CFU/mL。
将免疫磁珠分别加入104 CFU/mL的E.coli O157∶H7、沙门氏菌、金黄色葡萄球菌、单增李斯特氏菌、阪崎肠杆菌和痢疾志贺氏菌中,在优化条件下根据1.6所提出的模型对添加的样品进行检测。回收率如图8所示,该免疫磁分离体系对E.coli O157∶H7有很好的选择性。
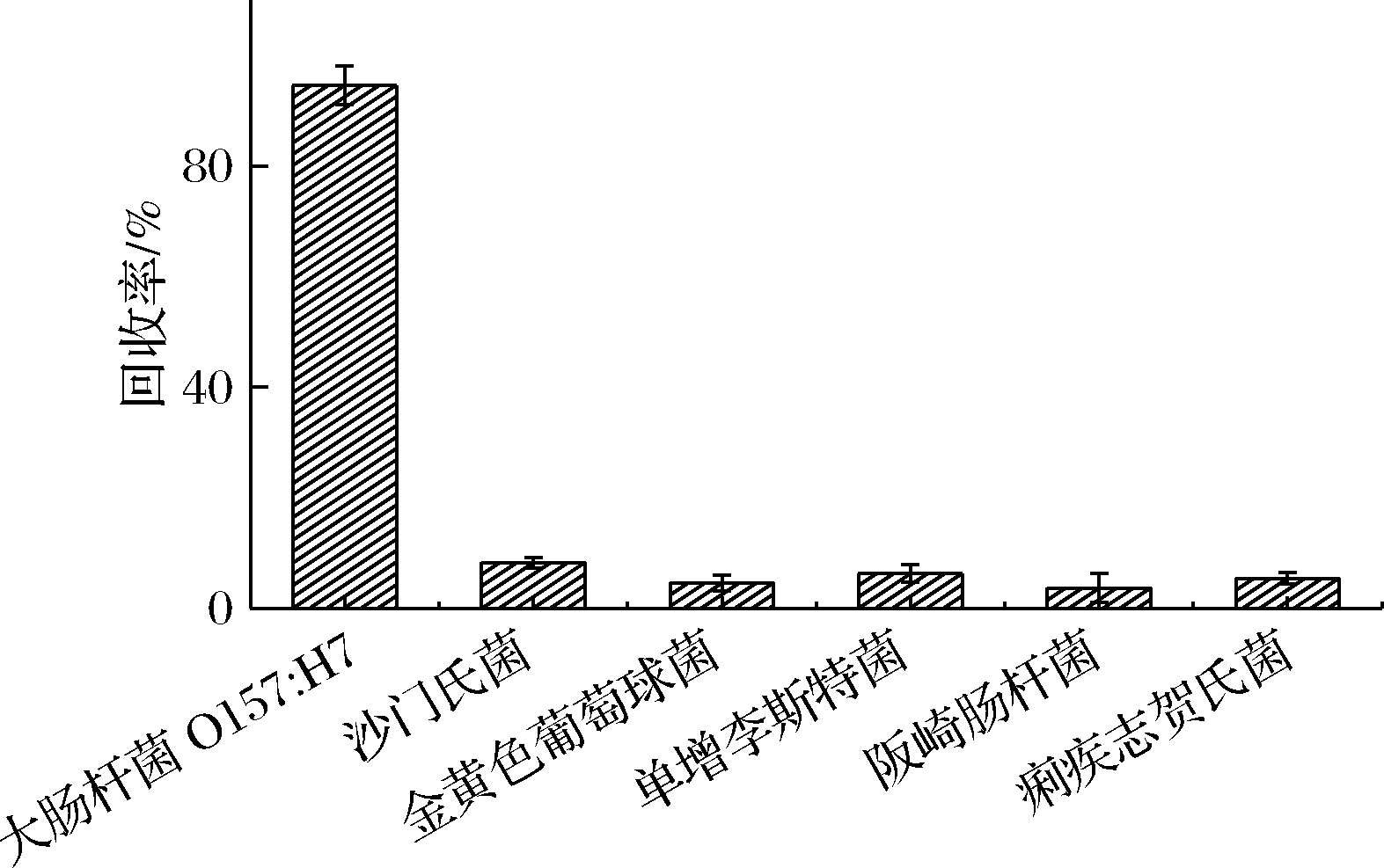
图8 免疫磁分离体系对E.coli O157∶H7的特异性
Fig.8 Specificity of immunomagnetic separation system for E.coli O157∶H7
实际样品中,该免疫磁分离体系对E.coli O157∶H7的回收率见表4,分别为80%~120%,相对标准差(relative standard deviation,RSD)值均不高于7.8%。
表4 Fe3O4@SiO2@Ab1对食品样品中添加的E.coli O157∶H7的回收率
Table 4 Recovery efficiency of E.coli O157∶H7 spiked in food samples by the Fe3O4@SiO2@Ab1
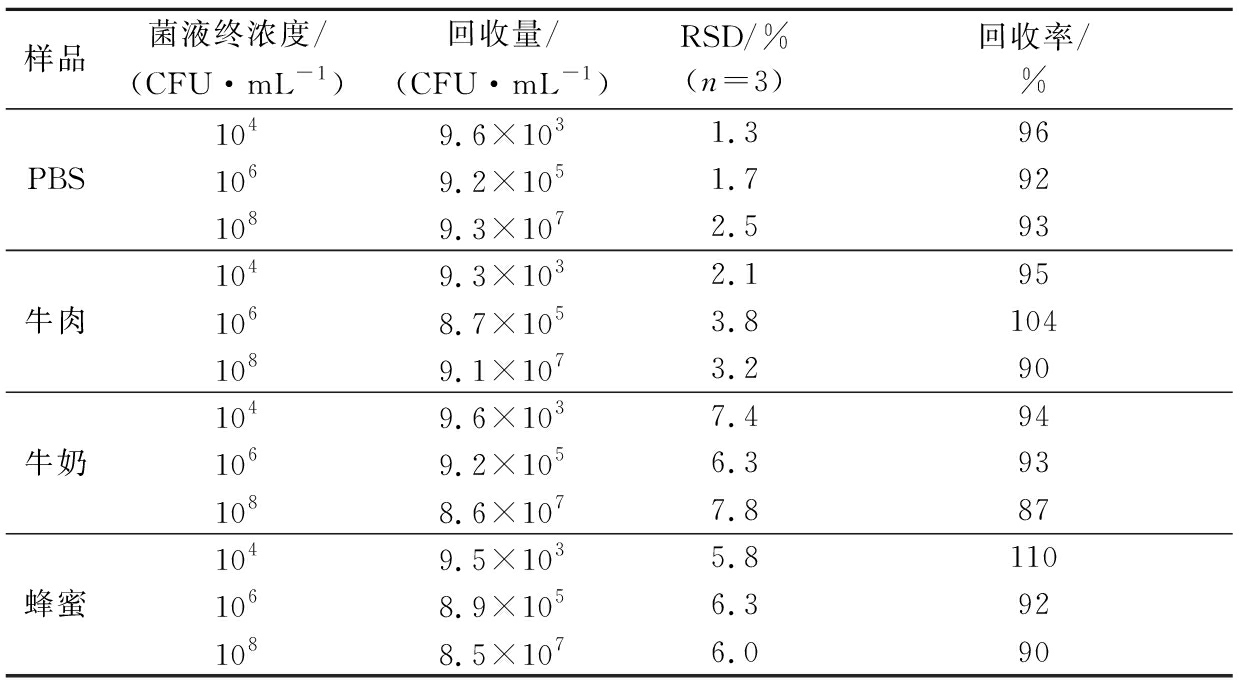
样品菌液终浓度/(CFU·mL-1)回收量/(CFU·mL-1) RSD/%(n=3)回收率/%PBS1049.6×1031.3961069.2×1051.7921089.3×1072.593牛肉1049.3×1032.1951068.7×1053.81041089.1×1073.290牛奶1049.6×1037.4941069.2×1056.3931088.6×1077.887蜂蜜1049.5×1035.81101068.9×1056.3921088.5×1076.090
3 结论
本文建立了免疫磁珠和荧光量子点标记的抗体检测E.coli O157∶H7的方法。采用溶剂热法制备了Fe3O4纳米颗粒,并用SiO2、羧基和E.coli O157∶H7抗体依次包覆制得免疫磁珠。游离的E.coli O157∶H7首先与免疫磁珠结合,然后由量子点标记的抗体与E.coli O157∶H7结合,形成一个三明治结构;随后分析磁分离采集的磁珠的荧光强度(激发/发射波长为370 nm/472 nm)。在引入SiO2壳层后,能减少传统免疫磁珠的非特异性吸附,从而提高对目标菌的选择性,SiO2的壳结构能有效地阻止量子点因电子转移至Fe3O4而引起的荧光猝灭。动态范围为10~108 CFU/mL,检出限为10 CFU/mL。牛肉、牛奶和蜂蜜样品中E.coli O157∶H7的平均加样回收率分别为95%~104%、90%~94%、90%~110%;RSD分别为2.1%~3.8%、3.2%~7.8%、5.8%~6.3%。该方法缩短了传统方法的检测时间,提高了检测效率。
[1] KING T, COLE M, FARBER J M, et al.Food safety for food security:Relationship between global megatrends and developments in food safety[J].Trends in Food Science & Technology, 2017, 68:160-175.
[2] CHEN J, PARK B.Label-free screening of foodborne Salmonella using surface plasmon resonance imaging[J].Analytical and Bioanalytical Chemistry, 2018, 410(22):5 455-5 464.
[3] JIANG T, SONG Y, WEI T X, et al.Sensitive detection of Escherichia coli O157:H7 using Pt-Au bimetal nanoparticles with peroxidase-like amplification[J].Biosensors and Bioelectronics, 2016, 77:687-694.
[4] NGUYEN Y, SPERANDIO V.Enterohemorrhagic E.coli (EHEC) pathogenesis[J].Frontiers in Cellular and Infection Microbiology, 2012, 2:90.
[5] GRIFFIN P M, TAUXE R V.The epidemiology of infections caused by Escherichia coli O157:H7, other enterohemorrhagic E.coli, and the associated hemolytic uremic syndrome[J].Epidemiologic Reviews, 1991, 13(1):60-98.
[6] RANGEL J M, SPARLING P H, CROWE C, et al.Epidemiology of Escherichia coli O157:H7 outbreaks, United States, 1 982-2002[J].Emerging Infectious Diseases, 2005, 11(4):603-609.
[7] SANCAK Y C, SANCAK H, ISLEYICI O.Presence of Escherichia coli O157 and O157:H7 in raw milk and Van herby cheese[J].Bulletin of the Veterinary Institute in Pulawy, 2015, 59(4):511-514.
[8] KARMALI M A.Infection by verocytotoxin-producing Escherichia coli[J].Clinical Microbiology Reviews, 1989, 2(1):15-38.
[9] VERHAEGEN B, DE REU K, HEYNDRICKX M, et al.Comparison of six chromogenic agar media for the isolation of a broad variety of non-O157 shigatoxin-producing Escherichia coli (STEC) serogroups[J].International Journal of Environmental Research and Public Health, 2015, 12(6):6 965-6 978.
[10] SUAIFAN G A R Y, ALHOGAIL S, ZOUROB M.Paper-based magnetic nanoparticle-peptide probe for rapid and quantitative colorimetric detection of Escherichia coli O157:H7[J].Biosensors and Bioelectronics, 2017, 92:702-708.
[11] WU X L, WANG W B, LIU L Q, et al.Monoclonal antibody-based cross-reactive sandwich ELISA for the detection of Salmonella spp.in milk samples[J].Analytical Methods, 2015, 7(21):9 047-9 053.
[12] FENG M, YONG Q Q, WANG W B, et al.Development of a monoclonal antibody-based ELISA to detect Escherichia coli O157:H7[J].Food and Agricultural Immunology, 2013, 24(4):481-487.
[13] YU H, BRUNO J G.Immunomagnetic-electrochemiluminescent detection of Escherichia coli O157 and Salmonella typhimurium in foods and environmental water samples[J].Applied and Environmental Microbiology, 1996, 62(2):587-592.
[14] ZHOU C, ZOU H M, LI M, et al.Fiber optic surface plasmon resonance sensor for detection of E.coli O157:H7 based on antimicrobial peptides and AgNPs-rGO[J].Biosensors and Bioelectronics, 2018, 117:347-353.
[15] YU X J, LU H D, WU D.Development of deep learning method for predicting firmness and soluble solid content of postharvest Korla fragrant pear using Vis/NIR hyperspectral reflectance imaging[J].Postharvest Biology and Technology, 2018, 141:39-49.
[16] BURRIS K P, STEWART C N Jr.Fluorescent nanoparticles:Sensing pathogens and toxins in foods and crops[J].Trends in Food Science & Technology, 2012, 28(2):143-152.
[17] ESTEVE-TURRILLAS F A, ABAD-FUENTES A.Applications of quantum dots as probes in immunosensing of small-sized analytes[J].Biosensors and Bioelectronics, 2013, 41:12-29.
[18] VINAYAKA A C, THAKUR M S.Focus on quantum dots as potential fluorescent probes for monitoring food toxicants and foodborne pathogens[J].Analytical and Bioanalytical Chemistry, 2010, 397(4):1 445-1 455.
[19] YANG L J, LI Y B.Simultaneous detection of Escherichia coli O157:H7 and Salmonella Typhimurium using quantum dots as fluorescence labels[J].The Analyst, 2006, 131(3):394-401.
[20] STÖBER W, FINK A, BOHN E.Controlled growth of monodisperse silica spheres in the micron size range[J].Journal of Colloid and Interface Science, 1968, 26(1):62-69.
[21] 苏鹏飞, 陈国, 赵珺.表面羧基化Fe3O4磁性纳米粒子的快捷制备及表征[J].高等学校化学学报, 2011, 32(7):1 472-1 477.
SU P F, CHEN G, ZHAO J.Convenient preparation and characterization of surface carboxyl-functioned Fe3O4 magnetic nanoparticles[J].Chemical Journal of Chinese Universities, 2011, 32(7):1 472-1 477.
[22] AI L H, ZHANG C Y, LIAO F, et al.Removal of methylene blue from aqueous solution with magnetite loaded multi-wall carbon nanotube:Kinetic, isotherm and mechanism analysis[J].Journal of Hazardous Materials, 2011, 198:282-290.
[23] HUANG L, ZHU P L, LI G, et al.Core-shell SiO2@RGO hybrids for epoxy composites with low percolation threshold and enhanced thermo-mechanical properties[J].Journal of Materials Chemistry A, 2014, 2(43):18 246-18 255.
[24] ZHU W T, PENG H L, LUO M, et al.Zipper-like magnetic molecularly imprinted microspheres for on/off-switchable recognition and extraction of 17β-estradiol from food samples[J].Food Chemistry, 2018, 261:87-95.
[25] XIE X W, MA X G, GUO L H, et al.Novel magnetic multi-templates molecularly imprinted polymer for selective and rapid removal and detection of alkylphenols in water[J].Chemical Engineering Journal, 2019, 357:56-65.
