土味素污染广泛存在,对水产品[1]、果汁[2]、葡萄酒[3]等食品和饮料的安全与风味品质产生影响,且在天然发酵食品中尤为突出。土味素是链霉菌、蓝细菌和某些真菌的挥发性代谢产物[4-5],会导致泥土气味[6]。土味素具有极低的感官阈值(6~10 ng/L),通常在45 ℃,质量浓度为7 ng/L时人们开始感到不适[7-8]。泥土异味可能会对健康造成一定程度的影响,例如头痛或胃部不适[9]。
中国白酒发酵是典型的多菌种固态发酵过程,采用了边糖化边发酵的方式,由谷物为原料,大曲作为糖化发酵剂,经过蒸煮、糖化发酵、蒸馏、储存、勾兑等独特工艺制成[10],独特的酿造工艺赋予了白酒复杂的香气成分[11]。作为糖化发酵剂,大曲在白酒酿造中发挥着重要的作用,为白酒发酵过程贡献了许多发酵功能性微生物[11]。大曲在开放的环境中通过自发固态发酵工艺制造而成,自然接种的霉菌、细菌和酵母菌在大曲中形成了独特的微生物菌群,并通过生长和代谢提供各种酶和风味化合物[12-13]。因此,大曲中的微生物在很大程度上决定了大曲和原酒的典型特征。然而,在开放系统中,环境中存在的一些微生物可能会在大曲发酵过程中造成污染[14]。
近年来,土味素污染对白酒风味品质的负面影响越来越受到关注。高浓度的土味素会给白酒带来发霉异味。DU等[5]在制曲过程中检测到了较高的土味素含量(约为6 μg/kg)。经可培养验证证明大曲中链霉菌是白酒中土味素的主要生物源头。链霉菌可以产生大量抗生素,这些抗生素会抑制酿造功能性酵母和霉菌的生长和代谢,并减少其贡献的风味物质[14-15]。在各种香型白酒中,清香型白酒受到了最显著的负面影响。因此,在制曲过程中探索一种抑制土味素生成的方案是必要的。
生物防治作为一种有效的、环境友好的方法,已被广泛用于食品、环境等领域[16-17]。生物防治基于微生物群落之间的相互作用,旨在塑造微生物群落结构和代谢性能,以优化传统发酵过程[18]。通过接种原位微生物进行生物防治是控制发酵质量的有效方法。例如,在葡萄汁中使用非发酵和低发酵酵母菌株来控制曲霉生产赭曲霉毒素A[19]。在本实验室前期的接种芽孢杆菌模拟发酵实验中,显示出有效降低土味素产生的能力[4]。
本研究采用顶空-固相微萃取与气相色谱-质谱联用技术(head space solid phase microextraction gas chromatography mass spectroscopy,HS-SPME-GC-MS)和高通量扩增子测序技术,测定了中温大曲制作过程中的土味素含量以及微生物群落结构组成。结合土味素产生时期和微生物特性,从中温大曲中筛选出能够对土味素及链霉菌进行生物防治的原位微生物,以期为后续控制大曲中土味素污染提供支撑。
1 材料与方法
1.1 样品采集
样品收集于陕西省某酒厂,在曲房中靠近门口、中间及靠近窗户的3个位置处各取1块曲,3块大曲作为平行跟踪采集样本。大曲样品分别在制曲的前期(发酵第10天)、后期采集(发酵第20天),前期编号分别为1、2、3,后期编号分别为4、5、6。将不同培养时期的大曲曲皮和曲心进行分离、粉碎,分别取曲心和曲皮样品各200 g,采集到的曲皮样品命名为XP,曲心样品命名为XX。所有样品1式3份粉碎后放入密封袋记录日期和编号,保存于-80 ℃用于HS-SPME-GC-MS测定与DNA提取。
1.2 主要试剂与仪器
NaCl、乙醇、异戊醇、三氯甲烷、D(+)-无水葡萄糖、琼脂,国药集团化学试剂(北京)有限公司;(+/-)土味素标准品,AccuStandard公司;L-薄荷醇(高级纯),Sigma-Aldrich公司(中国上海);酵母提取物、蛋白胨,Oxoid公司;马铃薯葡萄糖琼脂(Potato dextrose agar,PDA)培养基,URCHEM公司。
Avanti J-E冷冻离心机,Beckman Coulter公司;NanoDrop 8000蛋白核酸测定分光光度计,Thermo Fisher Scientific公司;PCR仪、凝胶成像仪,Bio-Rad公司;超声波清洗仪,宁波新芝生物科技股份有限公司;Milli-Q超纯水系列,美国Millipore公司;Mini-Beadbeater细胞破碎仪,Biospec公司。
1.3 微生物的分离与培养条件
用于生物防治试验的链霉菌为白色链霉菌(Streptomyces albus)FXJ,该菌株从中温大曲中分离,鉴定并保存于本实验室。在链霉菌菌株分离鉴定的过程中白色链霉菌出现的频率和含量最高,且在中温大曲中很常见,在不同酒厂的中温大曲中都有该菌株存在,具有代表性。该菌株产土味素的能力强(30 ℃液态发酵7 d后可产生143.53 μg/L土味素),且预实验发现该链霉菌的生长速度快于其他分离出的链霉菌菌株,所以从提高实验效率的角度,本研究选择了S.albus FXJ作为模式菌株。链霉菌使用PDA培养基30 ℃活化48 h。试验菌株为从中温大曲中分离出的大曲培养所必需的霉菌。为了筛选出大曲中对链霉菌有抑制作用的微生物,将5 g样品与45 mL无菌NaCl溶液(0.85 g/L) 充分搅拌混合30 min,制备10倍梯度稀释溶液(10-1、10-2、10-3、10-4、10-5和10-6),将稀释的溶液分别涂布在YPD培养基(g/L)(蛋白胨20,葡萄糖20,酵母提取物10,琼脂20)上,30 ℃培养。参照DU等[20]筛选微生物的方法,在霉菌分离实验中,加入0.12 mg/L的氨苄青霉素抑制细菌。基于微生物的特征,挑出每个平板中的单菌落,划线纯化并保藏于甘油管中。
1.4 从大曲中分离筛选鉴定对S.albus有抑制作用的微生物
通过改良的琼脂扩散实验测定分离株对S.albus的拮抗作用。在已覆盖有50 μL S.albus FXJ(每毫升含有107孢子)菌苔的PDA平板中间放置直径为4 mm的无菌滤纸片,将10 μL分离物的培养液加入滤纸片中,30 ℃培养5 d。生长抑制情况可以被量化为抑菌圈直径大小。
1.5 核酸提取、测序及生物信息学分析
大曲样品的前处理与DNA提取参考SONG等[21]的方法,NanoDrop仪器用来检测基因组中总DNA浓度,检测后保存于-20 ℃冰箱中。细菌使用通用引物组F338和R806扩增16S rRNA基因的V3~V4区,真菌内部转录间隔区ITS2区域用引物ITS3和ITS4扩增。PCR产物通过PCR纯化试剂盒进行纯化,并通过Thermo Scientific NanoDrop 8000评估浓度。使用BLAST程序(https://blast.ncbi.nlm.nih.gov/)将获得的基因序列与NCBI中的可用序列进行比较。使用位于中国北京AuwiGene Technology的Illumina MiSeq平台(Illumina,San Diego,CA,美国)对扩增子进行测序。生物信息学分析方法参考文献[13]。
1.6 大曲含水量测定
取10 g大曲样品,在105 ℃的烘箱中放入待测的大曲样品,烘干4 h,于干燥皿中冷却30 min,再次烘干1 h至恒重。称量样品质量,含水量的计算如公式(1)所示:
样品含水量![]()
(1)
1.7 大曲分离株耐低含水量能力测定
利用在本地获取的小麦作为模拟固态发酵的基质,粉碎后80 ℃下烘12 h至绝干,高压灭菌后用作初始固态基质。在含有5 g固态基质的50 mL离心管中对大曲分离株进行耐低含水量实验。将孢子悬浮液接种到每个烧瓶中,初始浓度为106/g(每克小麦中含有的孢子数,下同),调整固态发酵体系中水分的质量分数分别为2%、5%、10%、15%、20%。将烧瓶30 ℃培养7 d,微生物的生长情况被量化为培养7 d后的产孢子情况。培养结束后取出每个样品5 g,用铝箔包裹,液氮冷冻后-80 ℃储存,备用。
1.8 大曲分离株对土味素的抑制情况测定
进行模拟固态发酵实验,以研究大曲中分离出的微生物菌株对土味素产生的抑制情况。固态发酵基质制作方法同1.7,S.albus FXJ在含有100 g固态基质的250 mL烧瓶中与大曲分离株进行共培养实验。将链霉菌孢子悬浮液接种到烧瓶中,初始浓度为106/g,然后接种洗涤过的霉菌孢子,控制初始浓度分别为103、104、105、106/g,调整固态发酵体系中含水量为20%。以S.albus FXJ单培养时产生土味素情况作为对照。将烧瓶30 ℃培养7 d,培养结束后取出每个样品5 g,用铝箔包裹,液氮冷冻后-80 ℃储存,备用。
1.9 大曲中挥发性风味物质分析
1.9.1 大曲样品前处理
称取5 g粉碎后的大曲样品于50 mL旋盖离心管中,加入20 mL超纯水,涡旋振荡5 min,冰浴超声30 min,于4 ℃静置过夜,然后9 000 r/min离心10 min,取上清液。
1.9.2 GC-MS风味物质检测
取大曲浸提液5 mL加入20 mL顶空瓶中,加入1.5 g NaCl饱和,加入10 μL,质量浓度为4 mg/L的薄荷醇作为内标,使用HS-SPME-GC-MS的方法检测大曲中的土味素及其他风味物质含量。HS-SPME参数与GC-MS分析参考DU等[15]的方法。
1.9.3 土味素标准曲线
将一定量的土味素加入10%乙醇水溶液中,土味素的质量浓度为0.1~20 μg/L。通过计算土味素(m/z 112)与薄荷醇(m/z 95)的峰面积比与浓度比得到标准曲线。
1.9.4 土味素抑制率计算
从大曲中筛选出的霉菌对土味素产生的抑制率按公式(2)计算:
抑制率![]()
(2)
式中:ρ1,样品中土味素质量浓度;ρ2,对照组中土味素质量浓度。
1.10 统计学分析及绘图
使用Excel 2016、Origin Pro 2021和Adobe Illustrator CC 22.0进行统计学分析和数据绘图,显著性水平设定在0.05。主成分分析(principal component analysis,PCA)通过CANOCO5进行。Spearman等级相关性的计算通过R中的vegan包进行(http://vegan.r-forge.r-project.org/)。
2 结果与分析
2.1 不同制曲时期土味素的含量与含水量
大曲中的土味素含量与含水量变化情况如图1所示。土味素的变化情况与含水量呈现负相关,随着发酵的进行,土味素含量虽然有波动但是整体呈现上升趋势,而大曲的含水量则随着发酵进行而降低。在大曲入房时含水量为(34.73±0.57)%,出房时期含水量则为(12.05±0.55)%。制曲过程中,曲皮中的土味素含量在0~10 d迅速升高,在第10天达到(7.29±0.39) μg/kg,在第15天出现一个小波动后,随后在20 d达到最高含量(9.75±0.50) μg/kg。曲心中土味素含量在0~5 d同样快速增长,但随后的波动较平稳。之前的研究发现,含水量的差异是导致曲皮、曲心微生物差异的重要因素。发现由于曲皮与空气接触面积更大,导致曲皮中的含水量低于曲心[22]。
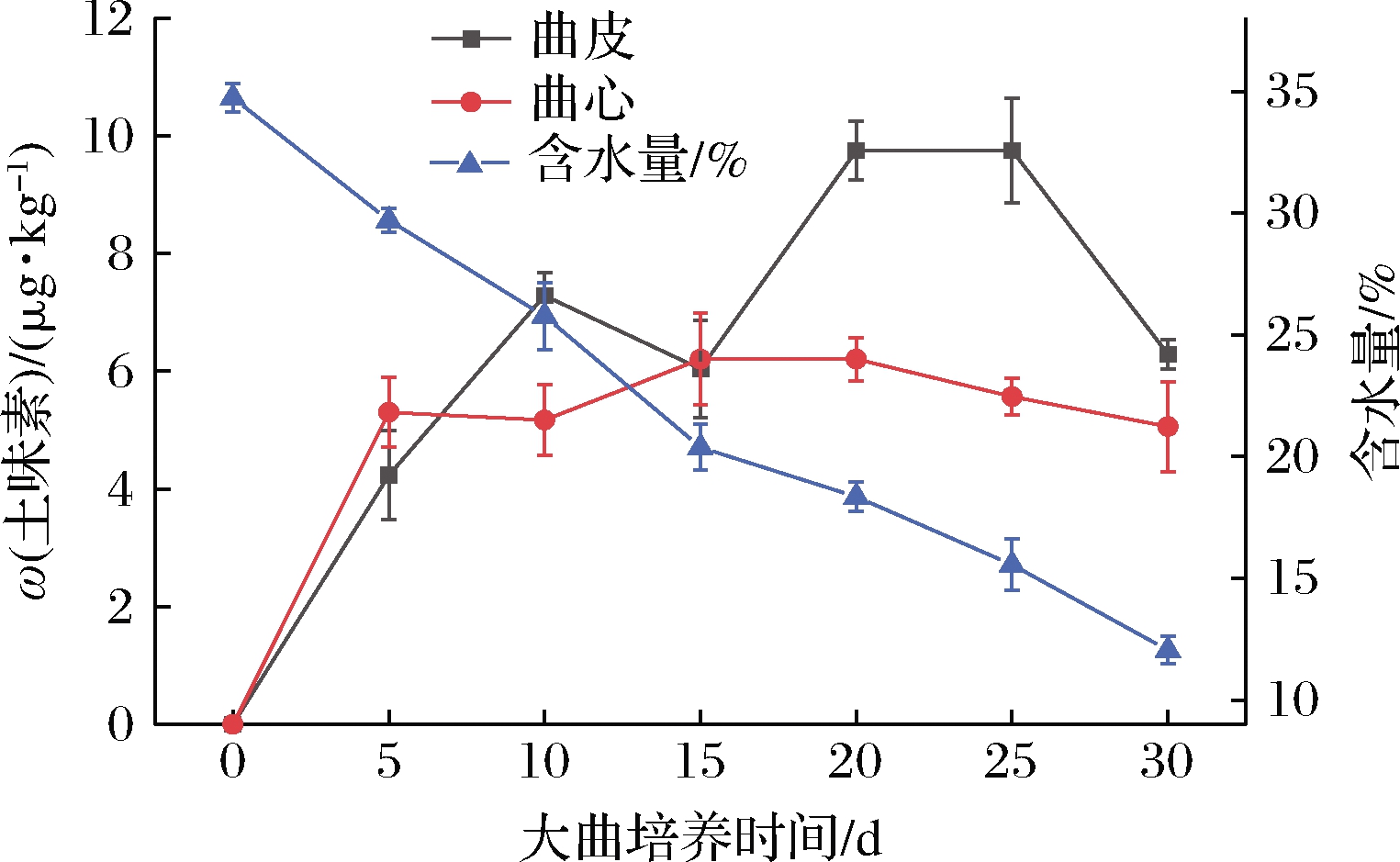
图1 大曲中土味素含量与含水量的关系
Fig.1 Relationship between geosmin and water content in Daqu
图1显示曲皮中的土味素存在2个快速产生阶段,0~10 d和15~20 d。0~10 d土味素的产生速率为0.729 μg/(kg·d),15~20 d则为0.742 μg/(kg·d)。土味素在制曲后期的产生速率高于制曲前期的产生速率。在固态发酵体系中,产土味素的链霉菌与大曲中的功能微生物存在一定程度的竞争关系,在同一体系中,酵母、霉菌等功能微生物的快速生长会对链霉菌存在一定程度的抑制作用[23]。结合制曲过程中含水量的变化,研究推测可能是酵母等功能微生物在低含水量的条件下生长缓慢,无法与链霉菌形成足够的竞争,所以在制曲后期含水量下降后,曲皮中的土味素含量出现了第2个快速增长期。因此需要找到在低含水量下可快速生长的微生物,重新与链霉菌形成竞争,从而抑制土味素的产生。
2.2 大曲中微生物群落结构分析
2.2.1 不同区域、不同时期的微生物多样性差异
本研究通过丰富度指数(Chao1)和多样性指数(Shannon)来评价大曲中的微生物α多样性。如图2所示,细菌群落的丰富度和多样性指数均高于真菌群落。图2-a显示曲皮和曲心在微生物丰富度上无显著性差异(P>0.05)。在多样性方面,无论是细菌或真菌,曲心的丰富度均稍高于曲皮,但无显著性差异(P>0.05)。在时间差异上(图2-c,图2-d),细菌群落在制曲后期的丰富度和多样性均高于前期,而真菌群落在制曲后期的丰富度和多样性稍有降低,但无显著性差异(P>0.05)。而真菌丰富度和多样性的降低可能是导致制曲后期土味素含量升高的原因。
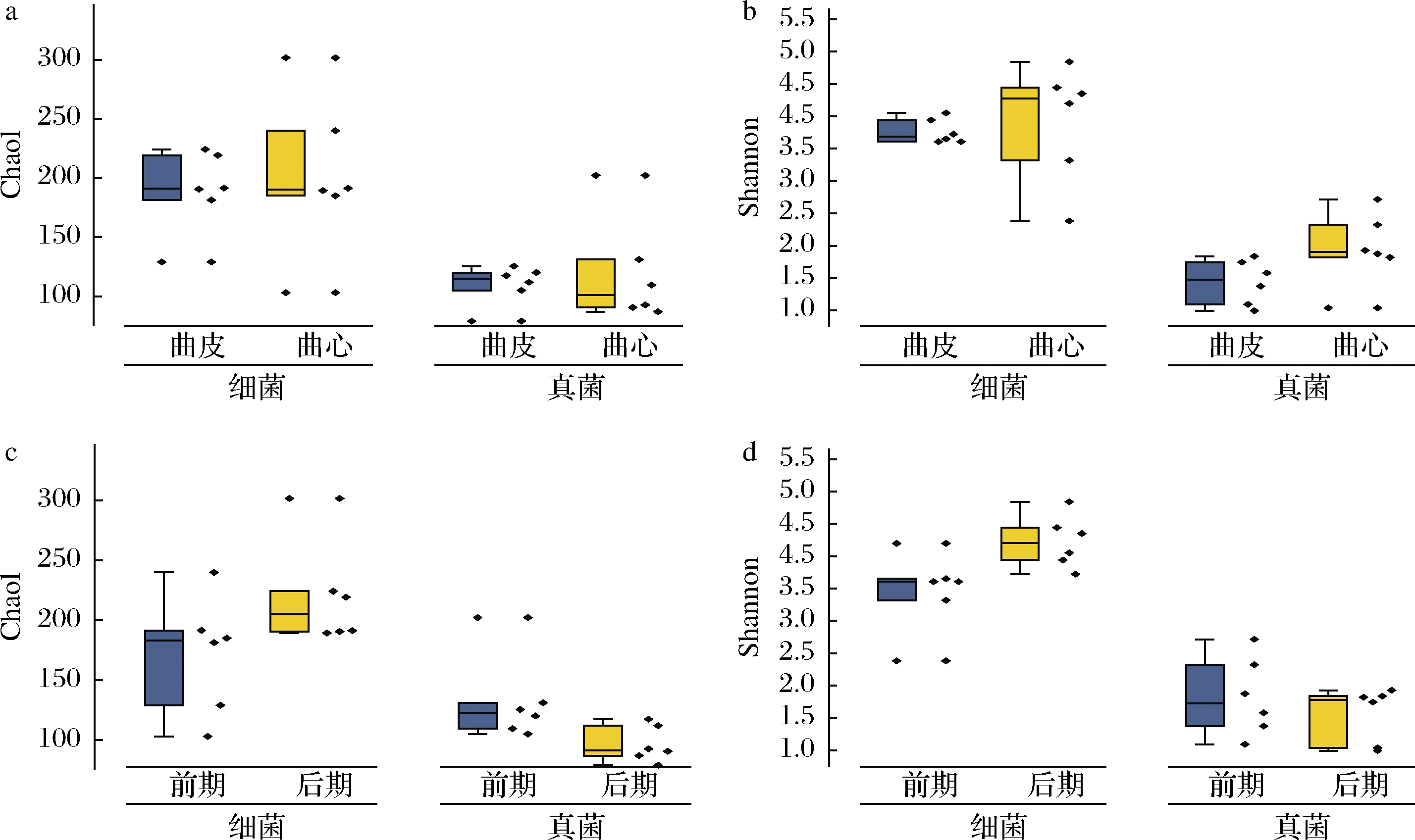
a-曲心和曲皮 Chao1指数;b-曲心和曲皮 Shannon指数; c-制曲前期和后期 Chao1指数;d-制曲前期和后期 Shannon指数
图2 大曲中微生物群落的α多样性
Fig.2 α Diversity of microbial communities in Daqu
2.2.2 细菌属水平分析
高通量测序显示大曲样品中在细菌属水平共检测到个117属。其中,大曲曲皮中检测到91个属,曲心中检测到了112个属。本研究将大曲中相对丰度最高的19个细菌属定义为优势种属,得到其水平信息如图3-a所示。链霉菌属作为主要的土味素生产者,通常被认为是大曲制作过程中严重的微生物污染[4-5]。链霉菌属在曲皮中的相对丰度(3.11%)显著高于曲心(0.22%),在制曲后期链霉菌属(2.08%)的相对丰度高于制曲前期(1.00%)。与图1土味素含量结论相符。
为了更直观地说明大曲中细菌群落的差异,本研究通过基于weighted UniFrac距离的PCA对细菌群落的β多样性进行进一步分析(图3-b)。大曲的发酵过程是在开放式的环境中自发的固态发酵过程,固态发酵与液态发酵最大的差异是其不均一性,所以重复之间的微生物群落结构也会存在一定的差异。PCA结果显示大曲中细菌群落的差异主要由曲心和曲皮的差异造成,不同重复之间存在差异但是不同组别之间的差异更大。
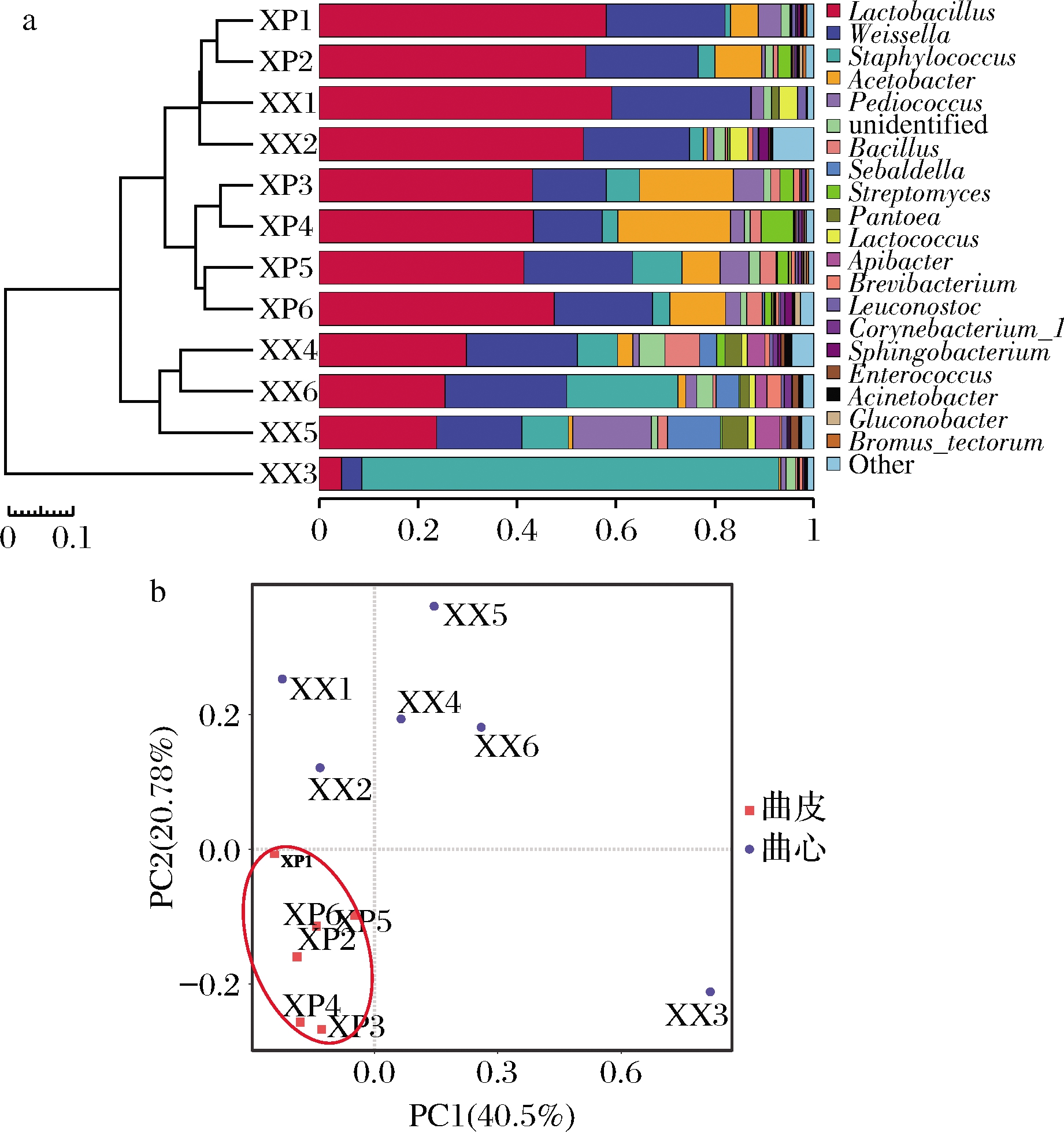
a-大曲属水平优势细菌分布;b-基于weighted UniFrac距离的PCA
图3 大曲样品细菌群落结构
Fig.3 Bacterial community compositions of Daqu samples
2.2.3 真菌属水平分析
高通量测序显示大曲样品中在真菌属水平共检测到34个属,其中大曲曲皮中检测到30个属,大曲曲心中检测到了33个属。本研究将大曲中相对丰度最高的19个真菌属定义为优势种属,得到其水平信息如图4-a所示。在曲皮中,毕赤酵母属(Pichia)是有绝对优势的真菌属,有最高的相对丰度,(78.49±8.65)%;在曲心中,嗜热子囊菌属(Thermoascus)则取代了曲皮中毕赤酵母属的优势,丰度为(58.35±6.48)%,成为了曲心中最具有优势的真菌属。

a-大曲属水平优势真菌分布;b-基于weighted UniFrac距离的PCA
图4 大曲样品真菌群落结构
Fig.4 Fungal community compositions of Daqu samples
由图1和2.2.2分析可知,曲皮和制曲后期都存在较高的土味素含量和链霉菌含量。Thermoascus、Aspergillus和Trichosporon在曲皮中的相对丰度比曲心中要低。同时,Pichia、Saccharomycopsis、Rhizopus、Candida和Trichosporon在制曲后期的相对丰度低于制曲前期。有研究表明,毕赤酵母属是白酒酿造过程中的主要功能性真菌,对大曲和白酒的风味有重要的贡献[24]。嗜热子囊菌属、曲霉属和根霉属可以分泌大量的胞外酶,参与淀粉和复合聚合物的分解同时,为发酵过程提供可用于发酵的糖类,同时真菌的群落结构功能等对大曲的品质有很重要的影响[18,25]。以上结果均为后续筛选抑制链霉菌与土味素的微生物提供思路。
PCA结果进一步表明大曲中微生物群落分布规律(图4-b)。大曲中真菌群落的差异主要由曲心和曲皮的差异造成,制曲阶段对大曲的真菌群落造成的影响较小。
2.2.4 微生物属水平相关性分析
为了探究大曲发酵过程中与土味素与链霉菌呈负相关的微生物,基于Spearman等级相关性(|P|>0.2和P<0.05)探索了中温大曲中微生物与土味素之间的关系(图5)。几种微生物与土味素和链霉菌均呈负相关性,如魏斯氏菌属、嗜热子囊菌属、曲霉属、横梗霉属、根霉属和毛孢菌属等。从计算所得呈负相关性的微生物中,进一步筛选抑制链霉菌的微生物。
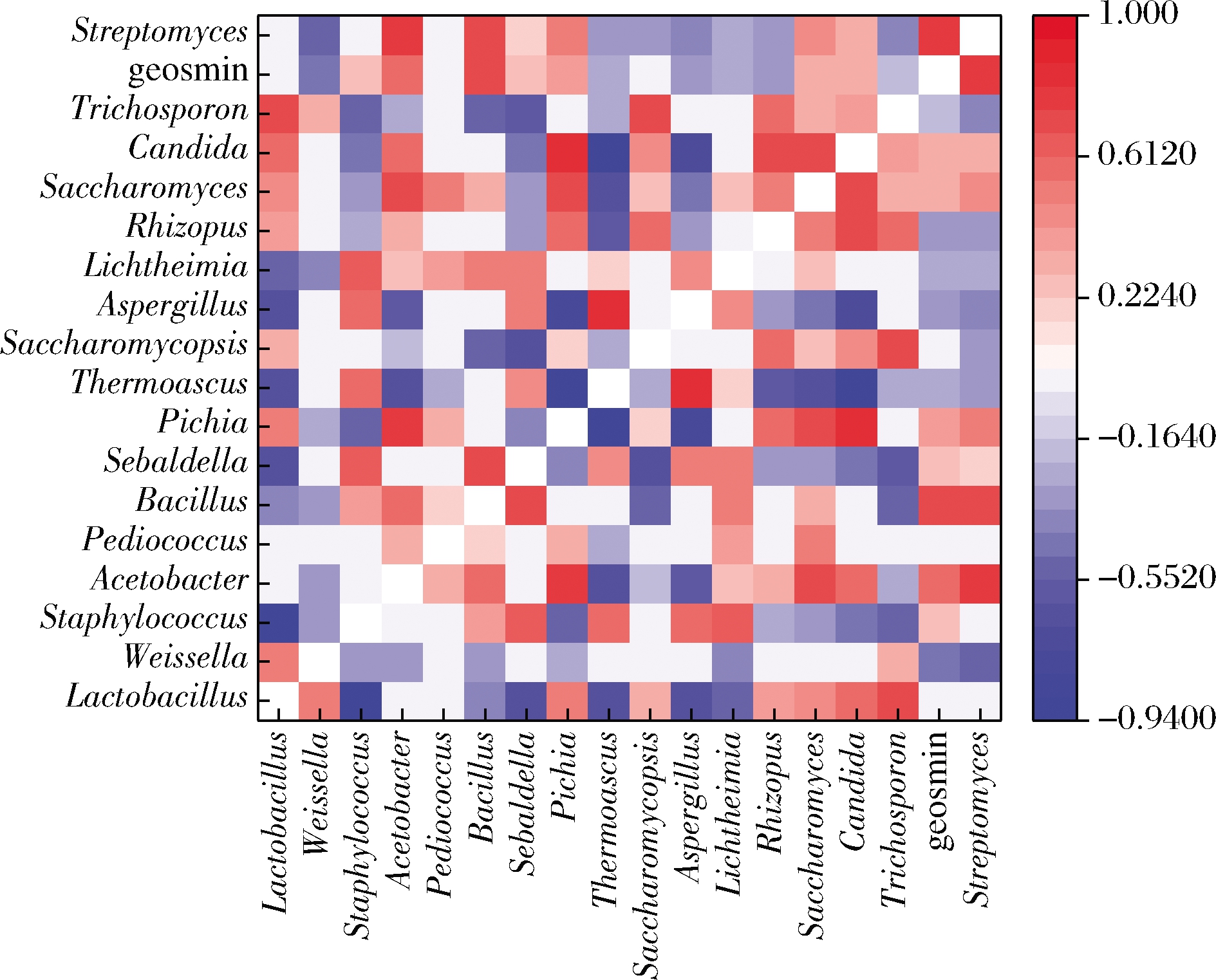
图5 十七个关键微生物属与土味素的相关性关系
Fig.5 Relationship between 17 key microorganisms and geosmin
注:热图的颜色表示Spearman相关性(R)的大小,红色和蓝色分别表示关键微生物与土味素之间的正负相关性关系,GSM表示土味素
2.3 对产土味素的链霉菌有抑制作用的微生物筛选
从源头控制土味素污染,确定原位微生物对链霉菌的拮抗潜力具有重要意义。在大曲中共分离出37株霉菌。通过改良的琼脂扩散实验测定所有分离株对S.albus FXJ的拮抗作用(图6)。其中,6株表现出明显的抑制作用。通过18S rDNA测序,有抑制效果的6株菌株分别被鉴定为Aspergillus sp. LBM32010、Aspergillus sp. LBM32013、Rhizopus sp. LBM32021、Trichosporon sp. LBM32022、Lichtheimia sp. LBM32026和Trichosporon sp. LBM32030。
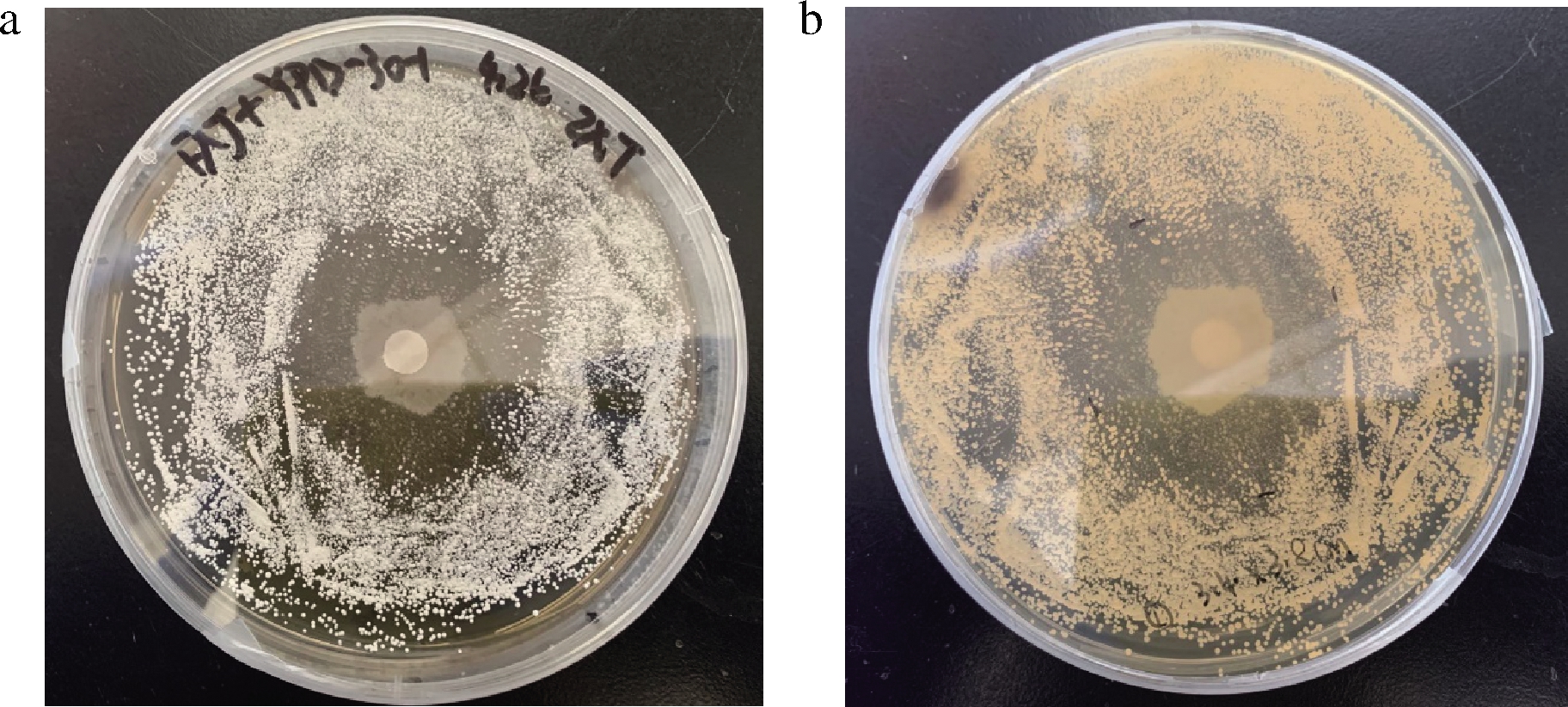
a-抑菌圈正面;b-抑菌圈背面
图6 对链霉菌有较明显抑制作用菌株筛选
Fig.6 Selection of strains with obvious inhibitory effect on Streptomyces
大曲中分离出的微生物生长抑制情况可以被量化为抑菌圈直径大小。抑菌效果按照抑菌圈直径分为3种,分别是:3 cm≤D<5 cm、5 cm≤D<7 cm、7 cm≤D。D<3 cm的微生物抑菌效果较差,不予统计(表1)。
表1 抑菌实验中效果较好的主要微生物及其在大曲中的相对丰度
Table 1 Main microorganisms with better effect in antibacterial experiment and their relative abundance in Daqu

抑菌圈直径(D)/cm菌种编号菌株名称大曲中相对丰度/%3 ≤D<5 LBM32026Lichtheimia sp.4.01LBM32030Trichosporon sp.0.295 ≤D<7 LBM32010Aspergillus sp.4.67LBM32022Trichosporon sp.0.297 ≤DLBM32013Aspergillus sp.4.67LBM32021Rhizopus sp.1.49
2.4 大曲来源的霉菌耐低含水量特性解析
针对制曲后期含水量下降,链霉菌与土味素含量升高的情况,本研究设计了10%、15%、20%的含水量质量分数梯度,测试了6株在抑菌实验中表现良好的霉菌对低含水量的耐受情况,霉菌的生长情况被量化为培养7 d后的产孢子情况。
所筛选到的6株霉菌均具有在低含水量条件下生长的能力(图7)。其中Aspergillus sp.LBM32010、Aspergillus sp.LBM32013、Trichosporon sp.LBM32030具有更强的耐低含水量的能力。在含水量≥10%时,Aspergillus sp.LBM32010生长情况最好,2.1小节显示,土味素在制曲后期含量最高,含水量在15%~20%,在15%含水量的情况下,Aspergillus sp.LBM32010的生长情况为[(9.72±0.03)lg孢子数/g],Aspergillus sp.LBM32013的生长情况为[(9.53±0.05)lg孢子数/g],Trichosporon sp.LBM32030的生长情况为[(9.57±0.08)lg孢子数/g]。在含水量20%时,Aspergillus sp.LBM32010的生长情况为[(10.35±0.04)lg孢子数/g],Aspergillus sp.LBM32013的生长情况为[(10.02±0.11)lg孢子数/g],Trichosporon sp.LBM32030的生长情况为[(10.08±0.11)lg孢子数/g]。
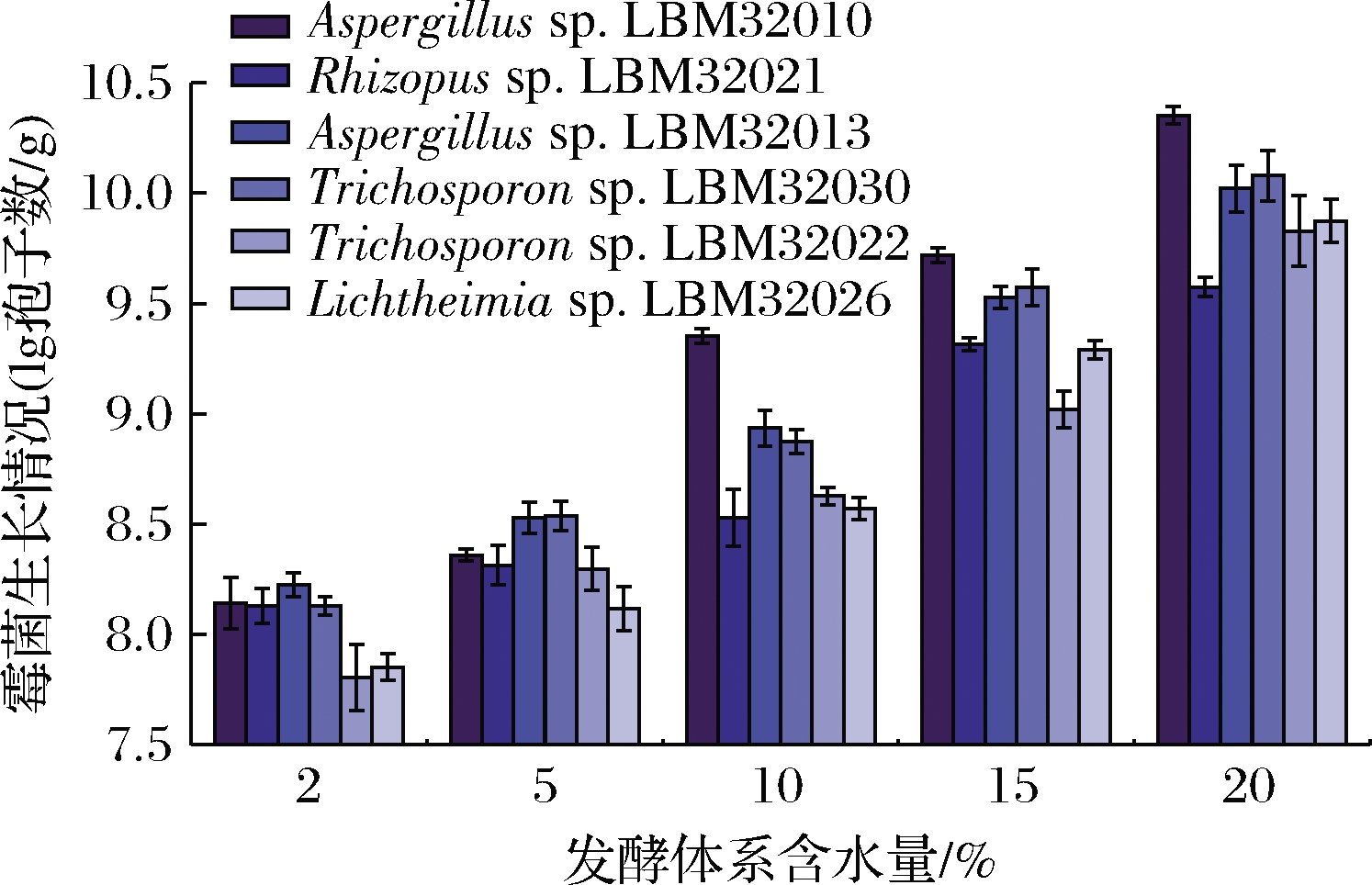
图7 不同含水量条件下霉菌在固态发酵体系中的生长情况
Fig.7 Growth of fungi in solid-state fermentation system under different water content conditions
在确定了筛选出的微生物菌株可以在含水量质量分数为10%~20%条件下生长后,实验继续测试了筛选到的微生物在极端含水量条件下(含水质量分数2%和5%)的生长情况,对耐受能力做极限评估。在含水量<5%时,筛选出的微生物仍可以继续生长,但生长受到了明显的抑制。
2.5 大曲来源的霉菌对土味素的抑制作用
为进一步测试筛选出的微生物对土味素的抑制效果,在实验室规模下使用破碎后的小麦模拟了固态发酵体系,实验控制小麦培养基含水量为20%,调整筛选到的霉菌接种数量分别为103、104、105、106/g,分别与S.albus FXJ进行共培养实验,分别命名为A~D组,CK为对照组,为S.albus FXJ单培养实验。HS-SPME-GC-MS测定了共培养7 d后固态发酵体系中土味素的含量(图8),针对实验结果进行显著性分析。
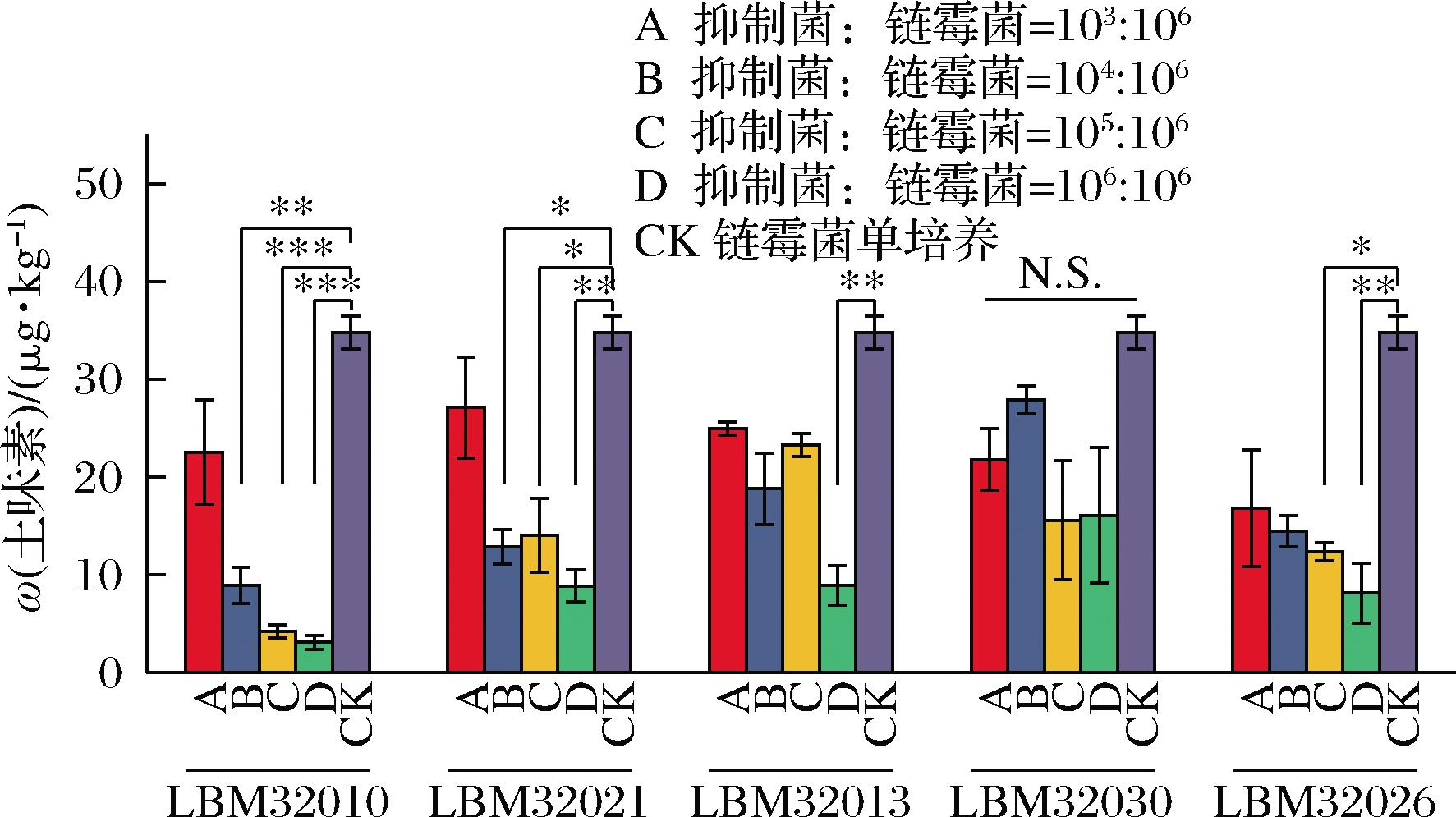
图8 大曲来源的霉菌对土味素的抑制效果
Fig.8 Inhibitory effect of fungi from Daqu on geosmin
注:* ,P<0.05;** , P<0.01;*** , P<0.001;N.S.,差异不显著
链霉菌单培养时产生的土味素质量分数为(34.79±2.34) μg/kg。随着筛选出的抑制菌添加量的提高,链霉菌生长代谢受到抑制,土味素的含量明显下降。虽然5种链霉菌抑制微生物在抑制菌∶链霉菌=103∶106时,与链霉菌单培养(对照组)相比无显著性差异(P>0.05),但土味素含量均有所下降。在5株霉菌与链霉菌的共培养实验中,Aspergillus sp.LBM32010对土味素的抑制效果是最好的,在试验组B、C、D中,土味素质量分数分别为(8.95±3.21) μg/kg,抑制率74.27%(P<0.01);(4.21±1.13) μg/kg,抑制率87.90%(P<0.001);(3.11±1.22) μg/kg,抑制率91.06%(P<0.001)。其次是Rhizopus sp.LBM32021对土味素的抑制效果也较好,在试验组BCD中,土味素的质量分数分别为(12.90±3.07) μg/kg,抑制率62.92%(P<0.05);(14.04±6.58) μg/kg,抑制率59.64%(P<0.05);(8.89±2.79) μg/kg,抑制率74.45%(P<0.01)。在Aspergillus sp.LBM32013对土味素的抑制实验中,仅在试验组D中对土味素有显著性抑制效果,土味素含量为(8.94±3.47) μg/kg,抑制率74.30%(P<0.01)。在Lichtheimia sp.LBM32026对土味素的抑制实验中,C、D组均展示了对土味素显著的抑制效果,在C组中土味素含量为(12.39±1.57) μg/kg,抑制率64.39%(P<0.05),在D组中土味素含量为(8.16±5.29) μg/kg,抑制率76.54%(P<0.01)。而在Trichosporon sp.LBM32030的实验中,土味素含量降低,但均无显著性差异(P>0.05)。
3 结果与讨论
土味素对白酒的风味与品质具有重要影响。本研究从中温大曲中筛选出6株能够耐受低含水量,且能够抑制链霉菌生长和土味素产生的霉菌。其中Aspergillus sp.LBM32010和Rhizopus sp.LBM32021表现出最强的土味素抑制能力,可以作为控制土味素产生的功能菌株。本研究筛选出的原位功能微生物可在制曲阶段作为土味素抑制菌剂添加,在大曲压制成曲块前将抑制菌剂与原料混合并压制成型。研究展现了大曲中原位微生物在低含水量条件下对链霉菌和土味素的抑制能力,突出了生物防治作为一种环境友好的方法对痕量挥发性有机物防治的潜力,为后续控制大曲中土味素污染提供支撑,并为精准调控微生物群落提供了思路。后续将会围绕该抑制菌剂在实际生产中的具体应用展开。进一步探究菌种的复配方案,并评估抑制菌剂对大曲的微生物群落、理化性质、酶活性和风味等方面的影响。
[1] MCCRUMMEN S T, WANG Y F, HANSON T R, et al.Culture environment and the odorous volatile compounds present in pond-raised channel catfish (Ictalurus punctatus)[J].Aquaculture International, 2018, 26(2):685-694.
[2] MORALES-VALLE H, SILVA L C, PATERSON R R M, et al.Microextraction and gas chromatography/mass spectrometry for improved analysis of geosmin and other fungal “off” volatiles in grape juice[J].Journal of Microbiological Methods, 2010, 83(1):48-52.
[3] JOVÉ P, VIVES-MESTRES M, DE NADAL R, et al.Development, optimization and validation of a sustainable and quantifiable methodology for the determination of 2, 4, 6-trichloroanisole, 2, 3, 4, 6-tetrachloroanisole, 2, 4, 6-tribromoanisole, pentachloroanisole, 2-methylisoborneole and geosmin in air[J].Processes, 2021, 9(9):1 571.
[4] ZHI Y, WU Q, DU H, et al.Biocontrol of geosmin-producing Streptomyces spp.by two Bacillus strains from Chinese liquor[J].International Journal of Food Microbiology, 2016, 231:1-9.
[5] DU H, XU Y.Determination of the microbial origin of geosmin in Chinese liquor[J].Journal of Agricultural and Food Chemistry, 2012, 60(9):2 288-2 292.
[6] GERBER N N, LECHEVALIER H A.Geosmin, an earthly-smelling substance isolated from actinomycetes[J].Applied Microbiology, 1965, 13(6):935-938.
[7] OMÜR-OZBEK P, LITTLE J C, DIETRICH A M.Ability of humans to smell geosmin, 2-MIB and nonadienal in indoor air when using contaminated drinking water[J].Water Science and Technology:a Journal of the International Association on Water Pollution Research, 2007, 55(5):249-256.
[8] LIATO V, AÏDER M.Geosmin as a source of the earthy-musty smell in fruits, vegetables and water:Origins, impact on foods and water, and review of the removing techniques[J].Chemosphere, 2017, 181:9-18.
[9] XUE Q, SHIMIZU K, SAKHARKAR M K, et al.Geosmin degradation by seasonal biofilm from a biological treatment facility[J].Environmental Science and Pollution Research International, 2012, 19(3):700-707.
[10] SONG J K, TANG H L, LIANG H B, et al.Effect of bioaugmentation on biochemical characterisation and microbial communities in Daqu using Bacillus, Saccharomycopsis and Absidia[J].International Journal of Food Science & Technology, 2019, 54(8):2 639-2 651.
[11] DU H, WANG X S, ZHANG Y H, et al.Exploring the impacts of raw materials and environments on the microbiota in Chinese Daqu starter[J].International Journal of Food Microbiology, 2019, 297:32-40.
[12] DU H, LU H, XU Y, et al.Community of environmental Streptomyces related to geosmin development in Chinese liquors[J].Journal of Agricultural and Food Chemistry, 2013, 61(6):1 343-1 348.
[13] HE G Q, DONG Y, HUANG J, et al.Alteration of microbial community for improving flavor character of Daqu by inoculation with Bacillus velezensis and Bacillus subtilis[J].LWT, 2019, 111:1-8.
[14] DU H, LU H, XU Y.Influence of geosmin-producing Streptomyces on the growth and volatile metabolites of yeasts during Chinese liquor fermentation[J].Journal of Agricultural and Food Chemistry, 2015, 63(1):290-296.
[15] DU H, FAN W L, XU Y.Characterization of geosmin as source of earthy odor in different aroma type Chinese liquors[J].Journal of Agricultural and Food Chemistry, 2011, 59(15):8 331-8 337.
[16] SELLITTO V M, ZARA S, FRACCHETTI F, et al.Microbial biocontrol as an alternative to synthetic fungicides:Boundaries between pre- and postharvest applications on vegetables and fruits[J].Fermentation, 2021, 7(2):60.
[17] BRANCO P, SABIR F, DINIZ M, et al.Biocontrol of Brettanomyces/Dekkera bruxellensis in alcoholic fermentations using saccharomycin-overproducing Saccharomyces cerevisiae strains[J].Applied Microbiology and Biotechnology, 2019, 103(7):3 073-3 083.
[18] ZHANG H X, DU H, XU Y.Volatile organic compound-mediated antifungal activity of Pichia spp.and its effect on the metabolic profiles of fermentation communities[J].Applied and Environmental Microbiology, 2021, 87(9):e02992-e02920.
[19] FIORI S, URGEGHE P P, HAMMAMI W, et al.Biocontrol activity of four non- and low-fermenting yeast strains against Aspergillus carbonarius and their ability to remove ochratoxin A from grape juice[J].International Journal of Food Microbiology, 2014, 189:45-50.
[20] DU R B, LIU J, JIANG J, et al.Construction of a synthetic microbial community for the biosynthesis of volatile sulfur compound by multi-module division of labor[J].Food Chemistry, 2021, 347:129036.
[21] SONG Z W, DU H, ZHANG Y, et al.Unraveling core functional microbiota in traditional solid-state fermentation by high-throughput amplicons and metatranscriptomics sequencing[J].Frontiers in Microbiology, 2017, 8:1294.
[22] 周天慈. 基于高通量测序技术定量解析核心真菌群落的形成机制[D].无锡:江南大学, 2021.
ZHOU T C.Analyzing quantitatively the formation mechanism of Daqu core fungal community based on high-throughput sequencing technology[D].Wuxi:Jiangnan University, 2021.
[23] 杜海. 产土味素菌群对白酒酿造的影响机制及监测控制[D].无锡:江南大学, 2013.
DU H.The influence mechanism of geosmin-producing microflora on Chinese liquor brewing and its monitoring&controling[D].Wuxi:Jiangnan University, 2013.
[24] WANG X S, DU H, ZHANG Y, et al.Environmental microbiota drives microbial succession and metabolic profiles during Chinese liquor fermentation[J].Applied and Environmental Microbiology, 2018, 84(4):e02369-e02317.
[25] MCCLENDON S D, BATTH T, PETZOLD C J, et al.Thermoascus aurantiacus is a promising source of enzymes for biomass deconstruction under thermophilic conditions[J].Biotechnology for Biofuels, 2012, 5(1):54.