白酒是世界六大蒸馏酒之一,根据生产工艺、糖化发酵剂种类、酿造原料与环境等因素的差异,可将其分为浓香型、酱香型、清香型和豉香型等多种香型[1]。豉香型白酒是广东珠三角地区的传统米酒。它以大米为原料,蒸煮后拌入大酒饼并加水入罐发酵,成熟醪经釜式蒸馏后,所得酒被称为“斋酒”,斋酒陈酿一段时间后再经肥猪肉酝浸,最终形成具有豉香风味的白酒[2]。豉香型白酒醇和细腻、低度清淡的酒体风格,深受我国华南地区和东南亚地区消费者的认可[3]。
酒曲是我国白酒生产中必不可少的糖化发酵剂,在白酒酿造过程中,酒曲微生物的群落结构决定了其代谢产物的种类和数量,同时也决定了白酒风味物质的组成[4]。豉香型白酒的酒曲也称为酒饼,是由多种药材、谷物、饼泥、酒饼叶和水进行混合、压制、发酵而成,其微生物复杂繁多[5]。与其他香型白酒酒曲相比,豉香型白酒酒饼除了生产原料和酿造环境不同外,其独特之处在于添加了酒饼叶。酒饼叶是豉香型白酒酒饼制作过程中添加的带有特殊香气的叶子,属于中草药类,其可为酒饼有益微生物补充营养,使之快速成为优势菌种从而抑制杂菌的繁殖,同时还能引起白酒发酵过程中总酸、还原糖、酒精度等指标的变化,对稳定酒饼的质量具有重要作用[6-7]。研究表明,酒曲中的细菌在白酒酿造过程中具有产香、产酶等功效,其代谢产生的风味物质决定着白酒的品质[8]。因此,探究酒饼叶对豉香型白酒酒饼中细菌群落结构的影响,有利于认识酒饼叶在豉香型白酒酿造过程中的作用。
高通量测序技术具有速度快,准确率高等优点[9],已广泛用于白酒、土壤和水资源等微生物群落多样性的分析[10]。目前,豉香型白酒的研究仍处于发展阶段,其酒饼中包括细菌群落结构在内的微生物多样性尚不清晰,不利于豉香型白酒的更好发展。因此,本研究以添加不同比例酒饼叶获得的酒饼为研究对象,采用Illumina MiSeq高通量测序平台对细菌的16S rDNA V3~V4区进行测序,分析豉香型白酒酒饼细菌微生物菌群多样性,明确优势细菌菌群,以期为更好地提升豉香型白酒品质提供理论依据,对推动豉香型白酒发展具有一定现实意义。
1 材料与方法
1.1 材料
1.1.1 样品
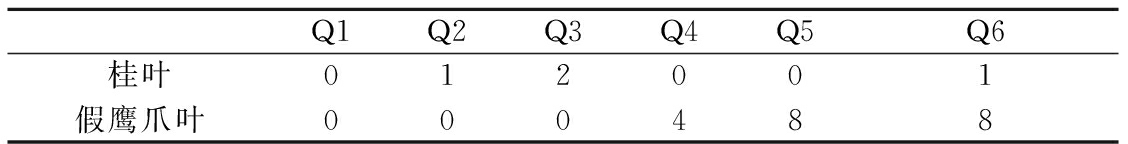
豉香型白酒的酒饼叶主要由肉桂(Cinnamomum cassia)、假鹰爪(Desmos chinensis)等植物叶子组成,为了探究桂叶、假鹰爪叶及传统工艺中其不同配比情况下对酒饼细菌多样性的影响,于2021年3月在广东省某酒厂正常生产车间以不同比例酒饼叶制取6种酒饼样品,具体比例如表1所示,其中酒饼叶为粉碎成豆粒大小的干叶,添加量为正常制曲工艺物料(不含酒饼叶)的质量分数。
表1 酒饼叶添加质量分数 单位:%
Table 1 Add proportion of herbal leaves
Q1Q2Q3Q4Q5Q6桂叶012001假鹰爪叶000488
生产完毕的6组酒饼分别运送至6个饼房中培养,饼房培养温度为30~38 ℃,最高品温48 ℃,培养周期为7 d,结束培养后,在每个饼房中分别从上层、中层和下层各取5个位置感官较好的酒饼[1](酒饼的取样标准为该酒厂内部酒饼的感官评价标准,评价依据为酒饼表面微白无异色,褶皱均匀,裂口大小适中,曲香正常无异味为感官较好的酒饼),如图1-a所示,每个酒饼的取样点为酒饼四角和中心位置,如图1-b所示。最后将上层、中层和下层取样位置的酒饼中5个部位的样品混合并粉碎均匀作为1个样品,尽量减少取样误差。样品采集完成后用无菌密封袋包装立即进行DNA提取。
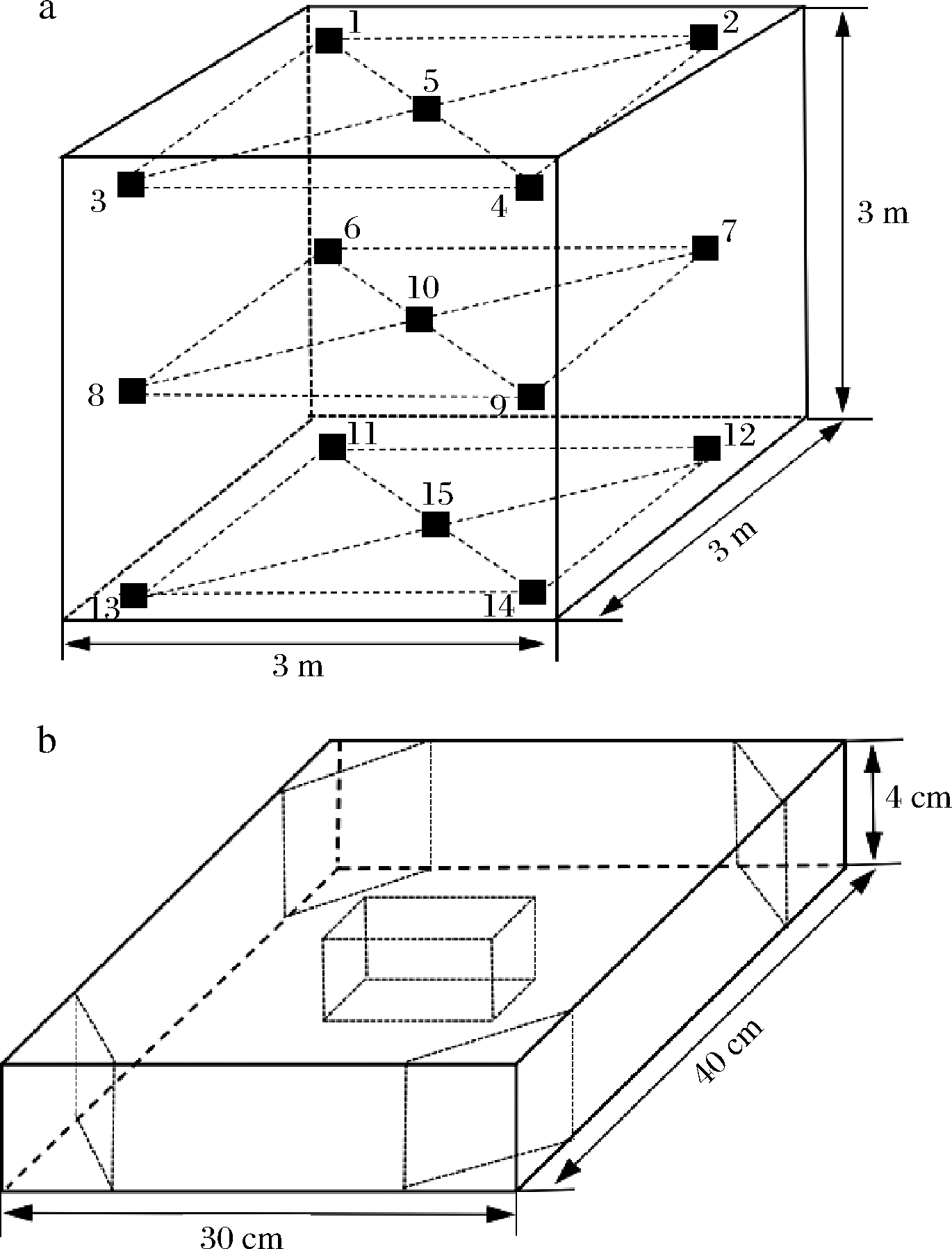
a-饼层中取样部位;b-酒饼取样部位
图1 饼房中酒饼取样部位示意图
Fig.1 Schematic diagram of Jiuqu sampling in culture room
1.1.2 试剂
D1600 DNA提取试剂盒,北京索莱宝科技有限公司;Omega D2500琼脂糖凝胶回收试剂盒,美国OMEGA公司;MiSeq试剂盒,美国Illumina公司。
1.1.3 仪器
ChemiDoc凝胶成像系统,美国Bio-Rad公司;DYY-6C型电泳仪,北京六一仪器厂;9700型PCR仪,美国ABI GeneAmp公司;ALLEGRA-64R高速冷冻离心机,美国BECKMAN COULTER公司;VM-01U涡旋振荡器,美国精骐公司。
1.2 实验方法
1.2.1 DNA的提取
将6种酒饼样品用6台粉碎机粉碎成粉末,称取每种样品各10 g,酒饼中微生物总DNA的提取按照DNA提取试剂盒中说明书的方法进行。
1.2.2 PCR扩增与测序
对细菌的16S rDNA V3~V4区进行测序,引物详情如表2所示。
表2 细菌PCR扩增引物
Table 2 Primers used for PCR amplification of bacterial

测序区域引物名称引物序列16S rDNA V3~V4区(细菌)338FACTCCTACGGGAGGCAGCAG806RGGACTACHVGGGTWTCTAAT
细菌PCR体系(20 μL):5×FastPfu Buffer 4 μL,dNTPs (2.5 mmol/L) 2 μL,Forward Primer (5 μmol/L) 0.8 μL,Reverse Primer(5 μmol/L) 0.8 μL,FastPfu Polymerase 0.4 μL,BSA 0.2 μL,Template DNA 10 ng,补充ddH2O至20 μL;反应条件:95 ℃预变性3 min,95 ℃变性1 min,55 ℃退火30 s,72 ℃延伸45 s(27次循环),最后72 ℃延伸10 min,10 ℃后停止。
PCR扩增结束后,利用DNA凝胶回收试剂盒对PCR产物进行定量,最后送到上海美吉生物医药科技有限公司进行Illunina MiSeq高通量测序。
1.3 数据处理
采用Uparse(version 7.0.1090, http://drive5.com/uparse/)软件在97%相似性对非重复序列进行可操作分类单元(operational taxonomic units,OTU)聚类分析。基于分类学信息,使用生信云平台对样品中物种多样性信息进行分析,并在特定分类水平上进行群落组成的统计。
2 结果与分析
2.1 酒饼中DNA的提取与定量
提取6个酒饼样品的DNA,测定其质量浓度与纯度,如表3所示。6个酒饼样品DNA的质量浓度为97.1~152.8 ng/μL,酒饼Q1与Q2之间不显著(P>0.05),酒饼Q1与酒饼Q3~Q6之间差异显著(P<0.05),说明单独添加1%的桂叶对质量浓度影响较小,其他比例酒饼叶对质量浓度影响较大。OD260/OD280值为1.71~1.82,酒饼Q1与Q6之间差异显著(P<0.05),酒饼Q1与Q2~Q5之间差异不显著(P>0.05),说明1%的桂叶和8%的假鹰爪叶混合生产的酒饼对OD260/OD280值影响较大,其他比例酒饼叶对OD260/OD280值影响较小。OD260/OD230值为0.27~0.71,酒饼Q2与Q3、Q4与Q5、Q1与Q6之间不显著(P>0.05),酒饼Q4、Q5与Q1、Q6与Q2、Q3之间差异显著(P<0.05),说明单独添加不同比例的桂叶或假鹰爪叶对OD260/OD230值影响较小,不同种类酒饼叶之间的OD260/OD230值影响较大。酒饼DNA质量浓度分析结果表明,不同酒饼之间质量浓度虽有差异,但提取的酒饼DNA浓度较纯,适用于酒饼细菌多样性的分析。
表3 酒饼中DNA质量浓度分析
Table 3 Microbial DNA concentrations from Jiuqu

样品名称质量浓度/(ng·μL-1)OD260/OD280OD260/OD230Q1152.867±0.78a1.713±0.02b0.273±0.02cQ2152.367±1.02a1.79±0.03ab0.356±0.03bQ3122.767±1.40b1.77±0.04ab0.423±0.04bQ4 97.1±1.27c1.76±0.03ab0.713±0.01aQ5 146±0.05d1.78±0.05ab0.707±0.03aQ6118.567±1.61e1.82±0.05a0.277±0.04c
注:同列数值肩标字母不同表示差异显著(P<0.05)(下同)
2.2 细菌丰富度和多样性分析
α多样性即复杂度,可以反映群落的物种丰富度和微生物多样性,主要包括OTU数、Shannon指数和Chao指数等,Chao指数越大,代表样品丰富度越高;Shannon指数越大,代表样品多样性越高[11]。6组酒饼样品中的有效序列数为30 188~35 587,Chao指数为30.74~49,Shannon指数为0.88~1.67,基于97%的相似度其OTU数为28~46,覆盖率范围是99.96%~99.98%,充分说明了本研究检测的OTU能基本反映酒饼样品的细菌群落组成。由表4可知,酒饼Q1、Q2、Q3反映的是桂叶添加量对酒饼细菌多样性的影响。酒饼Q1分别与Q2、Q3之间Chao指数差异不显著(P>0.05),酒饼Q2与Q3之间差异显著(P<0.05),说明单独添加1%桂叶和单独添加2%桂叶的酒饼之间细菌菌群丰富度有明显差异;这3个样品的Chao指数(细菌菌群的丰富度)随着桂叶添加量的增加而先降低后升高,说明单独添加1%的桂叶对其丰富度有一定抑制作用,而单独添加2%的桂叶对其丰富度有促进作用。酒饼Q1分别与Q2、Q3之间Shannon指数差异显著(P<0.05),酒饼Q2与Q3之间差异不显著(P>0.05),说明有无桂叶添加的酒饼之间细菌群落多样性有明显差异;这3个样品的Shannon指数逐渐升高,说明在一定范围内逐渐增加桂叶添加量可以提高酒饼细菌群落多样性。Chao指数和Shannon指数均说明单独添加2%的桂叶时,酒饼细菌群落多样性较为丰富。
表4 酒饼样品细菌测序数据统计分析
Table 4 Statistical analysis of bacterial sequencing data in Jiuqu samples
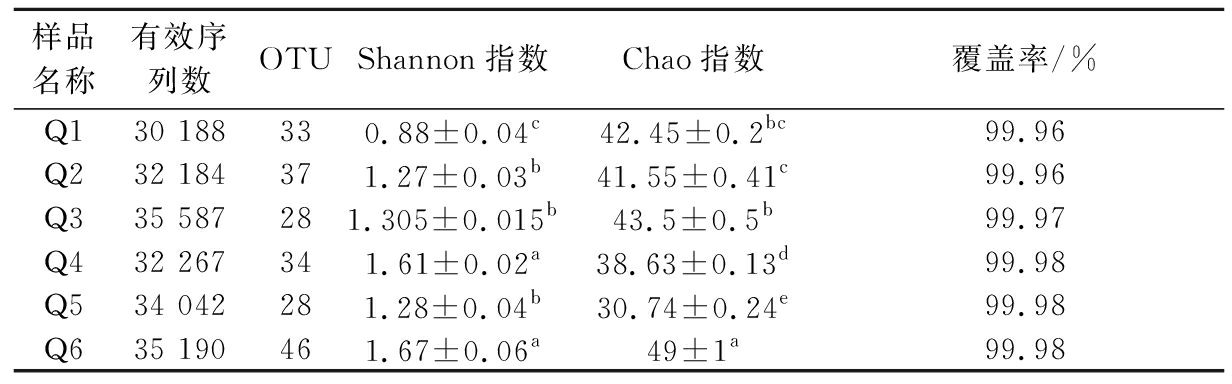
样品名称有效序列数OTUShannon指数Chao指数覆盖率/%Q130 188330.88±0.04c42.45±0.2bc99.96Q232 184371.27±0.03b41.55±0.41c99.96Q335 587281.305±0.015b43.5±0.5b99.97Q432 267341.61±0.02a38.63±0.13d99.98Q534 042281.28±0.04b30.74±0.24e99.98Q635 190461.67±0.06a49±1a99.98
酒饼Q1、Q4、Q5 3个样品反映的是假鹰爪叶添加量对酒饼细菌多样性的影响。酒饼Q1、Q4、Q5之间Chao指数差异显著(P<0.05),说明添加假鹰爪叶会对酒饼细菌菌群丰富度产生显著影响;3个样品的Chao指数逐渐降低,表明在一定范围内增加假鹰爪叶添加量对酒饼细菌群落丰富度有抑制作用。酒饼Q1、Q4、Q5之间Shannon指数差异显著(P<0.05),说明添加假鹰爪叶会对酒饼之间细菌群落多样性产生显著影响;这3个样品的Shannon指数先升高后降低,说明单独添加4%的假鹰爪叶对酒饼细菌群落多样性有促进作用,添加量过高时(8%)会对其细菌群落多样性有抑制作用。
酒饼Q6是按传统工艺酒饼叶添加比例生产的酒饼。结果表明,酒饼Q6与其他5组酒饼样品之间Chao指数差异显著(P<0.05),说明其细菌群落丰富度与其他5组样品之间有明显差异;酒饼Q6与Q4之间Shannon指数差异不显著(P>0.05),与其他4组样品之间差异显著(P<0.05),说明了1%的桂叶和8%的假鹰爪叶混合生产的酒饼与单独添加4%假鹰爪叶的酒饼之间细菌多样性差异较小,与其他4组之间细菌多样性差异较大;同时,6组酒饼样品中,酒饼Q6的Chao指数和Shannon指数均是最高,说明1%的桂叶和8%的假鹰爪叶混合生产的酒饼能够显著提高酒饼细菌群落的丰富度和多样性。
2.3 细菌群落分布与组成分析
2.3.1 细菌的群落分布
在属分类水平上,6组酒饼样品中共检测出85个细菌属(相对丰度≥1%)。采用韦恩图分别统计Q1空白组(KB)、Q2和Q3桂叶组(GY)、Q4和Q5假鹰爪叶组(JY)、Q6传统工艺组(CT)样品中共有和独有的细菌属。如图2所示,不同比例酒饼叶制成的6组酒饼中共有细菌属14个,占细菌属总数的41.18%;空白组、桂叶组、假鹰爪组之间,桂叶组、假鹰爪叶组、传统工艺组之间和假鹰爪叶组、传统工艺组、空白组之间均无共有细菌属;传统工艺组与其他组之间均有2个共有菌属,各组中的特有菌属分别为空白2个,桂叶0个,假鹰爪4个,传统工艺5个,其中传统工艺组的特有菌属数量最多,说明1%桂叶和8%假鹰爪叶的传统工艺组酒饼与其他酒饼细菌属之间具有一定相似性,同时其细菌属种类最丰富。

图2 不同分组酒饼样品细菌属水平韦恩图
Fig.2 Venn diagram of bacteria in Jiuqu sample at genus level from different groups
2.3.2 细菌群落分组成分析
如图3所示,在门分类水平上,酒饼样品中优势菌门为厚壁菌门(Firmicutes),其相对丰度大于99%,明显高于其他菌门。黎江华等[12]研究发现,五味子发酵用酒曲的优势菌门是厚壁菌门和担子菌门(Basidiomycota),其中厚壁菌门的丰富度达到72%,占主导地位;四川郎酒厂研究大曲发酵过程中,变形菌门(Proteobacteria)丰度变小,厚壁菌门丰度增加,厚壁菌门在高温大曲发酵和储存过程中起着关键作用[13]。本研究豉香型白酒酿造过程中,厚壁菌门也是其酒饼的主要优势菌门。

图3 酒饼样品细菌门水平群落组成
Fig.3 Bacterial community composition of Jiuqu samples at phylum level
此研究还发现,豉香型白酒酒饼中的变形菌门相对含量较少,与其他米酒酒曲中变形菌门相对含量比较高的结果不一致。变形菌门中某些菌种具有一定的致病性,如绿脓杆菌(Pseudomonas aeruginosa)能够导致甲沟炎的发生[14];肺炎克雷伯菌(Klebsiella pneumoniae)[15]和成团泛菌(Pantoea agglomerans)[16]对于某些抗生素具有一定的抗性作用,可能引发炎症;而豉香型白酒酒饼中变形菌门含量较少,在一定程度上避免了类似疾病的发生。
如图4所示,在属分类水平上,酒饼样品中优势菌属为乳杆菌属(Lactobacillus)、片球菌属(Pediococcus)和魏斯氏菌属(Weissella),相对丰度均大于1%,同时,所有样品中乳杆菌属占据较大比例,其相对丰度在75%以上,是酒饼样品中丰度最高的细菌菌属。而在其他酒曲中主要优势细菌群有芽孢杆菌属、片球菌属、红球菌属、罗尔斯顿菌属和海洋杆菌属等,说明豉香型白酒酒饼与其他酒曲中优势细菌群存在一定的差异[17-18]。

图4 酒饼样品细菌属水平群落组成
Fig.4 Bacterial community composition of Jiuqu samples at genus level
由图4可知,酒饼Q1、Q2、Q3的乳杆菌属相对丰度随着桂叶添加量的增加而逐渐减少,说明在一定范围内逐渐增加桂叶添加量可以降低乳杆菌属相对丰度。由酒饼Q1、Q4、Q5可知,添加假鹰爪叶可以降低乳杆菌属的相对丰度,但单独添加8%假鹰爪叶的酒饼中乳杆菌属的相对丰度高于单独添加4%假鹰爪叶的酒饼,即在一定范围内逐渐增加假鹰爪叶添加量也能够提高乳杆菌属相对丰度,表明单独假鹰爪叶对乳杆菌属的相对丰度作用效果不明显。与酒饼Q1相比,Q6的乳杆菌属相对丰度减少了15.43%,表明1%桂叶和8%假鹰爪叶混合添加对乳杆菌属丰度具有一定的抑制效果,但同时酒饼Q6中片球菌属和魏斯氏菌属的相对丰度有所增加,也表明了此添加比例也能够丰富酒饼的细菌群落多样性。即便丰度有所下降,乳杆菌属仍是各组酒饼中丰度最高的菌属,其在酒饼中的重要作用是不可忽视的。乳杆菌属是乳酸菌中的重要菌属之一,研究认为乳酸菌具有促进美拉德反应、酵母发酵和维持酿酒生态环境等作用,其主要代谢产物乳酸是形成乳酸乙酯和一些其他香味物质的重要物质[19]。张艳等[20]研究发现,乳杆菌可促进酵母生长代谢,以维持和促进主要酵母在白酒发酵过程中的优势地位,从而影响着白酒中的酸类、酯类和醇类等一些风味物质的形成,促进白酒品质提升。
片球菌属的相对丰度为6.49%~11.53%,也是豉香型白酒酒饼中的优势菌属之一,在海南山兰米酒酒曲[21]和建始地区米酒酒曲[22]中也发现一定丰度的片球菌属,可见,片球菌属在酒曲中具有重要作用。由Q1~Q5组片球菌属分布图可知,单独添加桂叶或单独添加假鹰爪叶均可以增加片球菌属的丰度,其变化趋势为:随着桂叶添加量的增加,片球菌属丰度增幅减小,说明在一定范围内逐渐增加桂叶添加量可以降低片球菌属相对丰度;随着假鹰爪叶添加量的增加,片球菌属丰度增加,说明在一定范围内逐渐增加假鹰爪叶添加量可以提高片球菌属相对丰度;而通过分析酒饼Q1和Q6发现,Q6组酒饼的片球菌属丰度虽不如单独添加桂叶和假鹰爪叶的Q2~Q5组,但其总体丰度还是高于空白组酒饼Q1,说明1%桂叶和8%假鹰爪叶混合组提高片球菌属丰度的效果低于单独添加桂叶组或假鹰爪叶组。
魏斯氏菌属的相对丰度为1.01%~14.95%,通过酒饼Q1与其他5组酒饼对比可知,添加酒饼叶即可增加魏斯氏菌属相对丰度;由Q1、Q2和Q3组可知,在一定范围内逐渐增加桂叶添加量可以提高魏斯氏菌属相对丰度;由Q1、Q4和Q5组可知在一定范围内逐渐增加假鹰爪叶添加量可以降低魏斯氏菌属相对丰度;酒饼Q6中魏斯氏菌属相对丰度是空白组Q1的14倍左右,说明1%桂叶和8%假鹰爪叶混合组酒饼可以显著提高魏斯氏菌属丰度。沈馨等[23]将孝感地区3个凤窝酒曲作为研究对象对其细菌菌群结构进行研究,结果发现魏斯氏菌属是其9个优势核心菌群之一,平均相对含量为12.15%,在核心菌属中排名第3位,这表明魏斯氏菌属也是其他酒曲的优势菌属。
2.4 细菌微生物群落相似性分析
主成分分析可以直观地在坐标图上表示出样品之间的相似性或差异性,点间距越小表明相似性越高[24]。如图5-a所示,主成分1和主成分2解释了酒饼样品中86.02%和8.45%的细菌群落信息,两成分之和大于80%,可以反映样品中的细菌群落信息。酒饼Q2、Q3、Q5样品之间距离最近,差异性不大,说明单独添加1%、2%的桂叶或8%的假鹰爪叶的酒饼可以形成相似的细菌群落;酒饼Q1分别与Q2、Q3、Q5和酒饼Q4、Q6之间距离较远,说明不添加任何酒饼叶的酒饼与添加酒饼叶的酒饼之间差异性较大,细菌群落相似性低;酒饼Q1与Q6之间的距离最远,同时也说明了1%的桂叶和8%的假鹰爪叶混合生产的酒饼更能丰富酒饼细菌群落丰度,与细菌群落丰度和多样性的研究一致。
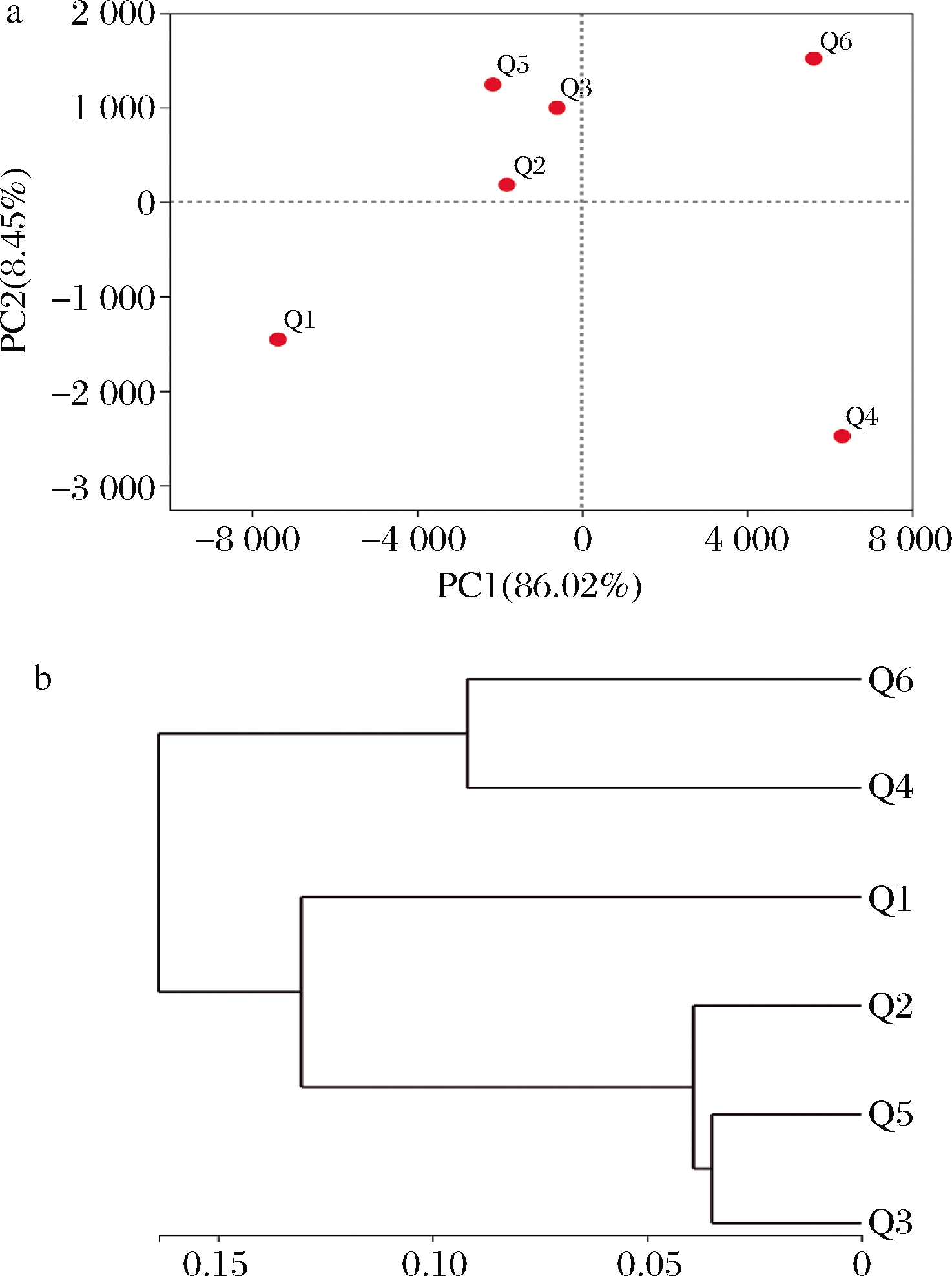
图5 细菌群落主成分分析(a)和β多样性距离的样本层级聚类树(b)
Fig.5 Principal coordinate analysis diagram of bacterial communities (a) and hierarchical clustering tree of β diversity distance (b)
通过对酒饼样品细菌β多样性距离矩阵进行层级聚类分析,构建样品的层级聚类树,根据不同的距离阈值可以将样品划分为凝聚的小组,从而研究样品之间的相似性和差异性[25]。图5-b中,β多样性分析结果与主成分分析结果相似。酒饼Q2与Q3、Q5的细菌属聚为一类,亲缘关系较近,说明单独添加1%、2%的桂叶或8%的假鹰爪叶酒饼具有相似的细菌群落结构;酒饼Q1分别与酒饼Q2、Q3、Q5和酒饼Q4、Q6聚为不同类,亲缘关系较远,说明不添加任何酒饼叶的酒饼与添加酒饼叶的酒饼之间细菌群落差异性较大,同时也说明了添加一定比例的酒饼叶可以形成不同的细菌群落结构,对于酒饼的细菌多样性具有重要作用。
3 结论
本文采用高通量测序技术对豉香型白酒酒饼中的细菌群落多样性进行分析,由不同组合的酒饼叶对细菌多样性的影响进行了评估及优势菌群组成进行了初步判定。结果发现,单独添加2%的桂叶对酒饼细菌群落丰富度有促进作用;单独添加4%的假鹰爪叶对酒饼细菌群落多样性有促进作用;1%的桂叶和8%的假鹰爪叶混合生产的酒饼能够显著提高酒饼细菌群落的丰富度和多样性。在门分类水平上,厚壁菌门是豉香型白酒酒饼的主要优势菌门;在属水平上,主要优势细菌属是乳杆菌属、片球菌属和魏斯氏菌属,与其他酒曲中细菌优势菌群存在一定的差异。在酒饼中添加酒饼叶能够降低乳杆菌属相对丰度,提高片球菌属和魏斯氏菌属的相对丰度,其中1%桂叶与8%假鹰爪叶混合添加可以明显提高魏斯氏菌属的相对丰度以及降低乳杆菌属相对丰度,单独添加1%桂叶的酒饼可以显著提高片球菌属的相对丰度。此外,6组酒饼样品中还存在一部分未鉴定的其他菌属,表明酒饼中还有丰富的未知菌有待进一步挖掘。通过细菌群落组成、丰富度和相似性等分析发现酒饼叶对于豉香型白酒酒饼的细菌群落多样性具有重要影响,该研究结论对豉香型白酒的生产具有积极的理论和实践意义。
[1] 左乾程, 黄永光, 朱家合, 等.清酱香型白酒冬季发酵细菌群落演替及堆积过程细菌来源解析[J].食品科学, 2021, 42(12):145-152.
ZUO Q C, HUANG Y G, ZHU J H, et al.Analysis of bacterial community succession and bacterial sources during fermentation of Chinese light/sauce-flavored liquor in winter[J].Food Science, 2021, 42(12):145-152.
[2] 潘丽娟, 赖嘉雯, 赵文红, 等.豉香型白酒研究现状[J].中国酿造, 2020, 39(10):21-25.
PAN L J, LAI J W, ZHAO W H, et al.Research progress of Chi-flavor Baijiu[J].China Brewing, 2020, 39(10):21-25.
[3] 黄清意, 李湘銮, 费永涛, 等.陈肉酝浸对豉香型白酒风味影响的研究进展[J].食品与发酵工业, 2020, 46(19):284-288.
HUANG Q Y, LI X L, FEI Y T, et al.Advances on the meat immersion and its effect on Chi-flavor Baijiu[J].Food and Fermentation Industries, 2020, 46(19):284-288.
[4] 王柏文, 吴群, 徐岩, 等.中国白酒酒曲微生物组研究进展及趋势[J].微生物学通报, 2021, 48(5):1 737-1 746.
WANG B W, WU Q, XU Y, et al.Recent advances and perspectives in study of microbiome in Chinese Jiuqu starter[J].Microbiology China, 2021, 48(5):1 737-1 746.
[5] 谭莹, 郭波, 梁思宇.大酒饼在豉香白酒酿造中的作用和特色[J].酿酒科技, 2020(2):116-120.
TAN Y, GUO B, LIANG S Y.Function and characteristics of cake-shape xiaoqu in the production of Chixiang Baijiu[J].Liquor-Making Science & Technology, 2020(2):116-120.
[6] 谷雪峰. 酒饼叶对豉香型白酒酒曲微生物及风味成分的调节作用[D].广州:华南理工大学, 2016.
GU X F.Effects of herbial leaves on the rice wine starter microorganisms and aroma compounds of Chi-flavour liquor[D].Guangzhou:South China University of Technology, 2016.
[7] 吴琼燕. 中草药对甜酒曲微生物发酵性能及酒酿香气成分研究[D].广州:华南农业大学, 2016.
WU Q Y.Research on the fermentation properties of main microbes in herbal starter and aroma volatile compounds of sweet rice wine[D].Guangzhou:South China Agricultural University, 2016.
[8] 管健, 廖蓓, 李兆飞, 等.白酒功能菌的功能特性及应用研究[J].中国酿造, 2017, 36(8):1-5.
GUAN J, LIAO B, LI Z F, et al.Functional properties and application of functional microbes in Baijiu production[J].China Brewing, 2017, 36(8):1-5.
[9] MARGULIES M, EGHOLM M, ALTMAN W E, et al.Genome sequencing in microfabricated high-density picolitre reactors[J].Nature, 2005, 437:376-380.
[10] JIN Y, LI D Y, AI M, et al.Correlation between volatile profiles and microbial communities:A metabonomic approach to study Jiang-flavor liquor Daqu[J].Food Research International, 2019, 121:422-432.
[11] ERCOLINI D.High-throughput sequencing and metagenomics:Moving forward in the culture-independent analysis of food microbial ecology[J].Applied and Environmental Microbiology, 2013, 79(10):3 148-3 155.
[12] 黎江华, 刘超兰, 冯兴, 等.高通量测序分析五倍子发酵用酒曲与酒糟微生物多样性[J].中成药, 2020, 42(8):2 113-2 118.
LI J H, LIU C L, FENG X, et al.Research on the microbial diversity of distiller’s yeast and distillers’ grains in fermentation of Galla chinensis by high-throughput sequencing analysis[J].Chinese Traditional Patent Medicine, 2020, 42(8):2 113-2 118.
[13] 付绍鸿, 赵荣寿, 杨柳, 等.高温大曲发酵过程中微生物多样性研究[J].酿酒科技, 2019(3):76-79.
FU S H, ZHAO R S, YANG L, et al.Microbial diversity in the fermentation process of high-temperature Daqu[J].Liquor-Making Science & Technology, 2019(3):76-79.
[14] CHIRIAC A, BRZEZINSKI P, FOIA L, et al.Chloronychia:Green nail syndrome caused by Pseudomonas aeruginosa in elderly persons[J].Clinical Interventions in Aging, 2015, 10(1):265-267.
[15] TASCINI C, VIAGGI B, MENICHETTI F.Comment on:Infections caused by KPC-producing Klebsiella pneumoniae:Differences in therapy and mortality in a multicentre study[J].The Journal of Antimicrobial Chemotherapy, 2015, 70(10):2921.
[16] DUTKIEWICZ J, MACKIEWICZ B, KINGA LEMIESZEK M, et al.Pantoea agglomerans:A mysterious bacterium of evil and good.Part III.Deleterious effects:Infections of humans, animals and plants[J].Annals of Agricultural and Environmental Medicine, 2016, 23(2):197-205.
[17] TANG Q X, HE G Q, HUANG J, et al.Characterizing relationship of microbial diversity and metabolite in Sichuan Xiaoqu[J].Frontiers in Microbiology, 2019, 10:696.
[18] WANG J, ZHONG Q P, YANG Y Y, et al.Comparison of bacterial diversity between two traditional starters and the round-koji-maker starter for traditional Cantonese Chi-flavor liquor brewing[J].Frontiers in Microbiology, 2018, 9:1053.
[19] 成林, 成坚, 王琴, 等.酒曲微生物菌群对酿造酒产品风味影响的研究进展[J].中国酿造, 2020, 39(10):1-4.
CHENG L, CHENG J, WANG Q, et al.Research progress on the effect of Jiuqu microbial flora on the flavor of brewed alcoholic drink[J].China Brewing, 2020, 39(10):1-4.
[20] 张艳, 杜海, 吴群, 等.酱香型白酒发酵中两株主要乳酸菌对酿造微生物群体的影响[J].微生物学通报, 2015, 42(11):2 087-2 097.
ZHANG Y, DU H, WU Q, et al.Impacts of two main lactic acid bacteria on microbial communities during Chinese Maotai-flavor liquor fermentation[J].Microbiology China, 2015, 42(11):2 087-2 097.
[21] 杨春敏, 黄建初, 查丽艳.海南山兰米酒酒曲微生物多样性分析[J].食品工程, 2019(4):44-48;59.
YANG C M, HUANG J C, ZHA L Y.Analysis of microbial community diversity in Hainan Shanlan rice wine[J].Food Engineering, 2019(4):44-48;59.
[22] 向凡舒, 朱媛媛, 邓风, 等.建始地区米酒曲细菌和真菌多样性研究[J].食品工业科技, 2021, 42(1):126-131.
XIANG F S, ZHU Y Y, DENG F, et al.Bacterial and fungal diversity of rice wine koji in Jianshi aera[J].Science and Technology of Food Industry, 2021, 42(1):126-131.
[23] 沈馨, 尚雪娇, 董蕴, 等.基于MiSeq高通量测序技术对3个孝感凤窝酒曲细菌多样性的评价[J].中国微生态学杂志, 2018, 30(5):525-530;544.
SHEN X, SHANG X J, DONG Y, et al.The diversity of 3 bacterial strains in the koji of Xiaogan Fengwo rice wine by MiSeq high throughput sequencing[J].Chinese Journal of Microecology, 2018, 30(5):525-530;544.
[24] 宁亚丽, 吴跃, 何嫱, 等.基于高通量测序技术分析朝鲜族传统米酒及其酒曲中微生物群落多样性[J].食品科学, 2019, 40(16):107-114.
NING Y L, WU Y, HE Q, et al.Analysis of microbial community diversity in Chinese Korean traditional rice wine and its starter culture using high-throughput sequencing[J].Food Science, 2019, 40(16):107-114.
[25] 唐凯, 贾丽娟, 高晓丹, 等.浑善达克沙地生物土壤结皮及其下层土壤中好氧不产氧光营养细菌群落结构及多样性[J].微生物学报, 2018, 58(2):228-237.
TANG K, JIA L J, GAO X D, et al.Community structure and diversity of aerobic anoxygenic phototrophic bacteria in soil crusts and subsoil of Hunshandake deserts[J].Acta Microbiologica Sinica, 2018, 58(2):228-237.