与常温酸奶不同,低温酸奶没有杀菌工序,因此需要低温储运和销售。低温酸奶中含有大量活的乳酸菌,且发酵作用使得酸奶比纯鲜奶更易被消化、吸收,因此特别适合乳糖不耐症患者饮用。酸奶因受到消费者的喜爱,成为乳品企业竞相研发的发酵乳品类之一[1]。然而,酸奶在加工、运输、储藏、销售等过程中极易被微生物污染,导致其在保质期内产生胀包、鼓盖、发霉、口味改变等现象,其中微生物中霉菌的污染最为频繁严重[2]。据统计,真菌造成了发展中国家所有食物浪费和损失的5%~10%,其中乳制品如奶酪和酸奶更易受到真菌腐败的影响[3-4]。因此,研发安全高效抑制腐败真菌生长的抑菌剂至关重要。
然而,使用化学防腐剂如山梨酸钾等会引发消费者对健康的担忧从而使消费者对酸奶的“天然”吸引力降低[5]。乳酸菌代谢物作为天然生物防腐剂具有无毒、无害、抗菌性强、作用广等优点,因而受到越来越多的关注[4,6]。MORADI等[7]研究表明乳酸菌发酵产生的代谢物能够显著抑制李斯特菌生长;PILOTE-FORTIN等[8]发现罗伊氏乳杆菌发酵甘油产生的罗氏菌素(reuterin)对胶红酵母、黑曲霉、青霉和毛霉菌有强烈抑制作用,其抑制能力与纳他霉素相当。此外,丙酸杆菌产生的发酵液提取物能够抑制腐败微生物,且其作为防腐剂已应用到肉制品中[9-10]。发酵乳清粉是以植物乳杆菌为主混合发酵乳清粉,再经喷雾干燥等加工工序制成的新型食品防腐保鲜剂。目前发酵乳清粉在鲜湿面、糕点、肉制品的防腐保鲜应用中效果较好,其对细菌的抑制作用已经得到确认,但迄今为止未见其对酸奶中霉菌抑制作用的报道。本研究从126份市售低温酸奶中分离优势霉菌,研究发酵乳清粉对它们的抑制作用,并进一步将其应用到酸奶中测试抑菌效果,为发酵乳清粉作为生物防霉剂的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
发酵乳清粉,河南麦瑞克有限公司。据该公司自述,发酵乳清粉是利用自有发明专利技术(专利号为:ZLCN201911112283.8),利用植物乳杆菌为主的混合菌种发酵乳清粉制成,主要发酵产物为混合有机酸和多肽;126份低温酸奶,市售;虎红培养基、乳酸酚棉蓝染色液,南京翼飞雪生物科技有限公司。
马铃薯琼脂培养基(potato detrose agar,PDA)(g/L):土豆200、葡萄糖20、琼脂15。121 ℃灭菌20 min。
马铃薯肉汤培养基(potato detrose broth,PDB)(g/L):土豆200,葡萄糖20。121 ℃灭菌20 min。
1.2 仪器与设备
LDZX-40AI型立式电热压力灭菌锅,上海申安医疗器械厂;AUY-120型分析天平,日本岛津公司;YT-CJ-1D型超净工作台,北京亚太科隆仪器技术有限公司;LRH-150系列生化培养箱,上海益恒科学仪器有限公司;QK-1536型电子数显卡尺,奇亦克尺业有限公司;THZ-Q型台式冷冻恒温振荡器,太仓市华美生化仪器厂;AIPHAPPHOT-2 YS2型光学显微镜,日本Nikon公司;GZX-9140 MBE型数显鼓风干燥箱,上海博讯实业有限公司医疗设备厂;SU8010型电子扫描显微镜,日本HITACHI公司。
1.3 实验方法
1.3.1 酸奶中污染霉菌的分离与纯化
市售低温酸奶购买后立即无菌分装于培养皿中,置于28 ℃恒温箱中静置培养7~10 d。待酸奶表面长出霉菌菌落后挑取其中少许菌丝,点植法接种到PDA培养基或虎红培养基中,纯化2~3次,并移接至斜面试管中,4 ℃保存[11]。
1.3.2 酸奶中污染霉菌的形态学观察和分子生物学鉴定
28 ℃恒温箱静置培养5~7 d,观察菌落的大小、颜色、质地等形态特征,染色制片,在显微镜下观察菌株的菌丝及分生孢子头等形态特征。纯化霉菌菌株送至上海生工生物工程有限公司测序,以ITS1(5′-TCCGTAGGTAACCTGCGG-3′)为正向引物,ITS4(5′-TCCTCGCTTATTGATATGC-3′)为反向引物扩增菌株序列,所得序列提交到GenBank(http://www.ncbi.nlm.nih.gov)进行注册并获得序列登录号,测序结果在NCBI中进行blast比对,确定种属。
1.3.3 发酵乳清粉对污染霉菌孢子萌发的抑制作用
1.3.3.1 孢子悬浮液的制备
用无菌生理盐水洗下斜面培养的霉菌孢子,通过4层纱网过滤到50 mL灭菌的三角瓶中,得到孢子悬浮液,用血球计数板在显微镜下观察,按照公式(1)计算孢子数[12]:
(1)
式中:N,孢子总数,CFU/mL;N1,血球计数板中5个大方格孢子总数,CFU/mL;D,稀释倍数。
1.3.3.2 孢子萌发抑制率的测定
将发酵乳清粉添加到PDB培养基中,使其质量浓度为1、3、5、8、10 g/L,调整pH为10.0, 121 ℃,灭菌20 min;将2 mL霉菌的孢子悬浮液(107 CFU/mL)接种到培养基中,28 ℃、180 r/min摇床培养,每隔2 h显微镜观察孢子萌发情况[13],以不添加发酵乳清粉的PDB作为对照组。
1.3.4 发酵乳清粉对菌落生长及生物量的抑制作用
1.3.4.1 发酵乳清粉对霉菌菌落生长抑制作用
参考的任苗苗等[14]的方法,并稍做修改。将菌丝接种到发酵乳清粉质量浓度为1、3、5、8、10 g/L的PDA平板上,置于28 ℃培养箱静置培养,通过游标卡尺十字交叉法,每24 h测定菌落的直径,按照公式(2)计算抑制率,以不添加发酵乳清粉的PDA作为空白对照组。
抑制率![]()
(2)
式中:dc,对照组菌落直径,mm;dt,试验组菌落直径,mm。
1.3.4.2 发酵乳清粉对菌丝生物量的影响
参考SHARMA等[15]的方法,并稍作修改。将100 μL霉菌的孢子悬浮液(107 CFU/mL)接种到发酵乳清粉质量浓度为1、3、5、8、10 g/L的20 mL PDB培养基中,28 ℃,180 r/min摇床培养48 h后,过滤、收集菌丝、称量并置于烘箱中干燥至恒重。
1.3.5 发酵乳清粉对霉菌细胞结构的影响
将菌丝接种到10 g/L发酵乳清粉的PDA培养基上,以不加发酵乳清粉的PDA培养基为对照,置于28 ℃恒温培养3 d,取菌丝体制作样本用透射电镜和扫描电镜观察霉菌菌丝体细胞形态[16]。
1.3.6 发酵乳清粉在酸奶防霉中的应用
将霉菌孢子悬浮液(104 CFU/g)与商业酸奶发酵剂同时接种巴氏消毒牛奶,42 ℃恒温发酵6~8 h后,添加发酵乳清粉使其质量浓度为1、3、5、8、10 g/L,置于4 ℃冰箱后熟过夜,在28 ℃恒温箱中储藏21 d,观察其长霉情况,并以不添加发酵乳清粉的酸奶为对照组[17]。
1.3.7 数据处理与统计分析
发酵乳清粉的抑霉试验重复3次,数据均采用“平均值±标准差”表示。实验数据采用Excel处理,Origin 2018绘图,SPSS 25.0统计软件进行单因素ANOVA判断(邓肯检验),P<0.05表示具有显著性差异。
2 结果与分析
2.1 低温酸奶中霉菌的分离鉴定及优势污染菌的确定
从市售126份低温酸奶中共分离到43株霉菌。根据形态学特征和ITS序列分析鉴定为22株曲霉菌(Aspergillus),占分离株的51.16%,其中9株鉴定为杂色曲霉(A. versicolor),5株为肉色曲霉(A.carneus),4株为假灰绿曲霉(A.pseudoglaucus),3株为甘曲霉(A.jensenii),1株为薛氏曲霉(A.chevalieri);15株青霉菌(Penicillium),占分离株的34.88%,其中8株为桔青霉(P. citrinum),4株为鲜红青霉(P.chermesinum),3株为斜卧青霉(P.decumbens);此外,4株为枝状枝孢霉(Cladosporium cladosporioides)和2株白囊耙齿菌(Irpex lacteus),其分离的频率分别为9.30%和4.65%。上述10个种(共计13株)霉菌的菌落及显微形态见图1,其分子序列分析结果见表1。
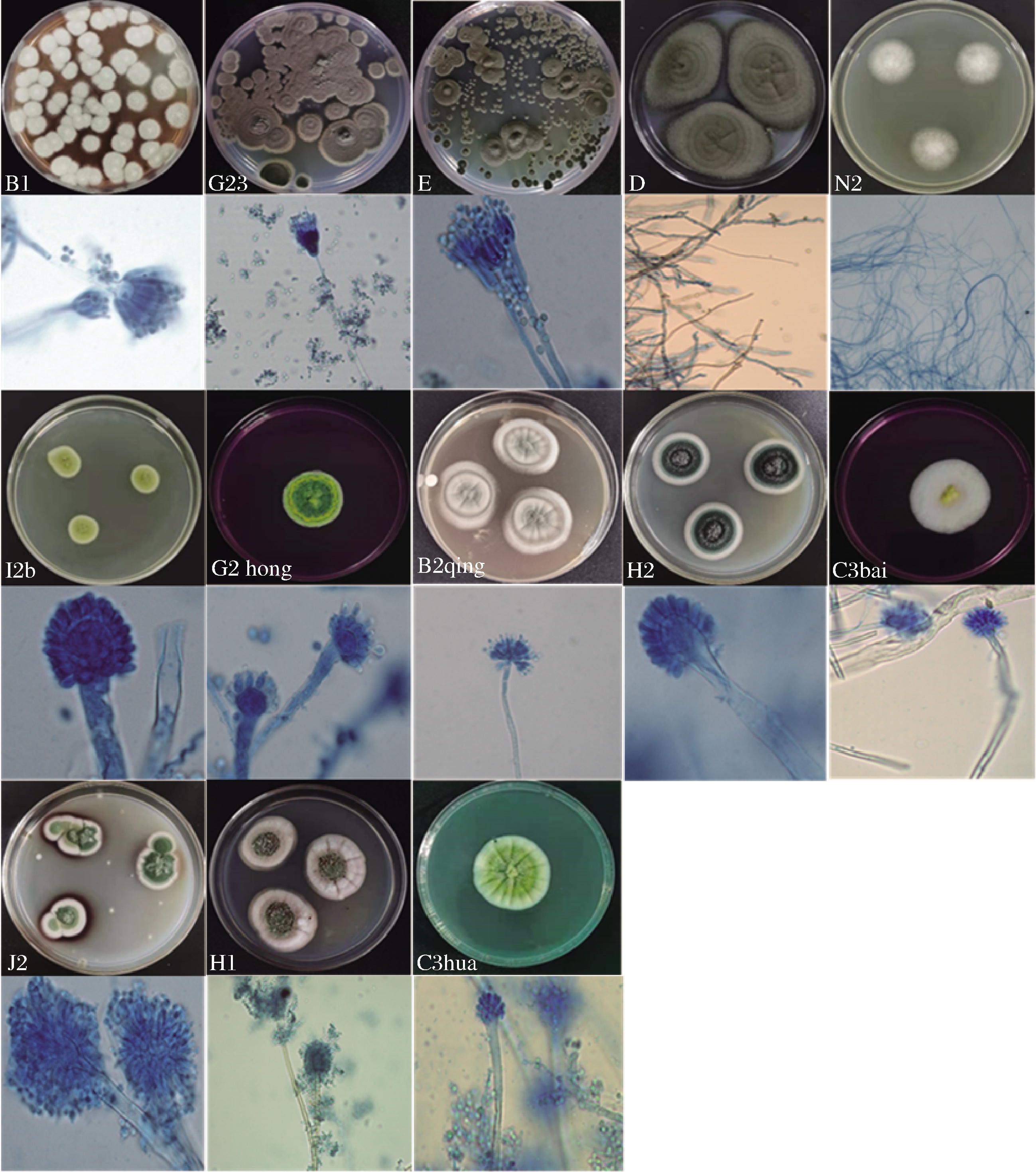
图1 低温酸奶污染霉菌的菌落和显微形态图
Fig.1 Colony and microscopic morphology of the contaminated molds from low-temperature yogurt
表1 十三株污染霉菌的序列分析结果
Table 1 Sequence analysis of 13 the contaminated mold

菌株编号登录号种-拉丁名种-中文名序列相似性/%分离频率/%B1OK135706Penicillium chermesinum鲜红青霉999.30G23OK143215Penicillium decumbens斜卧青霉996.98EOK135705Penicillium citrinum桔青霉10018.60DOK135707Cladosporium cladosporioides枝状枝孢霉1009.30N2OK135708Irpex lacteus耙齿菌1004.65I2bOK135703Aspergillus pseudoglaucus假灰绿曲霉1009.30G2hongOK135704Aspergillus chevalieri薛氏曲霉1002.33B2qingOK135697Aspergillus versicolor杂色曲霉10016.28H2OK135698Aspergillus versicolor杂色曲霉994.65C3baiOK135702Aspergillus jensenii甘曲霉994.65C3huaOK135700Aspergillus jensenii甘曲霉1002.33H1OK135699Aspergillus carneus肉色曲霉992.33J2OK135701Aspergillus carneus肉色曲霉1009.30
由表1可知,曲霉属(51.16%)和青霉属(34.88%)分离频率占比大,与文献报道的青霉和曲霉属是乳制品中最常见的腐败微生物结果一致[18],其中分离频率最高的杂色曲霉(20.93%)和桔青霉(18.60%)也曾在酸奶中被分离出来[17]。康博燕[19]对乳品生产环境中微生物的调查与分析中发现酸奶中的曲霉和青霉很可能是以孢子形式漂浮在加工环境的空气中,从而进入原料,污染酸奶。除此,枝孢霉属作为酸奶加工厂空气中最常见的分离物种也在酸奶中分离出来[4],而且很大可能是生产加工过程中由空气代入[18]。首次在酸奶中分离得到的耙齿菌属,也曾在臭豆腐和卤水样品等食品中分离得到[20]。由此可知,霉菌是整个供应链、食品行业中最常见的食品腐败微生物,甚至与高度加工、高稳定性产品的腐败(如酸奶)有关。然而,导致原料或成品变质的微生物的特性取决于物理和化学环境因素的组合[3]。本文选择污染频率高而且产生孢子的4株优势霉菌(杂色曲霉B2qing、肉色曲霉J2、桔青霉E和枝孢霉D)作为试验菌株,研究发酵乳清粉对它们的影响。
2.2 发酵乳清粉对霉菌孢子萌发的影响
孢子萌发是所有丝状真菌生命周期中必不可少的发育阶段,为了防止真菌感染和食品中产生霉菌毒素,则需限制孢子萌发[21]。在不添加发酵乳清粉的空白对照组中:桔青霉、枝孢霉、杂色曲霉、肉色曲霉的萌发率分别为(23.12±3.19)%、(30.01±3.14)%、(21.45±2.50)%、(13.48±4.04)%;不同菌株孢子的萌发具有显著性差异(P<0.05);与对照组相比,菌株孢子萌发率随着发酵乳清粉质量浓度的增加而显著降低(P<0.05),当质量浓度为8~10 g/L时,抑制率为100%,表明孢子萌发受到完全的抑制(图2)。对于肉色曲霉,发酵乳清粉在低质量浓度(1 g/L)下孢子萌发率为(16.12±0.10)%,高于空白对照组,经t检验,差异并不显著(P>0.05);在发酵乳清粉≥3 g/L时受到显著抑制(P<0.05)。TAO等[13]在萜烯柠檬烯对青霉孢子的诱导作用研究中也有类似现象:低浓度(0.125~0.50 μL/mL)的萜烯柠檬烯对青霉孢子的萌发有诱导促进作用,而高浓度(1 μL/mL)对孢子萌发有抑制作用。综上所述,发酵乳清粉对桔青霉、枝孢霉、杂色曲霉、肉色曲霉的最小抑菌浓度分别为1、1、1和3 g/L,且抑制效果与发酵乳清粉的浓度呈正相关。

图2 发酵乳清粉对4株酸奶优势污染霉菌孢子 萌发的抑制作用
Fig.2 Inhibition effect of the FWP on spore germination of 4 dominant contaminated molds strains from yogurt
2.3 发酵乳清粉对霉菌菌丝生长的影响
添加发酵乳清粉1 g/L时,肉色曲霉菌落直径大于空白对照组(P<0.05),可能是因为发酵乳清粉中有机酸等小分子营养物质在短时间内促进了肉色曲霉孢子的萌发。当发酵乳清粉质量浓度≥3 g/L时,菌落直径显著减小(P<0.05),这与孢子的萌发实验结果保持一致。其他菌株的菌落直径均显著低于空白对照组(P<0.05),且随着培养时间的延长,各浓度下的抑制率在不断地减小(图3-b)。WANG等[22]在对沙糖桔果皮所产生的挥发性精油的抑菌试验中发现,精油(≥0.5 μL/mL)对扩展青霉和核盘青霉有强烈的抑制作用,而对意大利青霉和指状青霉只有在高浓度下才有抑制作用,在低浓度(≤2.5 μL/mL)下则有促进作用。这与本文低浓度(≤1 g/L)促进肉色曲霉生长,高浓度抑制生长的结果一致。由此可见,不同菌株对抑菌物质的敏感度不同[11],因此抑菌物质对菌株的最小抑菌浓度也不同。
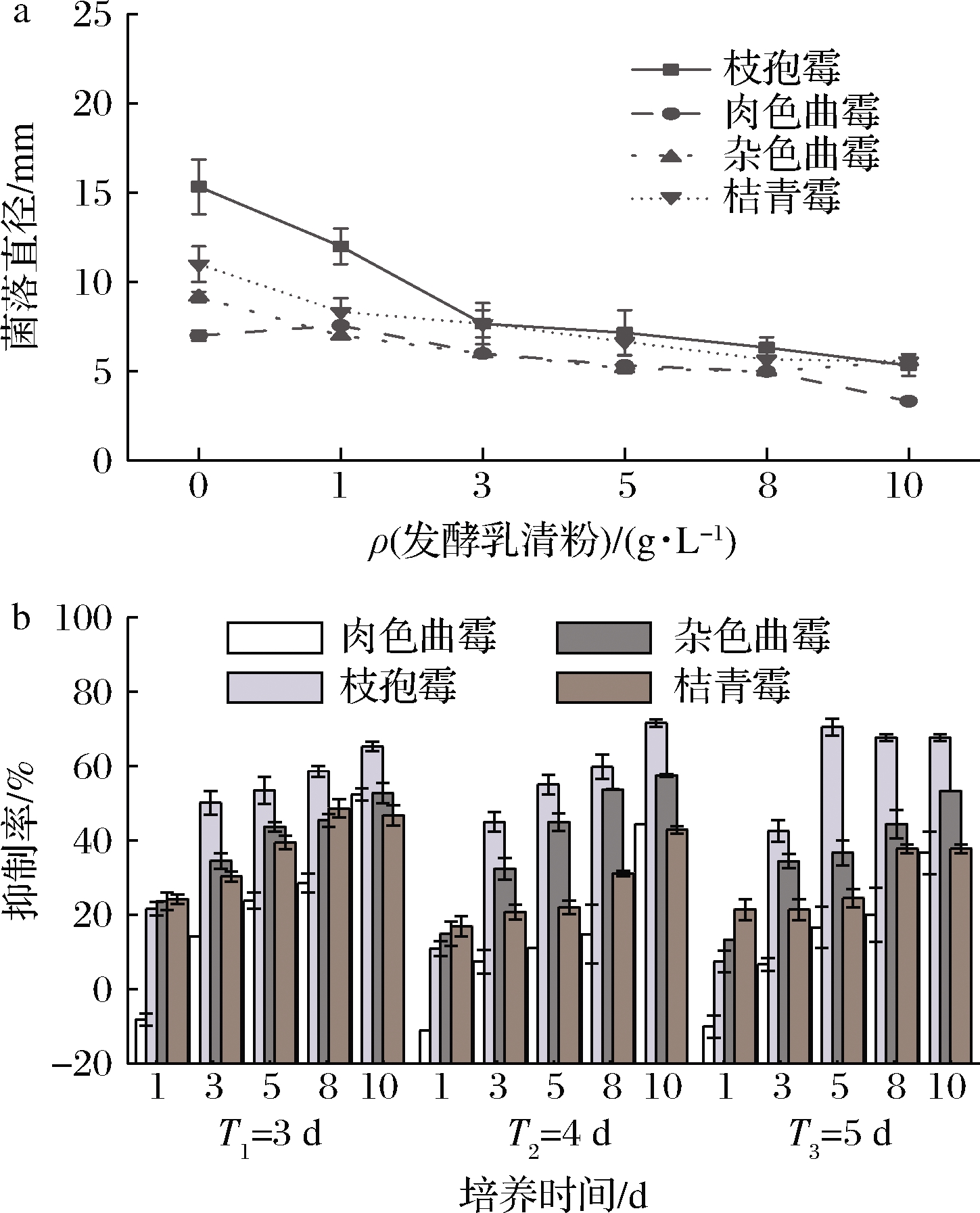
a-发酵乳清粉质量浓度;b-培养时间
图3 发酵乳清粉对4株酸奶优势污染霉菌菌丝生长的影响
Fig.3 Effects of the FWP on the mycelial growth of four dominant contaminated molds from yogurt
2.4 发酵乳清粉对霉菌菌丝生物量的影响
从表2可知,各菌株的生物量在不同浓度的发酵乳清粉处理后有显著性差异(P<0.05)。发酵乳清粉对肉色曲霉、枝孢霉、桔青霉和杂色曲霉的抑制率分别在8、8、8和5 g/L处达到最大值,为(60.38±2.73)%、(79.14±1.07)%、(69.88±0.14)%和(49.58±0.71)%;当质量浓度为10 g/L时,抑制率出现了降低的情况,可能是因为高浓度的发酵乳清粉对菌丝的形态造成严重的破坏、变形,无法形成完整的菌丝球,使细胞结构受到损伤,增加了菌丝干重,使得抑菌结果偏低。整体来看,发酵乳清粉的浓度与其对菌丝生物量的抑制作用呈正相关,各菌株的抑制率均有显著性差异(P<0.05)。
表2 发酵乳清粉对4株酸奶优势污染霉菌生物量的影响
Table 2 Effect of the FWP on the biomass of four 4 dominant contaminated molds strains from yogurt
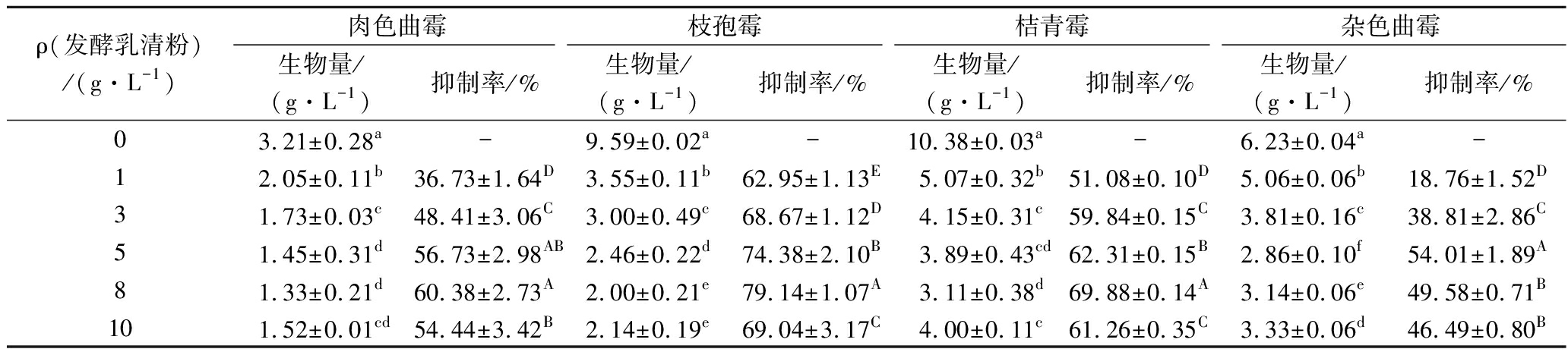
ρ(发酵乳清粉)/(g·L-1)肉色曲霉枝孢霉桔青霉杂色曲霉生物量/(g·L-1)抑制率/%生物量/(g·L-1)抑制率/%生物量/(g·L-1)抑制率/%生物量/(g·L-1)抑制率/%03.21±0.28a-9.59±0.02a-10.38±0.03a-6.23±0.04a-12.05±0.11b36.73±1.64D3.55±0.11b62.95±1.13E5.07±0.32b51.08±0.10D5.06±0.06b18.76±1.52D31.73±0.03c48.41±3.06C3.00±0.49c68.67±1.12D4.15±0.31c59.84±0.15C3.81±0.16c38.81±2.86C51.45±0.31d56.73±2.98AB2.46±0.22d74.38±2.10B3.89±0.43cd62.31±0.15B2.86±0.10f54.01±1.89A81.33±0.21d60.38±2.73A2.00±0.21e79.14±1.07A3.11±0.38d69.88±0.14A3.14±0.06e49.58±0.71B101.52±0.01cd54.44±3.42B2.14±0.19e69.04±3.17C4.00±0.11c61.26±0.35C3.33±0.06d46.49±0.80B
注:同列数值不同小写字母表示生物量有显著性差异(P<0.05);同列数值不同大写字母表示抑制率有显著性差异(P<0.05)
2.5 发酵乳清粉对霉菌细胞结构的影响
发酵乳清粉对霉菌细胞结构的影响结果如图4所示。未经发酵乳清粉处理的菌株分生孢子头饱满,孢子梗呈辐射状排列(图4-a-1);菌丝体发达,饱满挺直(图4-a-2);细胞内部结构完整,清晰可见的线粒体、液泡,内容物丰富(图4-a-3)。经10 g/L发酵乳清粉处理的菌株,孢子头干瘪,孢子梗排列疏松、不紧密(图4-b-1);菌丝体发生严重变形,空菌丝褶皱变平(图4-b-2);细胞内部质壁分离严重,细胞内容物流失,细胞质和细胞器丢失[16](图4-b-3)。LEYVA等[23]认为这可能是由于抑菌物质或有机酸以其未解离的形式通过微生物膜扩散,并在细胞内解离,从而导致细胞内pH值降低。有毒离子的累积与膜破坏、基本代谢反应的抑制或细胞内pH稳态中的应激相结合,最终导致细胞死亡。
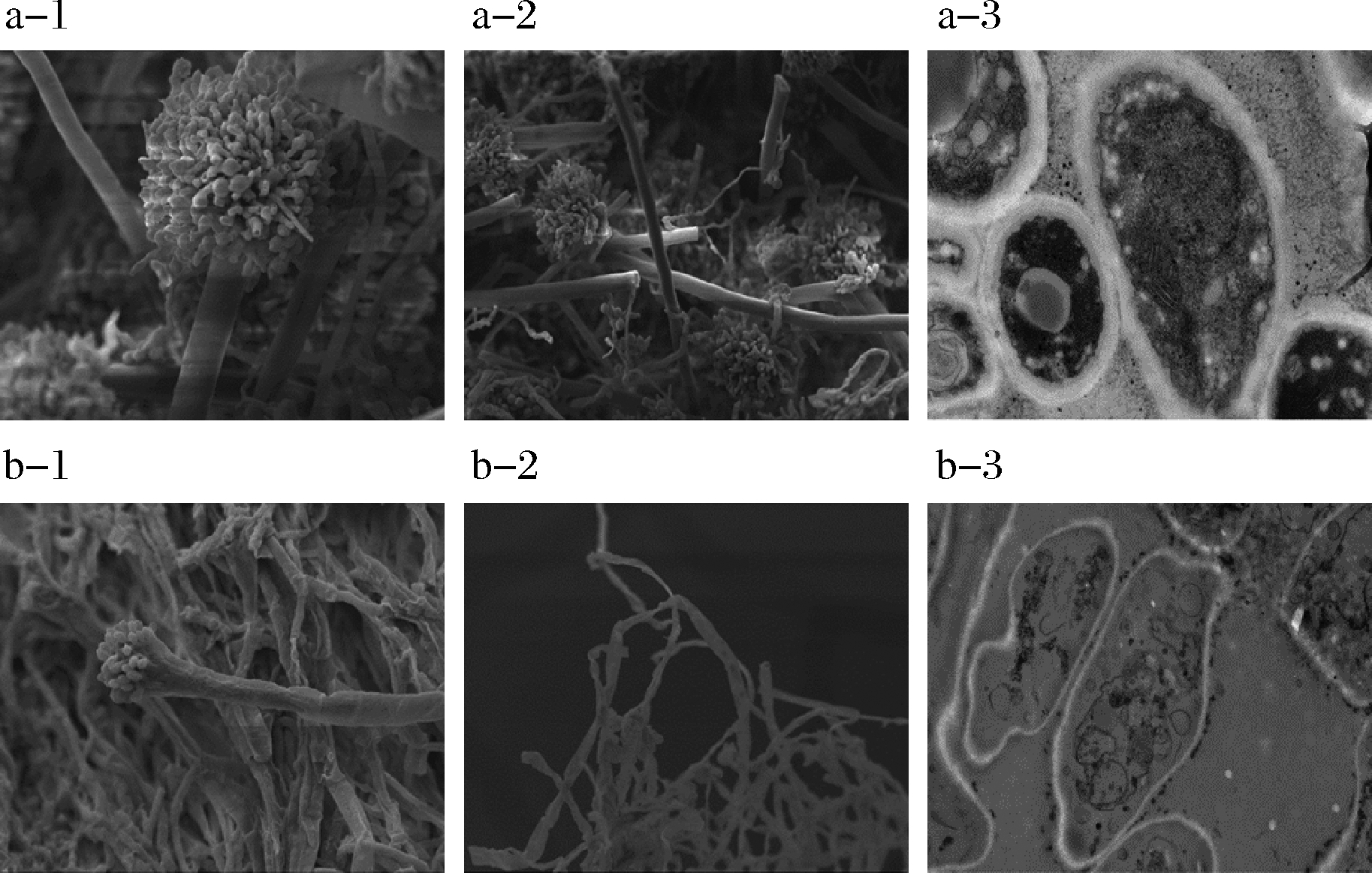
a-对照组;b-实验组;1-孢子头形态(1 500×); 2-菌丝形态(800×);3-细胞结构(5 000×)
图4 发酵乳清粉对杂色曲霉B2qing的孢子头、 菌丝体形态和细胞结构的影响
Fig.4 Effect of the FWP on the spores, mycelium morphology and cellular structure of A.versicolor B2qing
2.6 发酵乳清粉应用与酸奶储存中防霉效果
将发酵乳清粉添加到接种杂色曲霉孢子悬浮液的发酵乳中,使其终含量为0、1、3、5、8、10 g/L,28 ℃培养,分别于第1、3、5、7、10、15、21天观察霉菌菌落形成,结果见图5。

图5 发酵乳清粉添加对杂色曲霉在酸奶储藏期的生长影响
Fig.5 Effect of FWP addition on growth of A.versicolor in yogurt during storage
在储藏第5天时,空白对照组出现了白色的霉菌菌落,此时添加发酵乳清粉的试验组没有霉菌菌落形成;在储藏第12天时,1 g/L发酵乳清粉的样品出现了霉菌斑点(图中未显示);在储藏第15天时,对照组样品表面已经长满了霉菌,试验组中,除添加浓度为1 g/L发酵乳清粉的样品中有霉斑,其他添加量的样品仍未出现长霉的现象。结果表明:发酵乳清粉质量浓度≥1 g/L时,对酸奶中接种的霉菌有显著抑制作用,这可能是因为发酵乳的低pH使发酵乳清粉在低酸环境下的抑菌活性更高[12]。此外,随着发酵乳清粉浓度的增加,抑菌效果在加强的同时,也对发酵乳表观产生了一些影响,如乳清析出,颜色变暗的现象(图5),这与VIMONT等[17]对乳酸菌发酵产生的罗氏菌素抑菌能力及其在酸奶中应用的研究结果类似。这表明在抑制霉菌生长的同时,也要考虑对食品本身基本指标的影响。
3 结论
本文首先对市售低温发酵乳中丝状真菌的污染情况进行了统计分析,在126份市售发酵乳中共分离出43株霉菌,经鉴定为形态不同的13株污染霉菌,其中主要的优势菌为曲霉属,占比高达51.16%;其次从菌株的孢子萌发、菌落直径、菌丝生物量、细胞结构4个方面发现了发酵乳清粉对霉菌有显著的抑制作用,且不同菌株对发酵乳清粉的敏感性不同,使最小抑菌浓度也不同;最后将其添加到食品基质的发酵乳中,观察在储藏期间它对发酵乳中霉菌的抑制作用,结果表明添加1 g/L的发酵乳清粉能很好地抑制发酵乳中霉菌的生长,这表明发酵乳清粉有望成为生物防霉剂用于抑制低温发酵乳的霉菌污染。然而,在抑菌效果与发酵乳清粉添加量呈正相关的情况下,随着添加量的增加,发酵乳的一些基本指标也出现不良影响,如乳清析出、颜色变暗,这表明评价发酵乳清粉抑菌的同时还要考虑其对食品本身的影响。因此,接下来研究可侧重于探究不同添加量的发酵乳清粉对酸奶持水力、酸度、流变学特性、感官等指标的影响。
[1] 郑钰倩, 喻勇新, 赵海霞, 等.上海市市售低温酸奶中细菌多样性的初步研究[J].食品与发酵工业,2022,48(6):58-63.
ZHENG Y Q, YU Y X, ZHAO H X, et al.Preliminary study on bacterial diversity in low-temperature yogurt from Shanghai supermarket[J].Food and Fermentation Industries,2022,48(6):58-63.
[2] 陈正哲, 那治国, 余宁江.搅拌型酸奶质量控制的研究进展[J].中国乳业, 2014(5):55-57.
CHEN Z Z, NA Z G, YU N J.Research progress on quality control of stirred yoghurt[J].China Dairy, 2014(5):55-57.
[3] SNYDER A B, CHUREY J J, WOROBO R W.Association of fungal genera from spoiled processed foods with physicochemical food properties and processing conditions[J].Food Microbiology, 2019, 83:211-218.
[4] BUEHLER A J, MARTIN N H, BOOR K J, et al.Evaluation of biopreservatives in Greek yogurt to inhibit yeast and mold spoilage and development of a yogurt spoilage predictive model[J].Journal of Dairy Science, 2018, 101(12):10 759-10 774.
[5] BOUILLON G A, GÅSERØD O, RATTRAY F P.Evaluation of the inhibitory effect of alginate oligosaccharide on yeast and mould in yoghurt[J].International Dairy Journal, 2019, 99:104554.
[6] NIELSEN L, ROLIGHED M, BUEHLER A, et al.Development of predictive models evaluating the spoilage-delaying effect of a bioprotective culture on different yeast species in yogurt[J].Journal of Dairy Science, 2021, 104(9):9 570-9 582.
[7] MORADI M, MARDANI K, TAJIK H.Characterization and application of postbiotics of Lactobacillus spp.on Listeria monocytogenes in vitro and in food models[J].LWT, 2019, 111:457-464.
[8] PILOTE-FORTIN H, BEN SAID L, CASHMAN-KADRI S, et al.Stability, bioavailability and antifungal activity of reuterin during manufacturing and storage of stirred yoghurt[J].International Dairy Journal, 2021, 121:105141.
[9] 王昭钰, 王向坡, 张万刚.丙酸杆菌发酵提取物-乳酸链球菌素复配对熏煮香肠品质的影响[J].现代食品科技, 2021, 37(11):239-249.
WANG Z Y, WANG X P, ZHANG W G.Effect of the combination of Propionibacterium fermented extract and nisin on the quality of smoked and cooked sausages[J].Modern Food Science and Technology, 2021, 37(11):239-249.
[10] 吴颖, 赖利先, 张万刚.产酸丙酸杆菌发酵甘油提取物对冷藏调理猪肉饼品质的影响[J].食品科学, 2021, 42(1):228-234.
WU Y, LAI L X, ZHANG W G.Effect of a mixture of organic acids produced by Propionibacterium acidipropionici with glycerin as substrate on the quality of prepared pork patties during chilled storage[J].Food Science, 2021, 42(1):228-234.
[11] PEI X, TEKLIYE M, DONG M S.Isolation and identification of fungi found in contaminated fermented milk and antifungal activity of vanillin[J].Food Science and Human Wellness, 2021, 10(2):214-220.
[12] 张胜兰. 斜纹夜蛾高毒力棒束孢属菌株的筛选及其致病性研究[D].贵阳:贵州大学, 2020.
ZHANG S L.Screening and pathogenicity test of Cordyceps sp.strains highly virulent on Spodoptera litura (Fabricius)[D].Guiyang:Guizhou University, 2020.
[13] TAO N G, CHEN Y, WU Y L, et al.The terpene limonene induced the green mold of citrus fruit through regulation of reactive oxygen species (ROS) homeostasis in Penicillium digitatum spores[J].Food Chemistry, 2019, 277:414-422.
[14] 任苗苗, 闫思远, 李嘉泓, 等.两株拮抗芽孢杆菌对灵武长枣采后致腐真菌的抑菌作用[J].食品与发酵工业, 2020, 46(20):21-26.
REN M M, YAN S Y, LI J H, et al.Antibacterial effect of two antagonistic Bacillus strains on rot-causing fungi in postharvest Ziziphus jujube cv.Lingwu Changzao[J].Food and Fermentation Industries, 2020, 46(20):21-26.
[15] SHARMA N, TRIPATHI A.Effects of Citrus sinensis (L.) Osbeck epicarp essential oil on growth and morphogenesis of Aspergillus niger (L.) Van Tieghem[J].Microbiological Research, 2008, 163(3):337-344.
[16] 崔筱, 刘芹, 丁亚通, 等.平菇培养料发酵后对霉菌抑制机制研究[J].河南农业科学, 2021, 50(3):109-116.
CUI X, LIU Q, DING Y T, et al.Study on the inhibition mechanism of fermentation material of Pleurotus ostreatus on mold[J].Journal of Henan Agricultural Sciences, 2021, 50(3):109-116.
[17] VIMONT A, FERNANDEZ B, AHMED G, et al.Quantitative antifungal activity of reuterin against food isolates of yeasts and moulds and its potential application in yogurt[J].International Journal of Food Microbiology, 2019, 289:182-188.
[18] GOUGOULI M, KALANTZI K, BELETSIOTIS E, et al.Development and application of predictive models for fungal growth as tools to improve quality control in yogurt production[J].Food Microbiology, 2011, 28(8):1 453-1 462.
[19] 康博燕. 乳品生产环境中微生物的调查与分析[D].大连:大连工业大学, 2013.
KANG B Y.Investigation and analysis of microorganisms in dairy processing environment[D].Dalian:Dalian Polytechnic University, 2013.
[20] GU J S, LIU T J, SADIQ F A, et al.Biogenic amines content and assessment of bacterial and fungal diversity in stinky tofu - A traditional fermented soy curd[J].LWT, 2018, 88:26-34.
[21] BASAK S.Modelling the effect of betel leaf essential oil on germination time of Aspergillus flavus and Penicillium expansum spore population[J].LWT, 2018, 95:361-366.
[22] WANG H, TAO N G, HUANG S R, et al.Effect of Shatangju (Citrus reticulata Blanco) essential oil on spore germination and mycelium growth of Penicillium digitatum and P.italicum[J].Journal of Essential Oil Bearing Plants, 2012, 15(5):715-723.
[23] LEYVA S M, MOUNIER J, VALENCE F, et al.Antifungal microbial agents for food biopreservation-A review[J].Microorganisms, 2017, 5(3):37.