氨基甲酸乙酯(ethyl carbamate,EC),存在于许多发酵食品和发酵饮料中[1],由含氮化合物不完全代谢产生[2],该物质于2007年被国际癌症研究机构从2B类提升至2A类致癌物[3]。许多发达国家对市场上各类酒精饮品中的EC含量出台了限量标准[4],由于人们对酒精饮料的广泛摄入,其中EC带来的问题愈来愈受到人们的关注。
葡萄酒中的EC主要由尿素和瓜氨酸与乙醇反应生成,分离筛选低产EC或降解EC及其前体物质尿素的菌株[5-7],从源头上控制EC是一条方便快捷且行之有效的途径。近年来,国内外学者对降低发酵产品中EC的研究主要聚焦在筛选具有降解EC能力的菌株上,并进一步研究所筛选菌株产生的EC水解酶的相关特性。KOBASHI等[8]首次从小鼠粪便中分离出1株柠檬酸杆菌,发现该菌可将氨甲酸乙酯分解为乙醇和氨,并将具有这种降解能力的酶命名为urethanase。MOHAPATRA等[9]从海绵体螺旋藻中分离出有EC降解能力的微球菌,并初步研究了EC水解酶的特性;赵雅敏[5]从白酒大曲中筛选出1株具有EC降解能力的红酵母,并通过固定化细胞的方法使得该菌对黄酒酒样中EC的去除率从5%提高到了50%;杨广明[10]从小鼠消化系统中筛选出1株对EC和尿素都有相对较强的降解作用的菌株,鉴定为Providencia sp.,并对酶的性质做了初步研究;姚晓瑞宁[11]从香梨和葡萄中筛选出1株可以有效降解EC的鲁考弗梅奇属酵母;丁霞等[6]从浓香型白酒酒醅中分离得到1株能够同时降低 EC 及其前体尿素的解淀粉芽孢杆菌。
目前可产生EC水解酶的菌株,对降低酒精饮料中的EC含量具有较强的能力,但菌株本身不可直接用于葡萄酒的酿造。因此,本研究以筛选1株发酵葡萄酒性能良好且可降解EC的酵母菌为目标,从酿酒葡萄、干化葡萄和白酒酒醅中分离数株有EC降解能力的酵母菌,并对这些菌株进行发酵性能考察,以期为控制葡萄酒中EC含量提供参考。
1 材料与方法
1.1 材料
酿酒葡萄:宁夏银川贺兰县宁夏园艺产业园种植的多个酿酒葡萄品种;干化葡萄:宁夏吴忠青铜峡产区2019年赤霞珠,经干化处理;白酒酒醅:宁夏食品微生物应用技术与安全控制重点实验室保存。
YPD培养基、YPD液体培养基、WL培养基:均为商业培养基,购于青岛高科技工业园海博生物技术有限公司,按使用说明加蒸馏水溶解后灭菌。
液体筛选培养基(g/L):EC作为唯一氮源,EC 2.5,葡萄糖2.0,KH2PO4 2.0,乙酸钠2.0,NaCl 2.0,溴甲酚紫0.001,若配置固体培养基则加入琼脂20.0;pH 5.0。
复筛培养基(g/L):蛋白胨1.0,葡萄糖2.0,NaCl 2.0,KH2PO4 2.5,EC 2.5,溴甲酚紫0.001;pH 5.0。
葡萄汁培养基:葡萄汁与蒸馏水按1∶1的体积比配制。
1.2 主要试剂和仪器设备
氨基甲酸乙酯(EC)、氨基甲酸丙酯(nPC),北京索莱宝科技有限公司;葡萄糖、K2HPO4、KH2PO4、无水乙酸钠、NaCl、蛋白胨、琼脂、溴甲酚紫(以上试剂均为分析纯),天津大茂化学试剂厂;二氯甲烷、正己烷、甲醇(以上试剂均为色谱纯),阿拉丁(上海)试剂有限公司;酵母基因组DNA提取试剂盒,天根生化科技(北京)有限公司。
SW-CJ-2FD型洁净工作台,苏州安泰空气技术有限公司;YXQ-LS-50SII型立式压力蒸汽灭菌器、BSD-150型生化培养箱,上海博讯医疗生物仪器股份有限公司;8860-5977B型GC-MS联用仪,美国安捷伦公司;NBS-I型氮吹仪,合肥艾本森科学仪器有限公司;PEN3型电子鼻,德国Airsense公司。
1.3 实验方法
1.3.1 菌株筛选
1.3.1.1 初筛
将多个品种的酿酒葡萄鲜果、干化葡萄破碎后,常温下自然发酵24 h;称取酒醅10 g,加入90 mL无菌生理盐水,振荡培养12 h,得到菌悬液。将菌悬液接种于液体筛选培养基中[10],28 ℃培养24 h,对其进行梯度稀释,在WL培养基上进行涂布,后经过划线分离纯化得到纯种的单菌落,对形态符合酵母菌形态的菌株进行保存。再对每株菌进行验证,将菌株再次接入液体筛选培养基,观察是否发生变色反应,若变色则证明其可以降解EC,在对其进行复筛。
1.3.1.2 复筛
将初筛得到的具有EC降解能力的菌株,接种至复筛培养基中,28 ℃恒温静置培养10 d后,对复筛培养基中EC的含量进行测定,从中选取EC降解能力较强的菌株进行发酵性能比较。
1.3.1.3 发酵性能实验
(1)菌株的发酵能力试验。采用杜氏小管法,将菌株接种于内置杜氏小管的试管中,28 ℃培养36 h,观察杜氏小管气泡体积,比较各菌株发酵能力的强弱。
(2)菌株的耐受性试验。将各菌株接种于体积分数分别为3%、6%、9%、12%、15%的无水乙醇和SO2含量分别为60、180、300 mg/L的YPD液体培养基中,28 ℃培养36 h,比较各菌株的耐受性。结合发酵性能和耐受性试验结果,从中选取较优菌株进行发酵实验。
(3)发酵实验。取经过筛选的菌株进行发酵实验,将赤霞珠葡萄除梗破碎后,装入500 mL 三角瓶中,装液量为70%,加入50 mg/L SO2和 20 mg/L果胶酶,65 ℃水浴20 min,用水迅速冷却至室温后接种酵母菌(细胞浓度为107 CFU/mL),发酵温度控制在28 ℃,发酵12 d 后,添加90 mg/L SO2,装满罐于4 ℃贮存,澄清数天后对各处理葡萄酒的理化指标、EC、挥发性成分进行测定,同时进行电子鼻分析,以商业酵母XR作为对照。
1.3.2 菌株鉴定
18S rDNA分子鉴定:将上述菌株接入YPD液体培养基中静止培养12 h,离心弃上清液,收集菌体。使用酵母基因组DNA提取试剂盒提取酵母基因组,扩增后送上海生工生物工程股份有限公司测序,测序结果采用 NCBI Blast中进行同源序列比对,使用 MEGA X软件中的邻近法(Neighbor-Joining) 进行系统发育树的构建,并用Bootstrap对进化树进行1 000次置信度分析。
1.4 测定方法
1.4.1 EC的测定
复筛培养基样品中EC的测定:样品处理与标准工作溶液配制参照文献[12]的方法,GC-MS分析条件参照国标GB 5009.223—2014《食品安全国家标准 食品中氨基甲酸乙酯的测定》,略有修改。葡萄酒中EC的测定:参照国标GB 5009.223—2014《食品安全国家标准 食品中氨基甲酸乙酯的测定》,略有修改。
1.4.2 葡萄酒理化指标的测定
总酸、酒精度和挥发酸含量参照国标 GB/T 15038—2006《葡萄酒、果酒通用分析方法》测定,pH值使用pH计测定,总糖含量的测定使用苯酚硫酸法[13]。
色度、色调参照文献[14]的方法测定。
1.4.3 葡萄酒挥发性风味物质的测定
样品的前处理与GC-MS分析条件参照文献[15]的方法,定性、定量参照文献[16]的方法,略有修改。
1.4.4 电子鼻分析
参照文献[17]的方法测定。
2 结果与分析
2.1 降解EC酵母菌的筛选
2.1.1 初筛结果
本研究利用EC水解酶能够降解EC反应产生氨与乙醇,从而使菌株可以在以EC为唯一氮源的培养基中存活,同时使溴甲酚紫由黄变紫的原理,筛选得到了18株酵母菌作为初筛目的菌株,菌株编号见表1。
表1 菌株初筛结果
Table 1 Preliminary screening results of strains

菌株来源菌株编号酿酒葡萄NXU3、NXU4-2、NXU5、NXU7、NXU8、NXU9、NXU10、NXU14、NXU15、NXU18、NXU19-2、NXU20干化葡萄NXU1白酒酒醅NXU11-2、NXU12-2、NXU13、NXU17-1、NXU23
2.1.2 复筛结果
通过对初筛菌株接入的复筛培养基中EC浓度进行比较(图1),有7株对EC有较高降解能力的酵母菌,对EC的降解量达到181.97~261.5 mg/L,分别为NXU5、NXU7、NXU8、NXU11-2、NXU12-2、NXU14、NXU17-1,对这7株菌进行后续实验。

图1 复筛培养基中EC含量
Fig.1 EC content in secondary screening medium 注:小写字母不同表示差异显著(P<0.05)(下同)
2.1.3 发酵性能比较
2.1.3.1 发酵能力比较
对复筛结果中的7株菌种的产气结果进行比较(表2),7株菌中有4株菌产气充满杜氏小管,分别为:NXU5、NXU7、NXU11-2、NXU12-2,说明这4株酵母菌起酵能力强。
表2 筛选菌株的杜氏小管产气情况
Table 2 Screening strains of gas production in Dulbecco’s tubules

菌株编号产气情况菌株编号产气情况NXU5++++NXU12-2++++NXU7++++NXU14+NXU8+NXU17-1-NXU11-2++++
注:“+”:产气量为杜氏小管体积的1/4;“++”:产气量为杜氏小管体积的1/2;“+++”:产气量为杜氏小管体积的3/4,“++++”:产气量为杜氏小管满体积
2.1.3.2 耐受性比较
将通过发酵能力筛选的4株菌进行乙醇耐受性试验,结果如图2-a所示。在乙醇体积分数为3%~15%时,随着酒精浓度的升高,菌浓度整体呈现下降的趋势;酒精体积分数为15%时,菌株NXU11-2、NXU12-2菌浓度要明显高于其他菌株。如图2-b所示,在SO2质量浓度为60~300 mg/L时,随着SO2浓度的升高,菌浓度整体呈现下降的趋势;在SO2质量浓度到达300 mg/L时,所有菌株仍可以生长。结合耐乙醇实验结果,最终选择菌株NXU11-2、NXU12-2进行后续发酵实验。
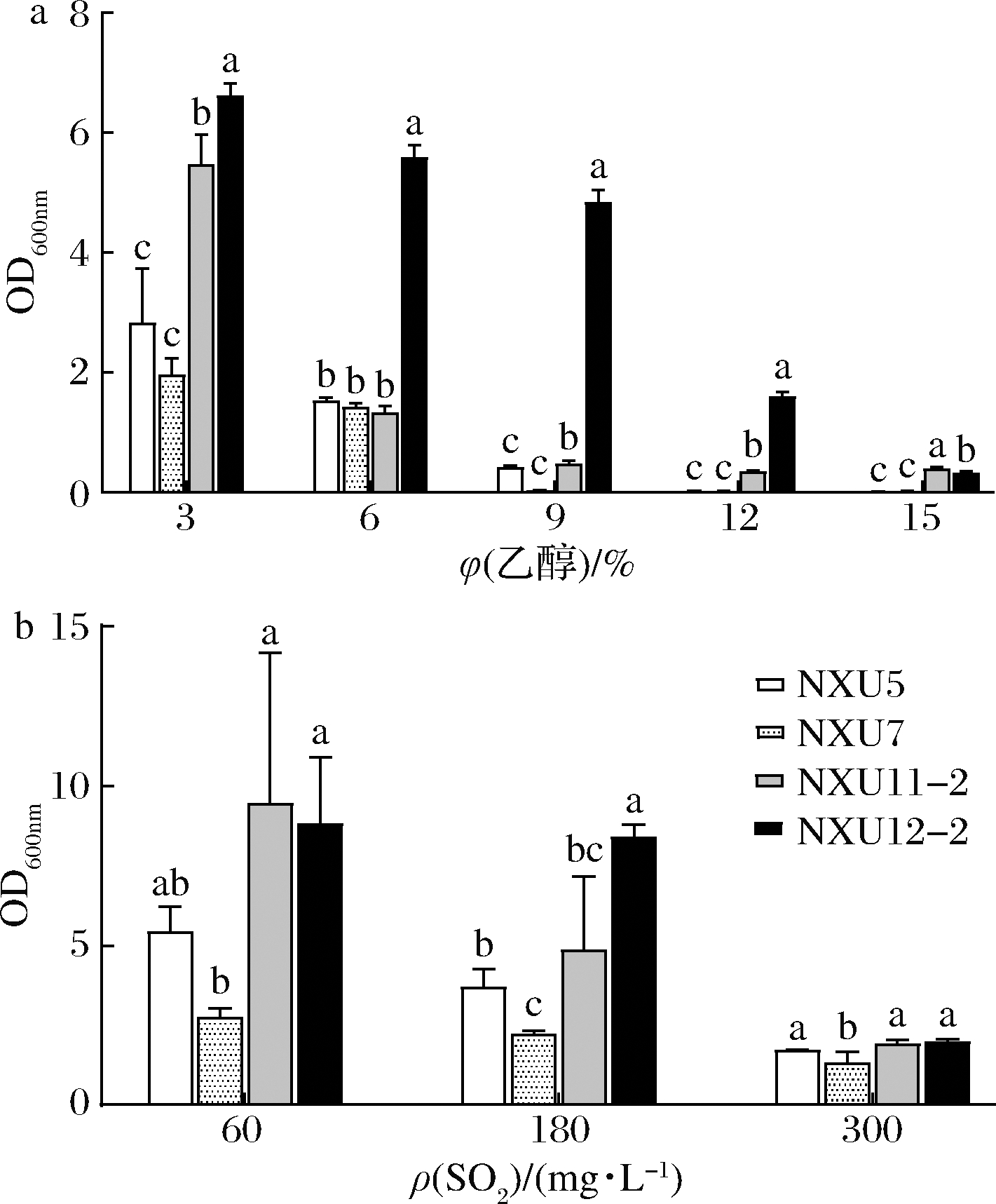
a-耐乙醇实验; b-耐SO2实验
图2 乙醇耐受性和SO2耐受性实验
Fig.2 Tolerance to alcohol and SO2
2.1.3.3 发酵实验
(1)理化指标与EC含量。对复筛所得到的NXU11-2与NXU12-2菌株进行发酵实验,结果如表3所示,通过葡萄酒中EC含量的测定得出,菌株NXU12-2的含量最低为18.96 μg/L,仅为商业酵母XR含量的53.13%。葡萄酒的挥发酸均在国标范围之内;总糖方面XR的含量最低,NXU12-2含量相对较高;总酸方面,NXU12-2含量最高;酒精度NXU12-2处于最低水平。近年来随着全球气候变暖,成熟酿酒葡萄含糖量升高,导致葡萄酒中乙醇含量升高[18],酒精度较低有利于生产低酒精度的葡萄酒,以迎合当前的消费者[19]。色泽是评价红葡萄酒品质的重要依据[20],不同菌株发酵葡萄酒的色度和色调值如图3所示,NXU12-2与XR的色度值相差最小,NXU12-2与XR的色调值无显著差异。
表3 葡萄酒理化指标
Table 3 Physicochemical indexes of wine samples

菌株编号酒精度/%vol总糖/(g·L-1)总酸/(g·L-1)(以酒石酸计)挥发酸/(g·L-1)(以乙酸计)pHEC含量/(μg·L-1)XR15.75±0.49a4.02±0.21b7.99±0.17b0.36±0.01ab3.88±0.00b35.69±4.91aNXU11-213.50±1.27ab4.43±0.75ab7.59±0.10c0.37±0.01a3.94±0.01a29.49±2.60aNXU12-212.80±0.00b4.69±0.39a9.26±036a0.32±0.00b3.82±0.02c18.96±0.92b
注:同一列字母不同表示差异显著(P<0.05)
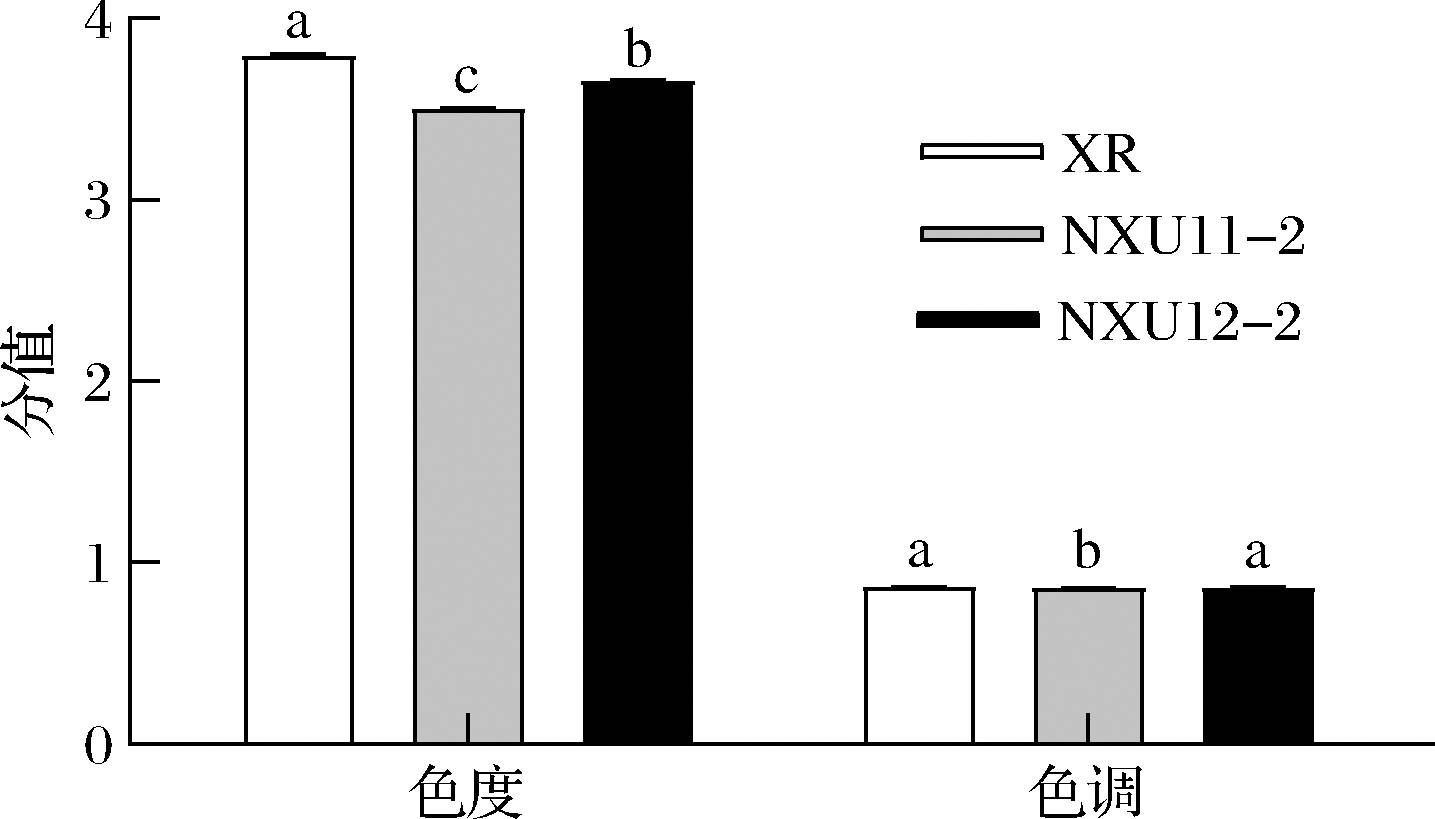
图3 葡萄酒色度与色调分析
Fig.3 The chromaticity and tonal analysis of wine samples
(2)葡萄酒香气成分分析。葡萄酒的香气很大程度上决定了葡萄酒的质量。通过顶空固相微萃取结合气相色谱-质谱联用法测定了葡萄酒中香气成分含量,结果见增强出版附件。实验共检测到44种香气物质,包括12种酯类、12种醇类、5种脂肪酸类、2种萜烯类、1种降异戊二烯衍生物、4种醛类、1种硫醇、1种内酯、2种酮类、2种烷烃类以及2种其他类。
酯类物质是葡萄酒香气的重要组成部分,各菌株发酵酒中酯类物质的含量为2 212.47~3 615.05 μg/L,NXU12-2酒样低于XR与NXU11-2。其中,共有3种酯类物质的OAV>1,分别为乙酸异戊酯、己酸乙酯和辛酸乙酯。酒样NXU12-2与XR相比,己酸乙酯和辛酸乙酯含量较低,乙酸异戊酯含量无显著区别。酒样NXU11-2与XR相比,3种物质含量均无显著区别。
高级醇是酵母代谢产生的次级产物,当葡萄酒中的高级醇含量低于300 mg/L 时,对葡萄酒香气具有积极贡献,可增加葡萄酒香气的复杂性[21]。酸类物质能够提高葡萄酒香气的复杂性,是葡萄酒中重要的一类香气物质[22]。各菌株发酵酒中,高级醇和脂肪酸的含量NXU12-2均为最高,总含量分别为18 548.20~35 446.90和187.22~345.13 μg/L。酒样中的醇类物质异戊醇、苯乙醇、异丁醇和1-壬醇含量较高;酸类物质异丁酸、辛酸等含量较高,酒样NXU12-2与XR相比,异戊醇含量无显著区别,1-壬醇含量较低,增加了苯乙醇(OAV>1)、异丁醇和异丁酸、辛酸、9-癸烯酸,增加了葡萄酒中的花香味、甜味和奶酪味,减少了生青味。
除此之外,芳樟醇、大马士酮、壬醛、异佛尔酮和2,4-二叔丁基苯酚的OAV也超过了1。芳樟醇为酒体带来花香,XR的含量最高;大马士酮为酒体带来花香、甜味、蜂蜜味, NXU12-2含量最高,对酒体香气的复杂性有一定的贡献。
(3)葡萄酒香气成分的主成分分析。为了直观地展示各实验组之间的差异,对于OAV>0.1的21种香气物质进行主成分分析。由图4可知,前2个主成分的总贡献率为79.2%,其中主成分1的方差贡献率46.9%,主成分2的方差贡献率为32.3%。其中,NXU12-2位于第一象限,与大马士酮、苯乙醇、辛酸、甲硫醇的相关性较强,赋予酒体复杂浓郁的花香、甜味和奶酪味;对照组XR位于第二象限,与芳樟醇、异佛尔酮、1-壬醇、丁酸乙酯、9-癸烯酸联系紧密,为酒体带来花香、脂肪味和生青味;NXU11-2位于第三象限,与乙醛和乙酸乙酯有较大关联,为酒体带来果香、醇味和甜味等。通过主成分分析,发现NXU11-2、NXU12-2和XR的香气特征都较好,可用于高质量葡萄酒的酿造。
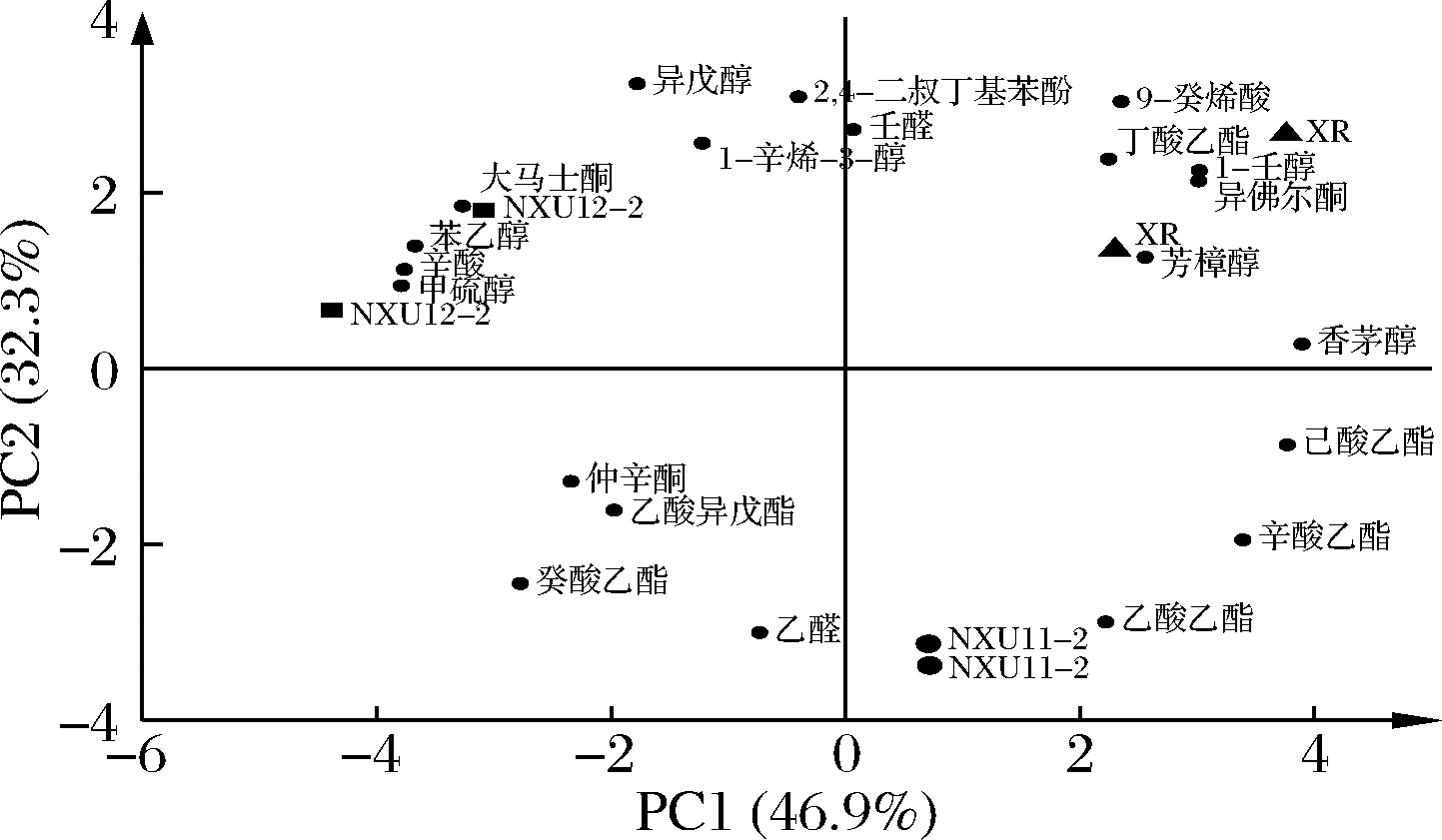
图4 葡萄酒香气物质(OAV>0.1)的主成分分析图
Fig.4 Principal component analysis plot of aroma substances in wine (OAV>0.1)
(4)电子鼻雷达图分析。图5为葡萄酒电子鼻雷达图分析结果,从中可以看出 W1C、W5S、W1S、W1W、W2S、W2 W 六个传感器对酒样的响应较高,其余4个传感器响应较低。XR在 W5S、W1S两个传感器响应最高,说明其中氮氧化合物、甲烷等短链烷烃类芳香化合物含量较高;NXU12-2在W2S传感器响应最高,说明其中醇醚醛酮类芳香化合物含量较高,各酒样间差异不明显。
综合初筛、复筛和发酵能力的比较,最终选择菌株NXU12-2作为发酵性能良好的目的菌株。
2.2 降解EC酵母菌的鉴定
将该菌株18S rDNA序列与NCBI数据库中进行BLAST比对,结果表明,此菌株18S rDNA序列与酿酒酵母18S rDNA的相似度为99%。根据菌株的18S rDNA序列,利用 Mega 5.0 软件建立系统发育进化树,采用 Neighbor-Joining 法对菌株进行分析。由图6可知,它与酿酒酵母在一个系统发育支上,因此可确定该菌株为酿酒酵母,并命名为NXU12-2。
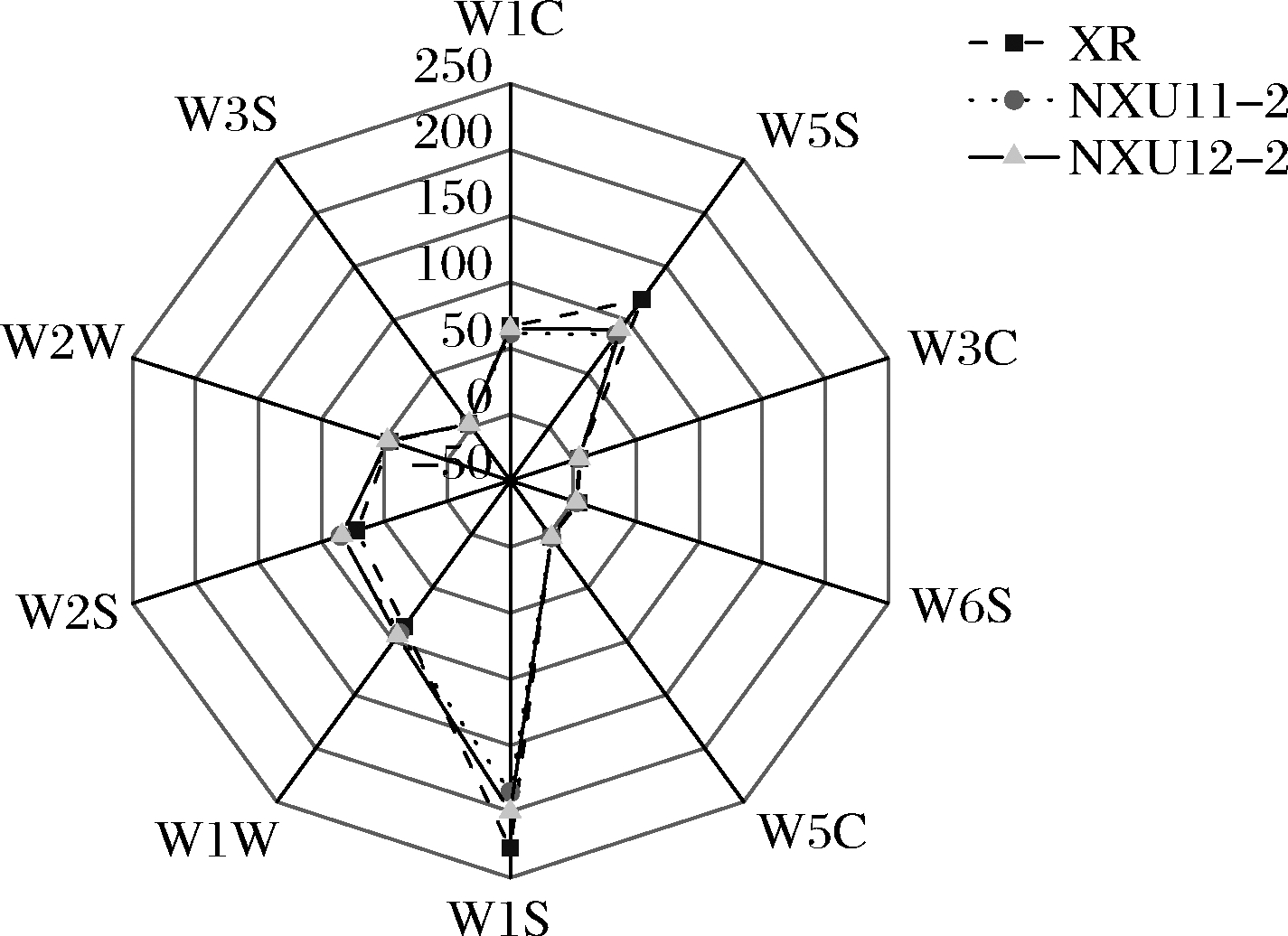
图5 葡萄酒电子鼻雷达图
Fig.5 Electronic nose radar chart of wine
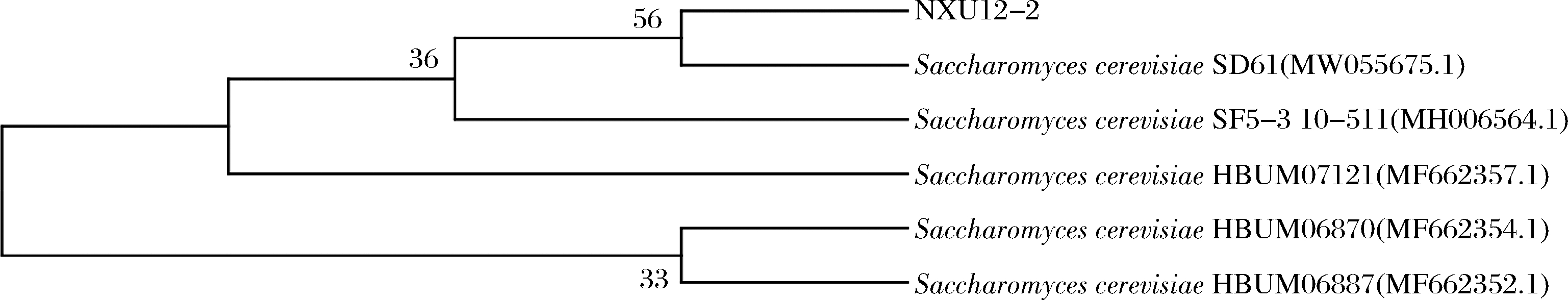
图6 NXU12-2 18 s rDNA基因系统发育分析
Fig.6 Phylogenetic tree of 18S rDNA gene of NXU12-2
3 结论
本研究从酿酒葡萄、干化葡萄和白酒酒醅中筛选得到可降解氨基甲酸乙酯的酵母菌18株,选择7株降解能力较强的菌株进行发酵性能实验和耐受性实验,得到2株酵母菌NXU11-2与NXU12-2。对这2株菌进行发酵实验,结果表明,使用NXU12-2酿造的葡萄酒EC含量最低,葡萄酒的酒精度、总酸等指标较优,香气特征较好,经鉴定为酿酒酵母。研究表明,使用酿酒酵母NXU12-2酿造的葡萄酒品质较优,同时降低了酒中EC的含量,对葡萄酒中EC的控制具有重要意义。
[1] 顾国贤. 酿造酒工艺学[M].第二版.北京:中国轻工业出版社, 2008:475-463.
GU G X.Brewing Technology[M].Second edition.Beijing:China Light Industry Press, 2008:475-463.
[2] THIBON C, MARULLO P, CLAISSE O, et al.Nitrogen catabolic repression controls the release of volatile thiols by Saccharomyces cerevisiae during wine fermentation[J].FEMS Yeast Research, 2008, 8(7):1 076-1 086.
[3] BAAN R, STRAIF K, GROSSE Y, et al.Carcinogenicity of alcoholic beverages[J].The Lancet Oncology, 2007, 8(4):292-293.
[4] WEBER J V, SHARYPOV V I.Ethyl carbamate in foods and beverages:A review[J].Environmental Chemistry Letters, 2009, 7(3):233-247.
[5] 赵雅敏. 红酵母降解中国黄酒中氨基甲酸乙酯的研究[D].无锡:江南大学, 2012.
ZHAO Y M.Investigation of ethyl carbamate degradation in Chinese rice wine by Rhodotorula sp[D].Wuxi:Jiangnan University, 2012.
[6] 丁霞, 李巧玉, 刘凡, 等.降解浓香型白酒中氨基甲酸乙酯菌株的筛选及产酶特性研究[J].食品与发酵工业, 2018, 44(7):29-36.
DING X, LI Q Y, LIU F, et al.Isolation of microbial strains for degradation of ethyl carbamate in Luzhou-flavour Baijiu and characterization of corresponding enzymes[J].Food and Fermentation Industries, 2018, 44(7):29-36.
[7] 周建立, 康振, 刘庆涛, 等.重组酸性脲酶对黄酒中尿素和氨基甲酸乙酯的降解应用[J].生物工程学报, 2016, 32(1):74-83.
ZHOU J L, KANG Z, LIU Q T, et al.Degradation of urea and ethyl carbamate in Chinese Rice wine by recombinant acid urease[J].Chinese Journal of Biotechnology, 2016, 32(1):74-83.
[8] KOBASHI K, TAKEBE S, SAKAI T.Urethane-hydrolyzing enzyme from Citrobacter sp.[J].Chemical & Pharmaceutical Bulletin, 1990, 38(5):1 326-1 328.
[9] MOHAPATRA B R, BAPUJI M.Characterization of urethanase from Micrococcus species associated with the marine sponge (Spirasfrella species)[J].Letters in Applied Microbiology, 1997, 25(6):393-396.
[10] 杨广明. 酸性脲酶与氨基甲酸乙酯降解酶产生菌的筛选及酶的特性[D].无锡:江南大学, 2014.
YANG G M.The isolation of acid urease and urethanase producing strain and the enzymatic characterization[D].Wuxi:Jiangnan University, 2014.
[11] 姚晓瑞宁. 降解氨基甲酸乙酯酵母菌的筛选及特性分析[D].石河子:石河子大学, 2018.
YAO X R N.Screening and characterization of the yeast degrading ethyl carbamate[D].Shihezi:Shihezi University, 2018.
[12] 区棋铭, 黄雨锟, 朱国军, 等.气相色谱-质谱法测定涂料中游离氨基甲酸乙酯[J].化学分析计量, 2018, 27(2):36-39.
OU Q M, HUANG Y K, ZHU G J, et al.Determination of free ethyl carbamate in coating by gas chromatography-mass spectrometry[J].Chemical Analysis and Meterage, 2018, 27(2):36-39.
[13] 浩楠. 甘肃河西走廊葡萄酒产区苹乳发酵乳酸菌分离鉴定及其对葡萄酒品质的影响[D].兰州:甘肃农业大学, 2019.
HAO N.Isolation, identification and influence of wine quality of malolactic bacteria from Hexi Corridor in Gansu[D].Lanzhou:Gansu Agricultural University, 2019.
[14] 孙玮璇, 岳卓雅, 刘珍, 等.香柏木浸渍工艺酿造干红葡萄酒的感官质量分析[J].中国食品学报, 2017, 17(6):172-178.
SUN W X, YUE Z Y, LIU Z, et al.The sensory analysis of dry red wine fermented by Cupressus pieces maceration process[J].Journal of Chinese Institute of Food Science and Technology, 2017, 17(6):172-178.
[15] JIANG B, ZHANG Z W.A preliminary study of aroma composition and impact odorants of cabernet franc wines under different terrain conditions of the loess plateau region (China)[J].Molecules (Basel, Switzerland), 2018, 23(5):1096.
[16] 宋茹茹, 段卫朋, 祝霞, 等.戴尔有孢圆酵母与酿酒酵母顺序接种发酵对干红葡萄酒香气的影响[J].食品与发酵工业, 2019, 45(24):1-9.
SONG R R, DUAN W P, ZHU X, et al.Effects of sequential inoculation with Torulaspora delbrueckii and Saccharomyces cerevisiae on aroma profile of dry red wine[J].Food and Fermentation Industries, 2019, 45(24):1-9.
[17] 宫雪, 刘宁, 李二虎, 等.基于电子鼻的葡萄酒感官评价模型的构建[J].中国酿造, 2014, 33(5):67-71.
GONG X, LIU N, LI E H, et al.Model for wine sensory evaluation based on electronic nose[J].China Brewing, 2014, 33(5):67-71.
[18] 尤雅, 段长青, 燕国梁.扁平云假丝酵母与酿酒酵母混合发酵对葡萄酒乙醇含量及香气的影响[J].食品科学, 2018, 39(20):146-154.
YOU Y, DUAN C Q, YAN G L.Effects of mixed fermentation of Candida humilis and Saccharomyces cerevisiae on ethanol content and aroma of wine[J].Food Science, 2018, 39(20):146-154.
[19] LI W P, YAO H, CHEN K Q, et al.Effect of foliar application of fulvic acid antitranspirant on sugar accumulation, phenolic profiles and aroma qualities of Cabernet Sauvignon and Riesling grapes and wines[J].Food Chemistry, 2021, 351:129308.
[20] 李斌斌, 赵晓敏, 周鹤, 等.不同冷浸渍时间对干红葡萄酒酚类物质和色泽品质的影响[J].食品与发酵工业, 2019, 45(18):183-188, 194.
LI B B, ZHAO X M, ZHOU H, et al.Effects of different cold maceration time on phenolic substances and color of dry red wine[J].Food and Fermentation Industries, 2019, 45(18):183-188;194.
[21] SWIEGERS J H, BARTOWSKY E J, HENSCHKE P A, et al.Yeast and bacterial modulation of wine aroma and flavour[J].Australian Journal of Grape and Wine Research, 2005, 11(2):139-173.
[22] JOLLY N P, VARELA C, PRETORIUS I S.Not your ordinary yeast:Non-Saccharomyces yeasts in wine production uncovered[J].FEMS Yeast Research, 2014, 14(2):215-237.