酶是一种具有高效性、专一性、催化条件温和无污染等特点的生物催化剂,在食品加工、生物医药、水处理、能源等研究领域中有着巨大的应用潜力[1]。然而,大多数酶是蛋白质,易受温度、pH以及重金属盐等环境因素影响而变性或失活,使其难以回收利用和连续化生产。固定化酶具有较高的催化特性和稳定性,可以有效提高酶的利用率。随着20世纪60年代固定化材料和酶工程领域的进一步发展[2],固定化酶技术开拓了更加广阔的应用前景。
目前,新型固定化酶技术的研究主要集中在2个方面:一是固定化新技术的开发及传统固定化技术的改进,如交联酶聚集体、物理辅助固定化技术、膜固定化技术等的开发与应用[3];二是新型固定化材料的开发研究,如金属有机框架材料(metal-organic frameworks,MOFs)、共价有机框架材料(covalent-organic frameworks,COFs)以及磁性纳米材料等[4]。其中,磁性Fe3O4纳米粒子作为酶固定化的新型载体,具有良好的生物相容性、粒径小、比表面积大、超顺磁性、较高的载酶量及在溶液中稳定存在等优点[5]。同时该粒子不仅可以通过施加外界磁场快速地从反应体系中分离出来,促进酶的有效回收和循环利用,还可以与多种材料复合,利用这些复合材料独特的物理或表面特性(提供醛基、羟基、羧基和氨基等基团)提高酶的固定效率,解决单一材料在固定化酶领域所存在的缺陷问题[6]。另外,稳定的核壳结构能够在强酸、强碱环境中保护酶的活性,使其在固定化酶、生物医学和临床应用中发挥巨大的作用。本文综述了磁性Fe3O4纳米粒子的制备、酶固定化方法及其固定不同种类酶的最新研究,最后总结其在食品工业领域的应用现状,以期为促进磁性Fe3O4纳米粒子固定化酶技术的应用研究提供参考。
1 磁性Fe3O4纳米粒子
1.1 磁性Fe3O4纳米粒子的特性
磁性纳米颗粒是由聚合物和磁性材料组成的新型有机-无机功能材料。其中,Fe3O4纳米粒子是目前最受欢迎的磁性固定化材料,具有高饱和磁化强度、超顺磁性和大比表面积等优点,目前在药物递送和酶固定化领域备受关注[5]。但Fe3O4非常不稳定,在空气中很容易被氧化成其他物质,降低了材料的磁性和分散性。此外,Fe3O4暴露的表面具有化学活性,可能会导致酶蛋白的失活[7]。为了克服这些问题,采用无机或有机材料与裸露的Fe3O4形成纳米复合材料。磁性核壳结构的复合材料是最有前途的多功能材料之一,在酶固定化方面受到越来越多的关注,如图1所示。
1.2 磁性Fe3O4纳米粒子的制备
Fe3O4纳米粒子的应用十分广泛,其制备方法多种多样,主要有机械球磨法、水热法、高温分解法、微乳液法、共沉淀法等[8-9],其制备原理和优缺点如表1所示。
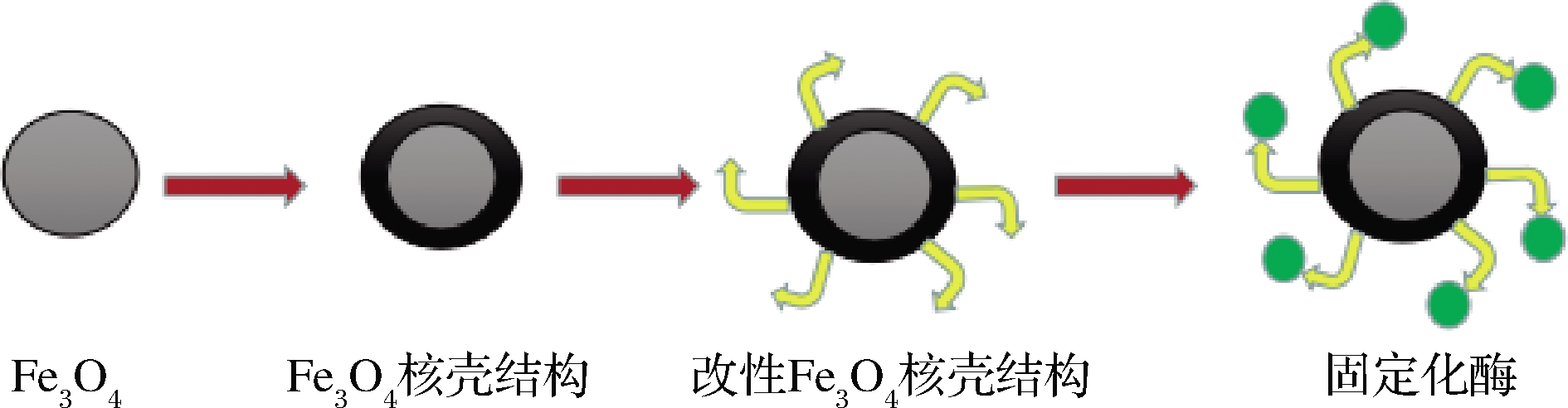
图1 Fe3O4核壳结构固定化酶形成过程示意图
Fig.1 Schematic diagram of the formation of Fe3O4 core-shell structure immobilized enzyme
表1 Fe3O4纳米粒子的制备方法
Table 1 Preparation method of Fe3O4 nanoparticles

方法原理优缺点机械球磨法将Fe3O4粗颗粒加入球磨机,通过钢球之间或钢球与研磨罐内壁之间的撞击,产生强烈的塑性变形并破碎,进而粗颗粒细化,直到形成纳米颗粒机械球磨法操作简单,但生产周期长,粒径不均一,难以达到纳米级要求水热法反应器中创造高温高压环境,使物质溶解在环境中,将反应物重结晶,然后分离并热处理以获得纳米颗粒高压环境下可以减少各组分的挥发,提高产品的纯度和环保性,但需要高压釜,工艺繁琐高温分解法在高温下热分解金属化合物,然后氧化前驱体,最终获得磁性金属氧化物纳米粒子磁性纳米粒子均匀、不聚集,具有高饱和磁化率和高初始磁化率值,但成本较高,操作复杂微乳液法通过调节表面活性剂、油相、水相和助溶剂的比例形成微乳液环境,从而沉淀磁性纳米粒子可以有效避免颗粒之间的团聚,但对反应环境要求较高共沉淀法将二价铁盐和三价铁盐溶液按一定比例混合,将碱性沉淀剂快速加入至上述铁盐混合溶液中,搅拌、反应一段时间即得纳米磁性纳米粒子,其反应式为:Fe2++2Fe3++8OH-=Fe3O4+4H2O常用方法,操作简单,成本低,但粒度分布范围较宽,当实验条件控制不严格时,生成的最终产物中可能有杂质
1.3 磁性Fe3O4纳米粒子固定化酶的方法
通过物理或化学方法将游离酶与特定的载体材料结合实现酶的固定化。酶固定化的方法主要包括吸附法、包埋法、交联法与共价法等以及多种方法结合的技术[10-12]。研究发现,采用化学试剂对Fe3O4纳米粒子及其核壳结构进行修饰,使酶分子上的氨基酸残基与载体上特定官能团以共价键的形式结合,可以快速有效地实现酶的固定化。AKHOND等[13]研究了氨基功能化的纳米粒子修饰的磁性纳米粒子共价固定猪胰腺α-淀粉酶的潜力。研究表明固定后α-淀粉酶保留了50%以上的初始比活性。与游离酶相比,固定化酶的热稳定较好,在重复使用9次后依然保持68%的初始活性。CHENG等[14]提出了一种将α-葡萄糖苷酶直接共价固定在3-氨丙基三乙氧基硅烷修饰的Fe3O4纳米粒子上的方法。与游离酶相比,固定化α-葡萄糖苷酶的耐酸碱度和热稳定性略有提高。此外,固定化α-葡萄糖苷酶表现出良好的重复利用性,经7次循环后,剩余活性仍达到66.0%。
2 磁性Fe3O4纳米粒子固定化酶
2.1 磁性Fe3O4纳米粒子固定化脂肪酶
脂肪酶(三酰基甘油酯水解酶)是一种良好的热稳定生物催化剂,可用于不同的工业领域,如洗涤剂、油脂化学品、食品添加剂、生物柴油、纺织等[15-16]。然而,游离脂肪酶的工业应用通常因其容易失活、操作稳定性低和循环利用困难而受到阻碍,将其固定在合适的载体上可以有效地克服这些缺点,以改善酶的特性。
目前,脂肪酶固定化的各种载体及其性质已被广泛研究。如,WANG等[17]研发了一种无表面活性剂、经济和绿色的高分散Fe3O4@MIL-100(Fe)磁性核/壳复合微球,其具有合适的孔径(7.07 nm)、高比表面积(137.27 m2/g)和高磁化强度(49.67 emu/g)。将假丝酵母脂肪酶作为模型酶固定在核壳微球上。发现固定化酶在65 ℃下水解橄榄油6 h后仍保持65%左右的初始活性;并且在第10次催化运行后,残余活性仍保持初始活性的60%。这可能归功于Fe3O4@MIL-100(Fe)大的表面积和孔径以及MOFs中游离羧基和不饱和金属中心的存在,使其具有较高的负载量。这与MOSAYEBI将七型假丝酵母脂肪酶固定在(3-辛基)三甲氧基硅烷功能化氧化石墨烯纳米复合材料(GO-Fe3O4)的研究结果一致[18]。因此,Fe3O4核壳型磁性微球在环境保护、化学生物传感器、纳米电子学等领域有着广阔的应用前景。
2.2 磁性Fe3O4纳米粒子固定化蛋白酶
目前研究较多的蛋白酶主要有胃蛋白酶、胰蛋白酶、碱性蛋白酶、中性蛋白酶和木瓜蛋白酶等。酶解产物不仅可以增大蛋白的溶解性、乳化性等物理特性,还可以得到易于消化吸收,具有多种活性的功能性肽段,已被广泛应用在生物、制药和食品工业等领域[19]。
在蛋白质水解产物的生产中,游离形式的酶通常需加热灭活,但加热可能会使蛋白变性或促进聚集体的形成,而磁性Fe3O4纳米粒子固定化酶可以通过磁性分离回收酶,消除了酶失活过程可能引起的潜在变化,并获得无残留酶的水解产物。如CAO等[20]制备一种由磁性Fe3O4纳米粒子和一层金纳米粒子组成的固定化载体。金纳米粒子作为中间配体,将胰蛋白酶可逆地固定从而得到一种生物反应器,并将其用于标准蛋白质的消化。结果表明,与使用游离胰蛋白酶及常规固定化技术(如静电相互作用、共价键合和形成金属螯合物)相比,其酶催化效率更高。CHEN等[21]研究以壳聚糖和三聚磷酸钠包覆的磁性纳米粒子(Fe3O4@CSTPP)为载体,开发了一种新型高效的双酶(碱性蛋白酶与胰蛋白酶)同步固定化方法,研究发现DE-Fe3O4@CS-TPP纳米粒子具有较高的热稳定性,在贮藏35 d后,其活性保持86%,连续重复使用10次后,仍保持60%以上的初始活性。DE-Fe3O4@CS-TPP纳米粒子在米糠、核桃、红小豆、玉米醇溶蛋白和酪蛋白等各种蛋白质水解过程中显示出良好的水解度、产率,同时由其水解制备的蛋白肽具有更高抗氧化活性。
2.3 磁性Fe3O4纳米粒子固定化漆酶
漆酶是一种分子质量为50~90 kDa的含铜多酚氧化酶,广泛分布于真菌、植物、细菌和昆虫中。它可以通过促进苯酚和二元胺的甲氧基取代来氧化多酚或其他具有类似多酚结构的底物[22]。然而,漆酶重复使用性差、稳定性差的缺点阻碍了漆酶的进一步应用。因此,漆酶的固定化引起了广泛的关注和研究。
酶固定化技术可以提高酶的整体稳定性和回收能力,促进酶在更多领域的进一步应用。与大多数复杂繁琐的酶固定化过程相比,ZHANG等[23]采用自组装方法制备了载体Fe3O4@壳聚糖(Fe3O4@CS)复合纳米粒子,并将漆酶共价固定Fe3O4@CS复合纳米粒子,研究去除水中的氯酚效率。结果表明,固定化漆酶的比活性达到112.4 U,活性回收率为51.8%。与游离漆酶相比,固定化漆酶具有更高的耐酸碱度、热稳定性和储存稳定性,这可能是由于漆酶与载体之间的结合增加了结构刚性并减少了构象变化。随着复合纳米粒子制备技术不断创新,CHEN等[24]首次提出同轴电喷雾制备核/壳复合纳米粒子固定化漆酶降解银杏酸的方法,固定化后漆酶在60~90 ℃热稳定性较高,用其降解银杏酸,速率常数(k)和时间(τ50)分别低于0.02 min-1和39 min,表现出良好的催化性能。此外在储存21 d或重复使用5次后显示出高于0.5的相对活性,具有良好的储存稳定性和可重复使用性。随着固定化酶技术的不断发展,可实现漆酶的固定化,更有希望实现漆酶的工业化生产。
2.4 磁性Fe3O4纳米粒子固定化其他酶
近年来,磁性纳米材料已经成为重要的纳米材料,被用来固定各种功能的酶,如淀粉酶、蜗牛酶、脱氢酶、葡萄糖苷酶、果胶酯酶、过氧化氢酶、内酰胺酶、碳酸酐酶等。
YILMAZ等[25]研究了α-淀粉酶固定在修饰的磁性碳纳米管磁性纳米粒子(α-淀粉酶-Fe3O4/多壁碳纳米管)作为萃取剂对食品中金属离子进行微萃取的可行性。在微萃取中发现,α-淀粉酶-Fe3O4/多壁碳纳米管重复使用6次仍保持较高的萃取效率,砷的提取率高于95%,该方法已成功应用于不同大米和面粉样品中砷含量的分析。LI等[26]合成了球形的50 nm羧化壳聚糖包裹的磁铁矿纳米粒子(Fe3O4@CYCTS),并首次将其应用于蜗牛酶的固定化。结果显示,在60 ℃孵育60 min后,固定化蜗牛酶的剩余活性为40.7%,约是游离酶的4倍。同时固定化酶在化学变性剂(2%十二烷基硫酸钠、60%乙醇和6 mol/L尿素)的作用下仍保留了大部分初始活性。WANG等[27]将磷酸甘油醛脱氢酶(GAPDH)固定在Fe3O4纳米粒子上以提高其降解组胺的性能。发现固定化GAPDH在70 ℃时仍保持约31.4%的活性,同时固定化酶显示出良好的可重复使用性(在5次使用循环后保留了近60%的活性)。固定化GAPDH降解了葡萄和黑树莓酒80%以上的组胺,对酒成分的影响微乎其微,表明Fe3O4-GAPDH的酶促技术在降低发酵饮料中生物胺方面具有巨大潜力。
3 固定化酶在食品工业中的应用
3.1 在油脂改性中的应用
脂肪酶是一种能够显著提高油脂催化效率的绿色生物催化剂,在油脂工业中应用广泛,可通过水解、氨解、酯化、酯交换等反应达到油脂改性的目的[28]。如GAO等[29]成功合成了单分散核壳型磁性有机硅纳米花,并将其用作南极假丝酵母脂肪酶B(CALB)共价固定化的载体。CALB@纳米花可以有效地催化不同链长乙酰丙酸醇(正丁醇、正辛酸、正月桂醇)酯化反应合成乙酰丙酸烷基酯。回收10次后,CALB@纳米花保留了85%以上的催化合成乙酰丙酸丁酯的初始活性和96%以上的催化合成长链烷基乙酰丙酸酯的初始活性,具有可调皱纹通道的疏水纳米花的设计为酶的固定化开辟了一条新的途径以提高酶的催化活性和稳定性。MIAO等[30]利用戊二醛活化法将脂肪酶成功固定在磁性Fe3O4纳米粒子上,制备的固定化脂肪酶作为生物催化剂用于菜籽油与甲醇酯交换制备生物柴油。结果表明,在甲醇与油的摩尔比为6∶1的条件下,使用固定化脂肪酶作为催化剂,在45 ℃下反应24 h,转化为脂肪酸甲酯的最大转化率为89.4%,催化剂重复使用5次后,脂肪酸甲酯转化率保持在70%。
3.2 在果汁澄清中的应用
鲜果汁中果胶、淀粉、纤维素和半纤维素等多糖成分在储存过程中容易沉淀,形成混浊的果汁悬浮液,这是造成品质不佳的主要原因之一[31]。酶处理果汁可提高最终产品的产量、安全性、保质期和储存稳定性,同时保持果汁固有的营养品质。DAL等[32]制备3种不同尺寸的磁性壳聚糖颗粒并用于果胶酶的固定和果汁的澄清。研究发现,在橙汁澄清过程中固定化果胶酶经过25次间歇循环后,仍保持85%的初始活性。LADOLE等[33]通过交联将果胶酶和柚皮苷酶同时固定在环保型壳聚糖包覆磁性纳米粒子上,并评价了共固定化生物催化剂对葡萄柚汁的澄清和脱苦效果。结果表明,葡萄柚汁浊度降低约52%,柚皮苷含量降低约85%。共固定化酶可循环使用7次,残留活性为64%,在室温下保存30 d,残留活性为86%。目前已有将固定化酶技术应用于澄清苹果汁、菠萝汁、葡萄汁和胡萝卜汁等的报道[34-35]。
3.3 在乳制品生产中的应用
牛乳含有3.3%~3.5%的蛋白质,营养丰富,是母乳最好的替代品。但牛乳中的蛋白质可能会引起过敏反应,影响婴幼儿的生长发育,甚至威胁其生命。目前降低牛乳蛋白致敏性的主要方法是酶水解法,该法主要是通过蛋白质肽键的断裂,将过敏蛋白水解成小分子肽段,破坏其过敏位点[36],从而达到降低其致敏性的目的。FENG等[37]制备了Fe3O4纳米粒子与Cu2(PO4)2·3H2O新型纳米花催化材料,成功结合木瓜蛋白酶后水解牛乳致敏蛋白,SDS-PAGE显示,随着时间的增加,牛奶中的大部分致敏蛋白(β-乳球蛋白、α-乳白蛋白)在30 min时水解完全,酪蛋白也被大量水解,为低致敏性易消化牛奶的生产提供了一种新方法。
3.4 在食品检测中的应用
随着生活水平的不断提高,消费者对食品安全越来越重视。因此,准确有效地分析食品以获得有效的检测结果是一个亟待解决的问题。在众多检测技术中,磁性纳米粒子作为一种新的检测方法已被证明是检测食品安全的合适方法[38]。ZHANG等[39]提出了一种磁性石墨烯(G-Fe3O4)测定5种苯并咪唑类化合物(奥芬达唑、甲苯达唑、氟苯达唑、阿苯达唑和芬苯达唑)的新方法,并建立了基于G-Fe3O4磁性固相萃取和高效液相色谱联用的方法。测定了鸡肉、鸡血和鸡肝样品中的痕量苯并咪唑,这些样品中的奥芬达唑、甲苯达唑、氟苯达唑和芬苯达唑的浓度分别为13.0~20.2、1.62~4.64、1.94~6.42和0.292~1.04 ng/g。回收率为83.0%~115%,相对标准偏差小于7.9%。该方法灵敏、可靠,适用于食品中痕量苯并咪唑的分析。类似的,WANG等[40]开发了基于磁性沸石咪唑骨架-8(Fe3O4@ZIF-8)的简易磁性固相萃取技术,Fe3O4@ZIF-8与高效液相色谱联用为同时测定塑料包装饮料和食品中的聚合物添加剂提供了一种有效的富集和测定方法。TONG等[41]构建了对5种邻苯二甲酸酯(phthalic acid esters,PAEs)具有优异亲和力、良好可重复使用性和快速分离的核壳Fe3O4@石墨碳亚微米立方体,并与高效液相色谱联用,同时检测饮料和塑料瓶中的5种痕量PAEs。这不仅建立了一种同时测定5种PAEs的有效方法,还为以低成本、可回收餐巾纸为碳源设计或构建磁性石墨碳包覆核壳材料开辟了新的策略。
3.5 在生物活性肽制备中的应用
生物活性肽因具有降胆固醇、降血压、抗菌、抗氧化等生物活性而成为食品领域的研究热点[42]。马瑞娟等[43]采用磁性交联酶聚集体技术制备的固定化酶酶解鳀鱼蒸煮液制备蛋白多肽,并分析所制备水解肽的性能。分析酶解液的必需氨基酸指数>0.95,分子质量低于1 500 Da的小肽占82.52%,且具有较强的抗氧化性。KUAN等[44]将泛素样特异性蛋白酶1(sfULP1)固定在结合谷胱甘肽的磁性纳米颗粒上,然后切割泛素样修饰物并获得了胰高血糖素样肽-1(glucagon-like peptide 1,GLP-1)。GLP-1是一种低分子质量肽和肠促胰岛素激素,具有抗高血糖潜力,对2型糖尿病治疗有意义的肽激素。
4 展望
固定化酶以其高催化效率、高稳定性、可重复利用性已被广泛应用于食品工业的多个领域,但从长远发展来看,仍然有很多挑战。一方面,大多数固定化酶种类主要是脂肪酶、蛋白酶、淀粉酶等,而研究转移酶类、裂合酶类和异构酶类等相对较少。另一方面,固定化酶的复合材料制备成本相对较高,比如MOFs和COFs材料等。因此,未来可着重探索新的固定化技术和载体,制备多种酶共同固定;探究固定机理,获得具有高催化效应的新型固定化酶,降低生产成本,提高经济效益。随着生物技术、化学、材料等其他相关学科的发展,固定化酶将在食品、医药、环保等领域有更广阔的应用前景。
[1] LIU D M, CHEN J, SHI Y P.Advances on methods and easy separated support materials for enzymes immobilization[J].TrAC Trends in Analytical Chemistry, 2018, 102:332-342.
[2] CHIBATA I.Utilization of immobilized enzymes and immobilized microbial cells[J].Journal of Synthetic Organic Chemistry, Japan, 1974, 32(4):286-297.
[3] 刘茹, 焦成瑾, 杨玲娟, 等.酶固定化研究进展[J].食品安全质量检测学报, 2021, 12(5):1 861-1 869.
LIU R, JIAO C J, YANG L J, et al.Advances of enzyme immobilization[J].Journal of Food Safety & Quality, 2021, 12(5):1 861-1 869.
[4] XIA H, LI N, ZHONG X, et al.Metal-organic frameworks:A potential platform for enzyme immobilization and related applications[J].Frontiers in Bioengineering and Biotechnology, 2020, 8:695.
[5] ZHANG Q K, KANG J Q, YANG B, et al.Immobilized cellulase on Fe3O4 nanoparticles as a magnetically recoverable biocatalyst for the decomposition of corncob[J].Chinese Journal of Catalysis, 2016, 37(3):389-397.
[6] AKTER N, CHOWDHURY L, UDDIN J, et al.N-halamine functionalization of polydopamine coated Fe3O4 nanoparticles for recyclable and magnetically separable antimicrobial materials[J].Materials Research Express, 2018, 5(11):115007.
[7] YAMAURA M, CAMILO R L, SAMPAIO L C, et al.Preparation and characterization of (3-aminopropyl)triethoxysilane-coated magnetite nanoparticles[J].Journal of Magnetism and Magnetic Materials, 2004, 279(2-3):210-217.
[8] LIU S X, YU B, WANG S, et al.Preparation, surface functionalization and application of Fe3O4 magnetic nanoparticles[J].Advances in Colloid and Interface Science, 2020, 281:102165.
[9] 杜逸纯, 刘治华, 孙维凯.Fe3O4磁性微球制备技术的研究进展[J].新材料产业, 2020(5):65-71.
DU Y C, LIU Z H, SUN W K.Research progress in preparation technology of Fe3O4 magnetic microspheres[J].New Material Industry, 2020(5):65-71.
[10] YOU L J, XU K, DING G J, et al.Facile synthesis of Fe3O4@COF covalent organic frameworks for the adsorption of bisphenols from aqueous solution[J].Journal of Molecular Liquids, 2020, 320:114456.
[11] SARGAZI G, AFZALI D, EBRAHIMI A K, et al.Ultrasound assisted reverse micelle efficient synthesis of new Ta-MOF@ Fe3O4 core/shell nanostructures as a novel candidate for lipase immobilization[J].Materials Science and Engineering:C, 2018, 93:768-775.
[12] 陈海欣, 张赛男, 赵力民, 等.固定化酶:从策略到材料设计[J].生物加工过程, 2020, 18(1):88-95.
CHEN H X, ZHANG S N, ZHAO L M, et al.Enzyme immobilization:From strategies to materials design[J].Chinese Journal of Bioprocess Engineering, 2020, 18(1):88-95.
[13] AKHOND M, PASHANGEH K, KARBALAEI-HEIDARI H R, et al.Efficient immobilization of porcine pancreatic α-amylase on amino-functionalized magnetite nanoparticles:Characterization and stability evaluation of the immobilized enzyme[J].Applied Biochemistry and Biotechnology, 2016, 180(5):954-968.
[14] CHENG G R, XING J P, PI Z F, et al.α-glucosidase immobilization on functionalized Fe3O4 magnetic nanoparticles for screening of enzyme inhibitors[J].Chinese Chemical Letters, 2019, 30(3):656-659.
[15] SANKARAN R, SHOW P L, CHANG J S.Biodiesel production using immobilized lipase:Feasibility and challenges[J].Biofuels, Bioproducts and Biorefining, 2016, 10(6):896-916.
[16] YAN J, HAN B, GUI X, et al.Engineering yarrowia lipolytica to simultaneously produce lipase and single cell protein from agro-industrial wastes for feed[J].Scientific Reports, 2018, 8(1):1-10.
[17] WANG J Z, ZHAO G H, YU F Q.Facile preparation of Fe3O4@MOF core-shell microspheres for lipase immobilization[J].Journal of the Taiwan Institute of Chemical Engineers, 2016, 69:139-145.
[18] MOSAYEBI M, SALEHI Z, DOOSTHOSSEINI H, et al.Amine, thiol, and octyl functionalization of GO-Fe3O4 nanocomposites to enhance immobilization of lipase for transesterification[J].Renewable Energy, 2020, 154:569-580.
[19] 谭梦. 低抗原性乳清蛋白的酶法制备及风味改善[D].杭州:浙江大学, 2016.
TAN M.The preparation of low antigenic whey protein by enzyme and flavor improvement[D].Hangzhou:Zhejiang University, 2016.
[20] CAO Y, WEN L Y, SVEC F, et al.Magnetic AuNP@Fe3O4 nanoparticles as reusable carriers for reversible enzyme immobilization[J].Chemical Engineering Journal, 2016, 286:272-281.
[21] CHEN Z Q, WANG X M, CHEN Y, et al.Preparation and characterization of a novel nanocomposite with double enzymes immobilized on magnetic Fe3O4-chitosan-sodium tripolyphosphate[J].Colloids and Surfaces B:Biointerfaces, 2018, 169:280-288.
[22] CATHERINE H, PENNINCKX M, FRÉDÉRIC D.Product formation from phenolic compounds removal by laccases:A review[J].Environmental Technology & Innovation, 2016, 5:250-266.
[23] ZHANG K, YANG W Z, LIU Y, et al.Laccase immobilized on chitosan-coated Fe3O4 nanoparticles as reusable biocatalyst for degradation of chlorophenol[J].Journal of Molecular Structure, 2020, 1220:128769.
[24] CHEN H Y, TING Y W, KUO H C, et al.Enzymatic degradation of ginkgolic acids by laccase immobilized on core/shell Fe3O4/nylon composite nanoparticles using novel coaxial electrospraying process[J].International Journal of Biological Macromolecules, 2021, 172:270-280.
[25] YILMAZ E, SOYLAK M.Innovative, simple and green ultrasound assisted-enzyme based hydrolytic microextraction method for manganese at trace levels in food samples[J].Talanta, 2017, 174:605-609.
[26] LI W N, ZHANG X W, XUE Z Y, et al.Ginsenoside CK production by commercial snailase immobilized onto carboxylated chitosan-coated magnetic nanoparticles[J].Biochemical Engineering Journal, 2021, 174:108119.
[27] WANG L L, FAN M T, XING X, et al.Immobilization of glyceraldehyde-3-phosphate dehydrogenase on Fe3O4 magnetic nanoparticles and its application in histamine removal[J].Colloids and Surfaces B:Biointerfaces, 2021, 205:111917.
[28] 王琳琳, 高兴明, 韦海涛, 等.固定化酶在食品工业中的应用研究进展[J].轻工学报, 2021, 36(2):25-33.
WANG L L, GAO X M, WEI H T, et al.Research progress in the application of immobilized enzymes in food industry[J].Journal of Light Industry, 2021, 36(2):25-33.
[29] GAO J, KONG W X, ZHOU L Y, et al.Monodisperse core-shell magnetic organosilica nanoflowers with radial wrinkle for lipase immobilization[J].Chemical Engineering Journal, 2017, 309:70-79.
[30] MIAO C L, YANG L M, WANG Z M, et al.Lipase immobilization on amino-silane modified superparamagnetic Fe3O4 nanoparticles as biocatalyst for biodiesel production[J].Fuel, 2018, 224:774-782.
[31] DAL MAGRO L, HERTZ P F, FERNANDEZ-LAFUENTE R, et al.Preparation and characterization of a Combi-CLEAs from pectinases and cellulases:A potential biocatalyst for grape juice clarification[J].RSC Advances, 2016, 6(32):27 242-27 251.
[32] DAL MAGRO L, DE MOURA K S, BACKES B E, et al.Immobilization of pectinase on chitosan-magnetic particles:Influence of particle preparation protocol on enzyme properties for fruit juice clarification[J].Biotechnology Reports, 2019, 24:e00373.
[33] LADOLE M R, POKALE P B, VARUDE V R, et al.One pot clarification and debittering of grapefruit juice using co-immobilized enzymes@chitosanMNPs[J].International Journal of Biological Macromolecules, 2021, 167:1 297-1 307.
[34] HASSAN S S, WILLIAMS G A, JAISWAL A K.Computational modelling approach for the optimization of apple juice clarification using immobilized pectinase and xylanase enzymes[J].Current Research in Food Science, 2020, 3:243-255.
[35] KHARAZMI S, TAHERI-KAFRANI A, SOOZANIPOUR A.Efficient immobilization of pectinase on trichlorotriazine-functionalized polyethylene glycol-grafted magnetic nanoparticles:A stable and robust nanobiocatalyst for fruit juice clarification[J].Food Chemistry, 2020, 325:126890.
[36] TACIAS-PASCACIO V G, MORELLON-STERLING R, SIAR E H, et al.Use of Alcalase in the production of bioactive peptides:A review[J].International Journal of Biological Macromolecules, 2020, 165:2 143-2 196.
[37] FENG N, ZHANG H Y, LI Y, et al.A novel catalytic material for hydrolyzing cow’s milk allergenic proteins:Papain-Cu3(PO4)2·3H2O-magnetic nanoflowers[J].Food Chemistry, 2020, 311:125911.
[38] NING F J, QIU T T, WANG Q, et al.Dummy-surface molecularly imprinted polymers on magnetic graphene oxide for rapid and selective quantification of acrylamide in heat-processed (including fried) foods[J].Food Chemistry, 2017, 221:1 797-1 804.
[39] ZHANG Q C, LIU Y L, WANG X Y, et al.In situ synthesis of a magnetic graphene platform for the extraction of benzimidazoles from food samples and analysis by high-performance liquid chromatography[J].Journal of Analytical Methods in Chemistry, 2017, 2017:3018198.
[40] WANG J Q, LIU X R, WEI Y.Magnetic solid-phase extraction based on magnetic zeolitic imazolate framework-8 coupled with high performance liquid chromatography for the determination of polymer additives in drinks and foods packed with plastic[J].Food Chemistry, 2018, 256:358-366.
[41] TONG Y, LIU X Y, ZHANG L.Green construction of Fe3O4@GC submicrocubes for highly sensitive magnetic dispersive solid-phase extraction of five phthalate esters in beverages and plastic bottles[J].Food Chemistry, 2019, 277:579-585.
[42] 谢博, 傅红, 杨方.生物活性肽的制备、分离纯化、鉴定以及构效关系研究进展[J].食品工业科技, 2021, 42(5):383-391.
XIE B, FU H, YANG F.Research progress on preparation, purification, identification and structure-activity relationship of bioactive peptides[J].Science and Technology of Food Industry, 2021, 42(5):383-391.
[43] 马瑞娟, 林煌华, 谢友坪, 等.固定化酶制备鳀鱼蒸煮液蛋白肽及其性能表征[J].食品与发酵工业, 2020, 46(9):122-127.
MA R J, LIN H H, XIE Y P, et al.Preparation and characterization of peptides from anchovy cooking liquid using immobilized protease[J].Food and Fermentation Industries, 2020, 46(9):122-127.
[44] KUAN W C, LAI J W, LEE W C.Covalent binding of glutathione on magnetic nanoparticles:Application for immobilizing small fragment ubiquitin-like-specific protease 1[J].Enzyme and Microbial Technology, 2021, 143:109697.