近年来,植物的天然活性成分由于其来源丰富、活性显著及安全可靠等优点受到广泛的关注。植物天然活性成分的提取即从原材料中获得多酚类、黄酮类、有机酸、苷类、糖类、生物碱等活性成分的过程[1]。该过程是活性成分研究的基础也是关键,会直接影响到植物天然成分的活性。植物中天然活性成分的提取方法有传统的水蒸气蒸馏法、煎煮法、回流法等,也有现代的超声波辅助法、超临界流体萃取法、微波辅助法等[2-3]。传统的提取方法有一定的局限性,如效率低、溶剂用量大、提取时间长等,另外,提取成分还有可能会混入较多杂质,导致提取成分很难与杂质分离[4-5]。因此,传统提取方法和较新的提取技术将共同发展,在互补交叉的过程中诞生更方便快捷的提取技术。
基于超声波、超高压、回流加热等提取方法的特点,最早应用于乳制品的均质技术即高压均质(high pressure homogenization,HPH)技术进入了研究人员的视线。高压均质过程产生的空穴现象能够释放能量并产生强烈高频振动,其相当于超声的功能,液体物料高速的循环流动及其撞击时产生的效果可与回流加热产生的效果相媲美[6]。高压均质通过高频振荡、高速剪切、空穴、瞬时高压和瞬时低压等综合效应,将液体中颗粒粉碎至平均直径<1 μm,极大地增加了溶剂的穿透能力,同时,高压均质处理能够破坏细胞壁的结构,减少溶质扩散的阻力,从而加速可溶物的渗透和扩散,提高了目标产物的得率[7]。因此,将HPH技术应用于植物天然活性成分的提取中,可大大提高提取效率,且具有提取产物生理活性好、工艺操作简单、安全等优点[8]。
在植物天然活性成分提取方面,HPH技术属于较新的一种提取技术,本文通过对HPH技术进行简介,并综述了其在提取植物多糖、黄酮、多酚等活性成分中的应用,以期为HPH技术在植物天然活性成分提取的工业化应用提供理论依据。
1 高压均质技术简介
1.1 高压均质简介
高压均质技术,最早由AUGUSTE GAULIN发明并应用于乳制品的均质,其目的是为了提高乳制品的稳定性。传统的高压均质技术可大大减少液体物料的粒径,保证体系的稳定性,但由于均质机的处理压力较低(50 MPa),因此,其在食品加工方面的适用范围有限[9]。1990年后,市场上己有均质压力可达到150 MPa的小型试验设备及工业化设备,这些设备可以实现杀菌以及制备稳定的乳状液。LANCIOTTI等于1994年首次报道了HPH对于食品中致病菌和腐败微生物的抑制作用[10]。近年来随着相关技术和设备的发展,均质机的压力最大可以达到400 MPa,当均质压力超过200 MPa时,也被称为超高压均质(ultra high pressure homogenization, UHPH)[11]。目前HPH技术应用于食品工业中,一方面可以改变乳浊液的流变或者稳定性,液体高速通过均质阀缝隙产生湍流,液料被冲击到金属环上而产生强大撞击力以及因压力突降与突升而产生的空穴爆炸力等综合力的作用,使液体物料或以液体为载体的固体超微细化,物料微粒大小达到纳米级,提高产品品质和稳定性[9,12];另一方面,物料高速通过均质阀,压力突降,由于剪切、碰撞等的机械作用力转化为热能,整个HPH过程中物料可升温2.5 ℃/10 MPa,同时由于强烈的剪切力、碰撞力、空穴爆炸等综合作用,可实现杀菌、钝酶的作用[13-15];另外,利用剪切、高速撞击等综合效应可使植物物料达到破壁的效果,使细胞破碎[16-17]。因此,将HPH技术应用于植物天然活性成分的提取中,可使植物物料强烈的粉碎细化,并促使细胞破碎,使其活性物质最大限度的溶于提取溶剂中。
1.2 高压均质机的设备及机理
高压均质机主要由柱塞泵、均质阀、传动装置等构成,其均质过程如图1所示[18]。料液首先通过柱塞泵,柱塞泵的作用是将液体物料吸入泵体,同时对物料加压,物料再进入一级均质阀均质,一级均质阀的压力较大,主要起破碎均质作用,再进入二级均质阀均质,二级均质阀的压力较低,其压力大小直接影响到物料经过一级均质阀瞬间压力降的大小,直接关系到一级阀的加工效果,因此,二级均质阀的压力选择在总压力的10%~15%,主要起分散作用,其均质作用不明显[19]。
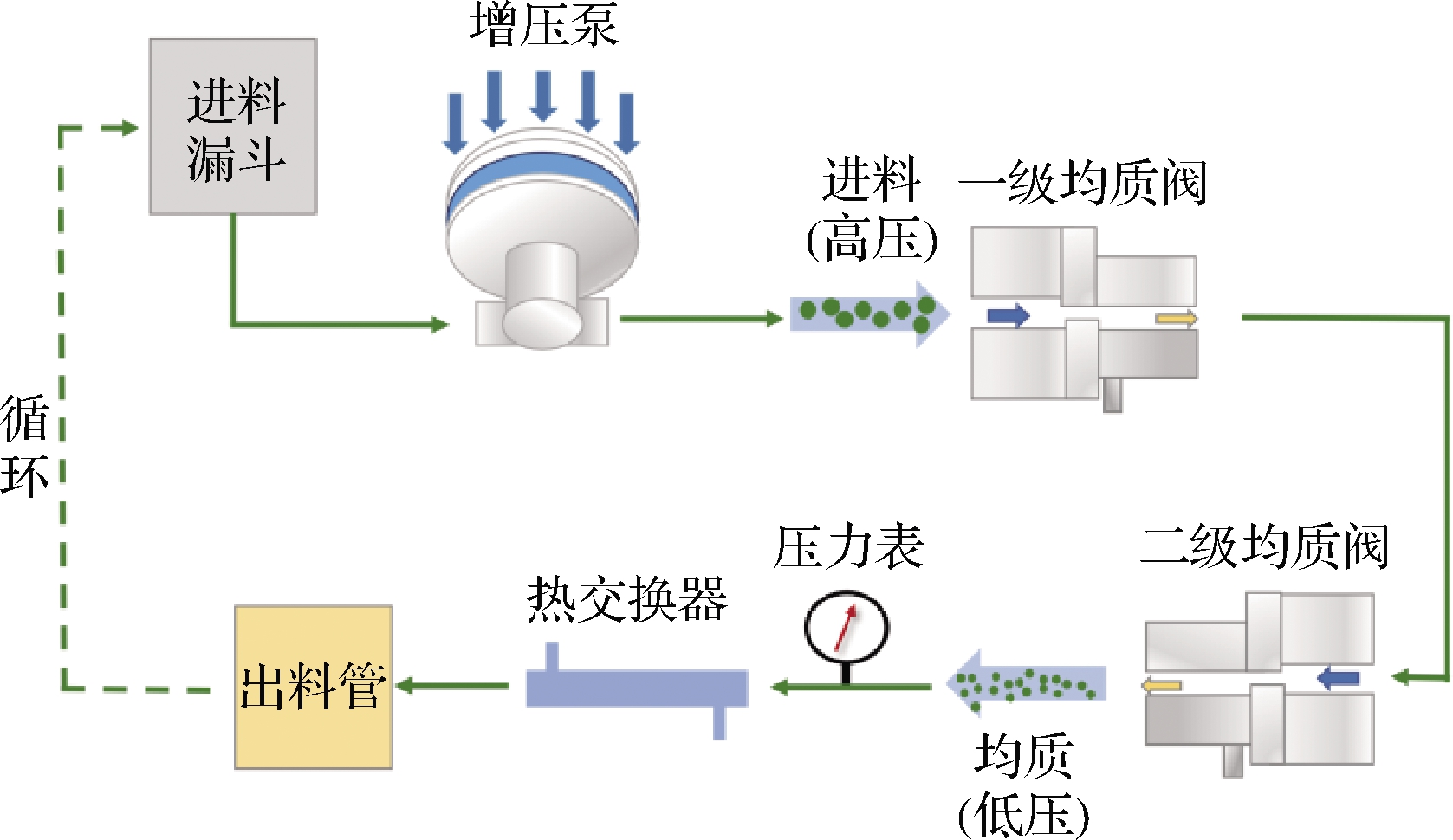
图1 高压均质系统(GEA的PandaPlus 2 000 均质器)的示意图[18]
Fig.1 Schematic of high-pressure homogenization system (PandaPlus 2 000 homogenizer, from GEA)[18]
高压均质机的工作原理如图2所示[20],尽管高压是均质机的驱动力,但主要工作在均质阀上。高压均质是利用柱塞泵为动力传递和输送液体物料的管道,柱塞泵吸入液体物料后并对液体物料加压,在柱塞作用下液体物料以高压低流速的状态进入压力可调节的均质阀中,液体物料在高压的作用下迅速通过特定宽度的均质阀缝隙,瞬间失压的液体物料以极高的流速(1 000~1 500 m/s)碰撞在撞击环上,产生了剪切、空穴和撞击等机械力作用[21]。剪切作用是指当物料通过均质阀缝隙时,其流速瞬间增加,物料随着涡流效应会产生强烈的剪切作用,使得物料颗粒被剪切成细微的小液滴[9,22];撞击效应是指被剪切粉碎的物料颗粒,通过均质阀后又强烈地撞击到碰撞环上,造成物料进一步的破碎[22];空穴效应是指在高压状态下,当流体离开阀门时,流体流通面积的增加会降低其速度,出口处的压力突然释放回到大气压,这个过程会使液料形成大量的汽泡,随后汽泡破裂引起空穴爆炸会导致破碎效果,同时也产生了剧烈的高频振动,从而使物料粉碎细化[20,23]。另外,当物料进入高压均质机后,高压均质机内部首先达到设定的压力,该过程可导致内部物料温度的升高(2.5 ℃/10 MPa),然后物料高速通过均质阀,压力会降低,由于剪切、碰撞等的机械作用力转化为热能,整个高压均质过程中物料可升温16~22 ℃/100 MPa[10,24]。基于这些效应可用于对植物细胞的破碎、对植物物料的粉碎细化,促进植物活性物质最大限度的溶于提取溶剂中[25-26]。

图2 高压均质作用工作原理示意图[20]
Fig.2 Schematic of the working principle of high-pressure homogenization[20]
2 HPH在提取植物天然活性成分中的应用
2.1 高压均质提取特点
传统的提取方法从细胞内渗透出的不仅有提取成分还会混入较多杂质,导致提取成分很难与杂质分离,同时,提取效率低,会造成资源的浪费。近年来现代新型仪器如微波、超声波、超高压等技术得到了快速发展,新技术的应用提高了植物活性成分的得率,且提取所获得的物质生物活性良好。而高压均质技术作为一种新型提取方法,其提取效果比其他提取方式更高效。用高压均质提取植物天然活性成分具有下述5个特点[6-7,17,20]:HPH技术集超声波、超高压、加热回流等效果于一体,提取效果更高效;HPH是一种非热加工技术,工作温度低,高压均质提取过程是卸压、加压交替的过程,高压容器和外界环境有着良好的热交换,在整个提取过程中基本可以维持在室温下进行,最大程度地保留了植物中生物活性物质及各种营养成分的天然结构,避免了因热效应引起的有效成分变性、损失、药理活性降低等问题,可保持提取的活性成分的原有性质;HPH技术可以使物料颗粒的大小达到纳米级,极大地破碎植物细胞组织结构,更有利于活性成分的溶出;HPH可以提取水溶性成分、脂溶性成分及溶于有机溶剂的成分;HPH设备简单,能耗低,可单独使用,提取时间短。
2.2 植物天然活性成分的提取
2.2.1 多糖类化合物提取
多糖一般是由10个以上的单糖以糖苷键组成的大分子碳水化合物,天然植物多糖属于植物体内一类极其重要的生物大分子,是维持生命活动能够正常运转的基本物质。同时,植物多糖具有如抗凝血、抗肝损伤、抗肿瘤、抗病毒、降血糖等生理活性[27]。多糖的生物活性与其结构特征有着密切的关系,多糖的结构特征主要包括单糖组分、糖苷键的类型、支链、空间构型、取代基的种类及数量等[27]。另外,多糖分子质量大、空间结构复杂及聚合度高等特征会阻碍多糖生物活性的发挥。HPH由于其高剪切力等作用可以使多糖的部分糖苷键断裂,降低多糖的分子质量,从而提高多糖的生物活性,HPH还可以提高多糖的得率。
在HPH处理过程中,多糖的提取率得到了很大的提升,翟天龙[28]通过高压均质与超滤技术联合提取细茎石斛多糖,与水提醇沉法作对比,多糖的提取率提高了将近50%。通过对多糖进行分析,发现高压均质与超滤技术联合提取的石斛多糖第一溶点较水提醇沉法提取的石斛多糖推迟了4 ℃,这可能是由于HPH作用破坏了大分子多糖分子之间的氢键作用力引起的,并且多糖黏度的下降也可能与这一原因有关。龚劲松等[29]比较了HPH、超声辅助、热水浸提3种方法提取猴头菌胞内多糖的产品得率,研究发现HPH法得率最高,提取的多糖最终分子质量相对偏低,这可能是由于机械剪切力等的作用使多糖部分糖苷键断裂引起的。另外,通过红外光谱分析发现,3种提取方法所提取的多糖一级结构基本保持一致。ELAIN等[18]研究了高压均质提取螺旋藻多糖的效果,多糖的得率最高为(15.1±0.8)%,是常规热水方法的2.5倍,另外,螺旋藻多糖的高效凝胶渗透色谱图显示一个主要的对称峰,其平均分子质量为1 810 kDa,提取物分子质量高且分子质量分布曲线为单峰,可以推断高压均质并没有引起多糖分子中重要键的断裂,因此,高压均质具有提取效率高、不破坏多糖结构等优点。LIU等[30]通过HPH处理提取沙棘多糖,经过分离纯化,纯化出了沙棘多糖的组分(tricholoma lobayense heim,TLH-3′),通过自由基清除实验发现,TLH-3′具有同VC相当的抗氧化活性。XIE等[31]通过高压均质处理提取紫肉马铃薯多糖,结果发现HPH改变了紫肉马铃薯多糖中单糖的组成,葡萄糖含量由51.9%下降到4.1%,阿拉伯糖含量从17.1%上升到83.5%,可溶性膳食纤维含量从17.9%上升到39.3%。
研究表明,高压均质可减小物质的粒度并改变其微观结构。胡婕伦[32]研究发现高压均质处理后,车前子多糖粒径减小,整块的片状形态变成了带孔的碎片,增加了多糖多孔性,但高压均质处理后并没有改变多糖的基本结构。ZHANG等[33]通过高压均质处理对柑橘膳食纤维进行改性,发现均质后的柑橘膳食纤维具有多孔结构,并出现晶区结构被破坏的现象,同时膳食纤维的内部结构变得松散。此外,也有人运用高压均质技术研究了芦笋多糖、茯苓多糖等其他植物多糖,其提取工艺及产品得率如表1所示。
高压均质提取多糖类化合物的研究表明,均质时间、压强、料液比和均质次数等参数的优化,以及与其他方法的协同作用都对提取植物多糖的得率有显著的影响,并且高压均质可以极大地提高细胞的破碎率,增加多糖产品的得率,因此,高压均质提取技术是提取植物多糖的一种有效方法。
2.2.2 黄酮类化合物提取
黄酮类化合物是一类具有2-苯基色原酮结构的植物次级代谢产物,广泛存在于植物界。该类化合物以C6—C3—C6结构为基础,黄酮类化合物因结构不同,表现出来的生物活性差别很大,在自然界中最常见的是黄酮和黄酮醇,其他包括双黄酮、双氢黄(醇)、异黄酮、橙酮、黄烷醇、查尔酮及新黄酮类等[39-40]。试验表明,黄酮类化合物具有抗癌、抗氧化、消炎、抗病毒、镇痛等作用[41]。常见的提取黄酮类化合物的方法有溶剂法、超声提取法、超临界流体萃取法、酶解法、HPH等,其中HPH处理可极大地提高黄酮的提取率。
表1 高压均质提取多糖类化合物
Table 1 HPH on extraction of polysaccharides
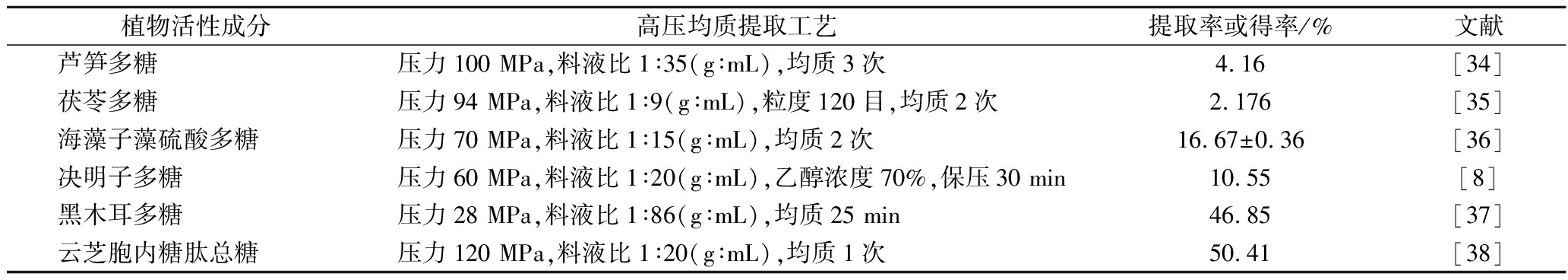
植物活性成分高压均质提取工艺提取率或得率/%文献芦笋多糖压力100 MPa,料液比1∶35(g∶mL),均质3次4.16[34]茯苓多糖压力94 MPa,料液比1∶9(g∶mL),粒度120目,均质2次2.176[35]海藻子藻硫酸多糖压力70 MPa,料液比1∶15(g∶mL),均质2次16.67±0.36[36]决明子多糖压力60 MPa,料液比1∶20(g∶mL),乙醇浓度70%,保压30 min10.55[8]黑木耳多糖压力28 MPa,料液比1∶86(g∶mL),均质25 min46.85[37]云芝胞内糖肽总糖压力120 MPa,料液比1∶20(g∶mL),均质1次50.41[38]
朱颖[41]通过高压均质技术从黄芩中提取了黄芩苷和黄芩素,研究发现高压均质处理后的颗粒比提取前减少了近6倍,从而增大了颗粒与溶剂接触的表面积,减小传质阻力,极大地促进了有效成分的溶出。刘增根等[42]利用高压均质提取柴达木枸杞叶黄酮,并与微波法、超声法和回流法进行对比。发现高压均质技术提取黄酮的提取率最高,高压均质各因素对提取黄酮的影响主次顺序为提取压力>乙醇体积分数>料液比>提取时间,高压均质提取方法操作简便,提取的黄酮生物活性高。钟汉左等[6]利用高压均质提取山楂叶黄酮并与超声和回流提取作对比,试验通过正交设计确定了高压均质提取山楂叶黄酮最优的工艺参数为:均质压力60 MPa,乙醇浓度70%,料液比1∶30,均质时间30 min,最终得率为8.39%,比超声提取提高了14.46%,比回流提取提高了8.12%,另外研究发现,3种提取方式的HPLC指纹图谱主要峰的出峰时间相同,高压均质提取的物质未发生变化,但峰的整体高度不同,高压均质提取的图谱峰值最高,提取率最高,同时高压均质提取具有提取时间短,经济安全等特点。谢亚[8]采用高压均质提取技术提取中药决明子中的黄酮,提取率为1.233%。与超声和回流提取方法进行比较,3种提取方法的HPLC指纹图谱中峰形相似,但高压均质提取的黄酮峰值最高。结果表明,高压均质提取决明子黄酮,其提取率最高且用时最短,高压均质提取的黄酮物质结构未发生变化。ZHU等[26]研究了碱和高压均质对马铃薯皮中黄酮类化合物提取的影响,经0.1 mol/L NaOH溶液处理18 h,总黄酮得率从2.61 mg/g提高至3.63 mg/g,高压均质处理将其增加到3.11 mg/g。此外,结合碱和高压均质处理,可以在0.1 mol/L NaOH处理12 h后,将总黄酮含量升高到3.95 mg/g,高压均质可以显著减小马铃薯皮的颗粒尺寸,从而产生较小的纤维素碎片和较小的球体,促进了黄酮类物质的释放,高压均质在破碎植物细胞方面具有独特的优势,因此,细胞内容物能够得到最大程度的释放。
研究发现,高压均质技术不仅可以提高黄酮类化合物的提取得率,而且经高压均质处理后黄酮类化合物具有更强的生物活性,并且经HLPC指纹图谱、扫描电镜等分析后,发现高压均质得到的黄酮提取物结构没有发生改变,因此,高压均质提取法是提取黄酮类化合物的一种良好选择。
2.2.3 多酚类化合物提取
植物多酚种类繁多,大多数植物酚类化合物都来源于一种常见的中间体-苯丙氨酸,或一种类似的前体-莽草酸。多酚主要包括类酚酸、木酚素、姜黄素、单宁和芪类化合物。植物多酚具有抗氧化、抗衰老、抗炎、防辐射等多种生物活性,因此近年来对植物多酚的研究极为迅速[43]。植物多酚常用的提取方法有超声波提取法,微波提取法,闪式提取法等,HPH法提取可提高多酚的提取率,增加多酚的生物活性。
JURI [44]通过高压均质处理番茄皮中的多酚,发现与高速剪切处理的悬浮液相比,经 HPH 处理的悬浮液表现出较好的抗氧化活性。通过 FRAP 方法测量的抗氧化活性相对于高速剪切悬浮液增加了 23.3%,从(220.7±0.6)增加到 (272.2±0.8) μmol AAE/L,这对应于总多酚增加了32.2%。符群等[45]研究了球磨法和高压均质法2种超微粉碎法对薇菜多酚保留的影响,对比球磨法和常规粉碎方法,高压均质处理的薇菜总多酚提取量增加了8.8 g/100 g,高压均质法对物料的粉碎粒度是常规粉碎的1/65,且总多酚的提取量显著高于常规粉碎的提取量,高压均质对薇菜粉碎得更充分,且有效保留了薇菜中的活性成分。张露等[46]研究了动态高压微射流预处理对甘薯叶多酚提取物抗氧化性的影响,动态高压微射流是高压均质技术中的一种,研究发现当均质压力为120 MPa时多酚的得率最高,为18.62 mg GAE/g DM,且提高了多酚的抗氧化能力,而当甘薯叶多酚溶液再经过动态高压微射流处理时,发现其对总酚含量以及多酚的体外抗氧化性无显著影响,因此,可以判断动态高压微射流是通过改变物料粒度,增加物料的接触面积来提高多酚的得率,并提高其抗氧化性,同时,动态高压微射流未改变甘薯叶中多酚的基本结构,也未引起其氧化降解。ZHU等[26]研究了碱和高压均质处理对马铃薯皮中酚酸提取的影响,发现通过高压均质处理后,总酚含量/提取量从2.88升高到3.67 mg/g,联合碱液和高压均质处理可使总酚提取量达到4.16 mg/g。通过扫描电镜观察NaOH和高压均质处理的马铃薯皮结构的变化,如图3所示,观察到图3-d~图3-f中的椭圆形颗粒是淀粉,高压均质后土豆皮结构遭到了破坏,粗纤维断裂,并产生了许多较小的片段,而图3-a~图3-c中土豆皮的表面是完整的、紧密的。因此,经高压均质处理破坏了马铃薯皮的结构,纤维结构上的多酚被释放出来,从而导致了产品总酚得率的增加。
[44]通过高压均质处理番茄皮中的多酚,发现与高速剪切处理的悬浮液相比,经 HPH 处理的悬浮液表现出较好的抗氧化活性。通过 FRAP 方法测量的抗氧化活性相对于高速剪切悬浮液增加了 23.3%,从(220.7±0.6)增加到 (272.2±0.8) μmol AAE/L,这对应于总多酚增加了32.2%。符群等[45]研究了球磨法和高压均质法2种超微粉碎法对薇菜多酚保留的影响,对比球磨法和常规粉碎方法,高压均质处理的薇菜总多酚提取量增加了8.8 g/100 g,高压均质法对物料的粉碎粒度是常规粉碎的1/65,且总多酚的提取量显著高于常规粉碎的提取量,高压均质对薇菜粉碎得更充分,且有效保留了薇菜中的活性成分。张露等[46]研究了动态高压微射流预处理对甘薯叶多酚提取物抗氧化性的影响,动态高压微射流是高压均质技术中的一种,研究发现当均质压力为120 MPa时多酚的得率最高,为18.62 mg GAE/g DM,且提高了多酚的抗氧化能力,而当甘薯叶多酚溶液再经过动态高压微射流处理时,发现其对总酚含量以及多酚的体外抗氧化性无显著影响,因此,可以判断动态高压微射流是通过改变物料粒度,增加物料的接触面积来提高多酚的得率,并提高其抗氧化性,同时,动态高压微射流未改变甘薯叶中多酚的基本结构,也未引起其氧化降解。ZHU等[26]研究了碱和高压均质处理对马铃薯皮中酚酸提取的影响,发现通过高压均质处理后,总酚含量/提取量从2.88升高到3.67 mg/g,联合碱液和高压均质处理可使总酚提取量达到4.16 mg/g。通过扫描电镜观察NaOH和高压均质处理的马铃薯皮结构的变化,如图3所示,观察到图3-d~图3-f中的椭圆形颗粒是淀粉,高压均质后土豆皮结构遭到了破坏,粗纤维断裂,并产生了许多较小的片段,而图3-a~图3-c中土豆皮的表面是完整的、紧密的。因此,经高压均质处理破坏了马铃薯皮的结构,纤维结构上的多酚被释放出来,从而导致了产品总酚得率的增加。

a-0 mol/L NaOH处理;b-0.1 mol/L NaOH处理; c-0.4 mol/L NaOH处理;d-HPH处理; e-0.1 mol/L NaOH+HPH处理; f-0.4 mol/L NaOH+ HPH处理[27]
图3 马铃薯皮的扫描电子显微镜照片
Fig.3 Scanning electron micrographs of potato peels
由于多酚类化合物在高温下不稳定,高压均质提取过程没有高温加热,从而在一定程度上减少了高温对多酚结构的破坏;同时,高压均质所用仪器简单,自动化程度较高,操作简便,因此,高压均质为提取多酚类化合物提供了新思路。
2.2.4 其他生物活性物质
高压均质技术除了应用到多糖、黄酮、多酚等活性成分的提取之外,潘鹤林等[47]还研究了黄姜皂素等其他生物活性物质,如表2所示,高压均质提取比超声提取、回流提取和微波提取等方式效率高,且高压均质提取操作简便,提高了活性成分的生物活性,因此,可以作为提取植物天然活性成分的良好选择。
表2 高压均质提取其他生物活性物质
Table 2 HPH on extraction of other biologically active substances
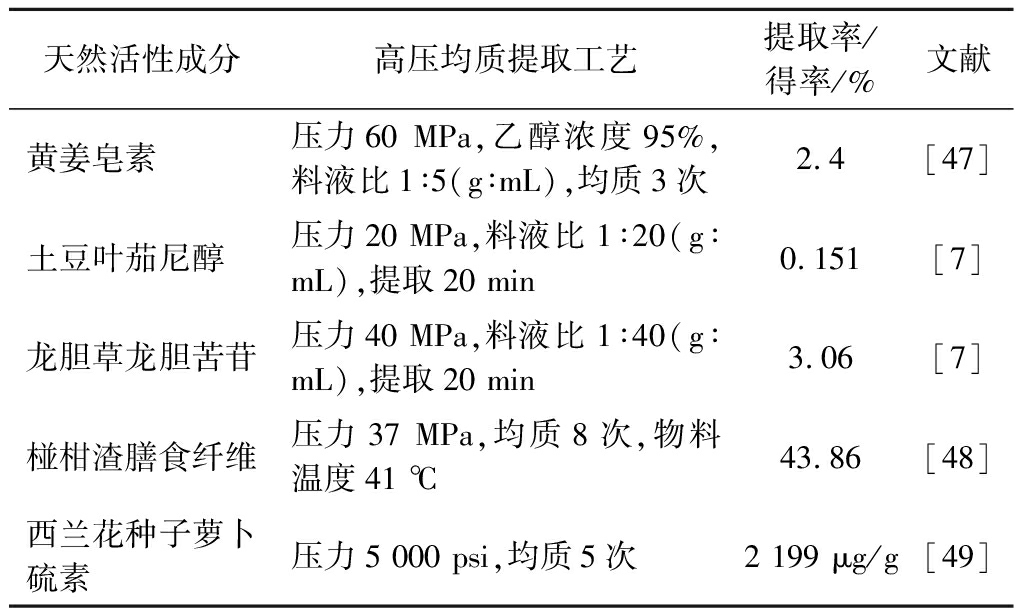
天然活性成分高压均质提取工艺提取率/得率/%文献黄姜皂素压力60 MPa,乙醇浓度95%,料液比1∶5(g∶mL),均质3次2.4[47]土豆叶茄尼醇压力20 MPa,料液比1∶20(g∶mL),提取20 min0.151[7]龙胆草龙胆苦苷压力40 MPa,料液比1∶40(g∶mL),提取20 min3.06[7]椪柑渣膳食纤维压力37 MPa,均质8次,物料温度41 ℃43.86[48]西兰花种子萝卜硫素压力5 000 psi,均质5次2 199 μg/g[49]
3 结论
HPH作为一种新型的植物天然活性成分提取技术,具有提取效率高、提取产物活性强、工艺操作简单、安全等优点,均质压力,均质次数是对植物天然活性成分提取率和稳定性产生影响的关键因素。在HPH处理后,各种植物天然活性成分的稳定性能得到最大程度的保留。为提高HPH技术在提取天然活性成分方面的应用,还需开发新型的设备材料,以提高均质阀的抗压、耐腐蚀等性能。随着科技的进步和仪器设备的发展,高压均质技术将会在提取天然活性成分方面的应用更加广泛。
[1] ROOHINEJAD S, KOUBAA M, BARBA F J, et al.Negative pressure cavitation extraction:A novel method for extraction of food bioactive compounds from plant materials[J].Trends in Food Science & Technology, 2016, 52:98-108.
[2] KUMAR M, DAHUJA A, TIWARI S, et al.Recent trends in extraction of plant bioactives using green technologies:A review[J].Food Chemistry, 2021, 353:129431.
[3] MALA T, SADIQ M B, ANAL A K.Comparative extraction of bromelain and bioactive peptides from pineapple byproducts by ultrasonic- and microwave-assisted extractions[J].Journal of Food Process Engineering, 2021, 44(6):e137009.
[4] QIN D Y, XI J.Flash extraction:An ultra-rapid technique for acquiring bioactive compounds from plant materials[J].Trends in Food Science & Technology, 2021, 112:581-591.
[5] QI X L, PENG X, HUANG Y Y, et al.Green and efficient extraction of bioactive flavonoids from Equisetum palustre L.by deep eutectic solvents-based negative pressure cavitation method combined with macroporous resin enrichment[J].Industrial Crops and Products, 2015, 70:142-148.
[6] 钟汉左, 梁勇, 胡江涌, 等.高压均质提取山楂叶有效成分[J].精细化工, 2007, 24(9):890-894;909.
ZHONG H Z, LIANG Y, HU J Y, et al.Extraction of the main functional components from hawthorn leaves by high pressure homogenization method[J].Fine Chemicals, 2007, 24(9):890-894;909.
[7] 胡江涌. 天然产物中有效成分的高压均质提取和高速逆流色谱分离技术研究[D].广州:华南师范大学, 2007.
HU J Y.Research on high pressure homogenous extraction and high-speed countercurrent chromatography separation technology of active ingredients in natural products[D].Guangzhou:South China Normal University, 2007.
[8] 谢亚. 中药决明子有效成分提取分离及结构的电喷雾串联质谱(ESI-MS~n)研究[D].广州:华南师范大学, 2007.
XIE Y.Study on the extraction, separation and structure of effective components of cassia seed in traditional Chinese medicine by electrospray tandem mass spectrometry (ESI-MS~n) [D].Guangzhou:South China Normal University, 2007.
[9] MARTíNEZ-MONTEAGUDO S I, YAN B, BALASUBRAMANIAM V M.Engineering process characterization of high-pressure homogenization—from laboratory to industrial scale[J].Food Engineering Reviews, 2017, 9(3):143-169.
[10] SEVENICH R, MATHYS A.Continuous versus discontinuous ultra-high-pressure systems for food sterilization with focus on ultra-high-pressure homogenization and high-pressure thermal sterilization:A review[J].Comprehensive Reviews in Food Science and Food Safety, 2018, 17(3):646-662.
[11] BEVILACQUA A, CAMPANIELLO D, SPERANZA B, et al.Two nonthermal technologies for food safety and quality-ultrasound and high pressure homogenization:Effects on microorganisms, advances, and possibilities:A review[J].Journal of Food Protection, 2019, 82(12):2 049-2 064.
[12] 巴根纳. 液态乳制品加工均质工艺研究[D].北京:中国农业科学院, 2007.
BA G N.The research of homogenization processing in liquid milk[D].Beijing:Chinese Academy of Agricultural Sciences, 2007.
[13] LOIRA I, MORATA A, BA UELOS M A, et al.Use of ultra-high pressure homogenization processing in winemaking:Control of microbial populations in grape musts and effects in sensory quality[J].Innovative Food Science & Emerging Technologies, 2018, 50:50-56.
UELOS M A, et al.Use of ultra-high pressure homogenization processing in winemaking:Control of microbial populations in grape musts and effects in sensory quality[J].Innovative Food Science & Emerging Technologies, 2018, 50:50-56.
[14] DOS SANTOS AGUILAR J G, CRISTIANINI M, SATO H H.Modification of enzymes by use of high-pressure homogenization[J].Food Research International, 2018, 109:120-125.
[15] 马亚琴, 贾蒙, 张晨.高压均质技术在果汁加工中的应用[J].食品与发酵工业, 2021, 47(3):265-273.
MA Y Q, JIA M, ZHANG C.Application of high-pressure homogenization technology in fruit juice processing[J].Food and Fermentation Industries, 2021, 47(3):265-273.
[16] SARICAOGLU F T, ATALAR I, YILMAZ V A, et al.Application of multi pass high pressure homogenization to improve stability, physical and bioactive properties of rosehip (Rosa canina L.) nectar[J].Food Chemistry, 2019, 282:67-75.
[17] PICART-PALMADE L, CUNAULT C, CHEVALIER-LUCIA D, et al.Potentialities and limits of some non-thermal technologies to improve sustainability of food processing[J].Frontiers in Nutrition, 2019, 5:130.
[18] ELAIN A, NKOUNKOU C, FELLIC M, et al.Green extraction of polysaccharides from Arthrospira platensis using high pressure homogenization[J].Journal of Applied Phycology, 2020, 32(3):1 719-1 727.
[19] 董海胜, 陈斌.高压均质处理对微胶囊油脂乳液稳定性的影响研究[J].饮料工业, 2008, 11(7):17-21.
DONG H S, CHEN B.Studies on effects of high-pressure homogenization on stability of microencapsulated lipid lotion[J].The Beverage Industry, 2008, 11(7):17-21.
[20] LEVY R, OKUN Z, SHPIGELMAN A.High-pressure homogenization:Principles and applications beyond microbial inactivation[J].Food Engineering Reviews, 2021, 13(3):490-508.
[21] YONG S X M, SONG C P, CHOO W S.Impact of high-pressure homogenization on the extractability and stability of phytochemicals[J].Frontiers in Sustainable Food Systems, 2021, 4:593259.
[22] SARICAOGLU F T, GUL O, BESIR A, et al.Effect of high pressure homogenization (HPH) on functional and rheological properties of hazelnut meal proteins obtained from hazelnut oil industry by-products[J].Journal of Food Engineering, 2018, 233:98-108.
[23] 王彦增. 均质处理对生鲜牛乳近红外漫反射光谱的影响及机理研究[D].杨凌:西北农林科技大学, 2019.
WANG Y Z.Effect of homogenization on near-infrared diffuse reflectance spectra of milk and its mechanism research[D].Yangling:Northwest A & F University, 2019.
[24] PATRIGNANI F, LANCIOTTI R.Applications of high and ultra high pressure homogenization for food safety[J].Frontiers in Microbiology, 2016, 7:1 132.
[25] LOIRA I, MORATA A, BA UELOS M A, et al.Use of ultra-high pressure homogenization processing in winemaking:Control of microbial populations in grape musts and effects in sensory quality[J].Innovative Food Science & Emerging Technologies, 2018, 50:50-56.
UELOS M A, et al.Use of ultra-high pressure homogenization processing in winemaking:Control of microbial populations in grape musts and effects in sensory quality[J].Innovative Food Science & Emerging Technologies, 2018, 50:50-56.
[26] ZHU X D, CHENG Y L, CHEN P, et al.Effect of alkaline and high-pressure homogenization on the extraction of phenolic acids from potato peels[J].Innovative Food Science & Emerging Technologies, 2016, 37:91-97.
[27] 谭西, 周欣, 陈华国.植物多糖构效关系研究进展[J].中国中药杂志, 2017, 42(21):4 104-4 109.
TAN X, ZHOU X, CHEN H G.Structure-activity relationship of plant polysaccharides[J].China Journal of Chinese Materia Medica, 2017, 42(21):4 104-4 109.
[28] 翟天龙. 高压均质联合超滤技术提取细茎石斛多糖及其性质和活性[D].合肥:安徽大学, 2013.
ZHAI T L.Extraction and properties as well as biological activity of polysaccharide from Dendrobium moniliforme by high-pressure homogenization combine with ultrafiltration technology[D].Hefei:Anhui University, 2013.
[29] 龚劲松, 袁峰, 袁兵兵, 等.高压均质法提取药用真菌多糖的研究[J].生物学杂志, 2018, 35(4):29-33.
GONG J S, YUAN F, YUAN B B, et al.The investigation on extraction of fungal polysaccharide via high-pressure homogenization strategy[J].Journal of Biology, 2018, 35(4):29-33.
[30] LIU L, LU Y M, LI X H, et al.A novel process for isolation and purification of the bioactive polysaccharide TLH-3′ from Tricholoma lobayense[J].Process Biochemistry, 2015, 50(7):1 146-1 151.
[31] XIE F, LI M, LAN X H, et al.Modification of dietary fibers from purple-fleshed potatoes (Heimeiren) with high hydrostatic pressure and high pressure homogenization processing:A comparative study[J].Innovative Food Science & Emerging Technologies, 2017, 42:157-164.
[32] 胡婕伦. 大粒车前子多糖体内外消化与酵解特征体系构建及其促进肠道健康的作用[D].南昌:南昌大学, 2014.
HU J L.Establishment of a system for in vitro and in vivo studies on digestion and fermentation of polysaccharide from seeds of Plantago asiatica L.with its beneficial effects on intestinal health[D].Nanchang:Nanchang University, 2014.
[33] ZHANG Y, QI J R, ZENG W Q, et al.Properties of dietary fiber from Citrus obtained through alkaline hydrogen peroxide treatment and homogenization treatment[J].Food Chemistry, 2020, 311:125873.
[34] 付建鑫, 张桂香, 邵家威, 等.高压均质优化提取芦笋多糖及抗氧化能力的研究[J].农产品加工, 2019(1):44-48.
FU J X, ZHANG G X, SHAO J W, et al.Study on optimization of extraction of Asparagus polysaccharides by high pressure homogenization and antioxidant capability[J].Farm Products Processing, 2019(1):44-48.
[35] 闫明, 韦迎春, 杨晶, 等.响应面法优化茯苓多糖提取工艺[J].药学与临床研究, 2016, 24(5):365-367.
YAN M, WEI Y C, YANG J, et al.Pachymaran extraction by response surface methodology[J].Pharmaceutical and Clinical Research, 2016, 24(5):365-367.
[36] LI G Y, LUO Z C, YUAN F, et al.Combined process of high-pressure homogenization and hydrothermal extraction for the extraction of fucoidan with good antioxidant properties from Nemacystus decipients[J].Food and Bioproducts Processing, 2017, 106:35-42.
[37] 胡俊飞. 高压均质降解黑木耳多糖硫酸酯化衍生物抗辐射作用研究[D].哈尔滨:哈尔滨工业大学, 2016.
HU J F.The radioprotective effect of sulfated Auricularia auricula polysaccharide degraded by high pressure homogenization[D].Harbin:Harbin Institute of Technology, 2016.
[38] 钱强, 陆震鸣, 许泓瑜.高压均质法提取云芝胞内糖肽[J].食用菌, 2010, 32(3):67-68.
QIAN Q, LU Z M, XU H Y.Extraction of intracellular polysaccharopeptide from Coriolus versicolor mycelium using hot water and high-pressure homogenization[J].Edible Fungi, 2010, 32(3):67-68.
[39] 孙玉敏. 植物黄酮抗肿瘤作用的研究进展[J].中西医结合心血管病电子杂志, 2020, 8(7):15-16.
SUN Y M.Research progress on anti-tumor effects of plant flavonoids[J].Cardiovascular Disease Electronic Journal of Integrated Traditional Chinese and Western Medicine, 2020, 8(7):15-16.
[40] 张蓓蓓. 植物黄酮类化合物的研究[J].科技视界, 2018(23):155-157.
ZHANG B B.Study on plant flavonoids[J].Science & Technology Vision, 2018(23):155-157.
[41] 朱颖. 高压均质技术提取天然产物中有效成分的研究[D].杭州:浙江工业大学, 2015.
ZHU Y.Extraction of active ingredients from Scutellaria by high pressure homogenization[D].Hangzhou:Zhejiang University of Technology, 2015.
[42] 刘增根, 党军, 江磊, 等.柴达木枸杞叶有效成分高压均质提取及纯化[J].精细化工, 2011, 28(4):350-354.
LIU Z G, DANG J, JIANG L, et al.High pressure homogenization extraction and purification of the main functional components from medlar leaves of Qaidam Basin[J].Fine Chemicals, 2011, 28(4):350-354.
[43] 吴常月, 宋春莲, 刘永波, 等.植物多酚的提取及在动物上的应用研究进展[J].中兽医医药杂志, 2018, 37(3):76-79.
WU C Y, SONG C L, LIU Y B, et al.Research progress of extracting methods of plant polyphenols and its application in animals[J].Journal of Traditional Chinese Veterinary Medicine, 2018, 37(3):76-79.
[44] JURI S, FERRARI G, VELIKOV K P, et al.High-pressure homogenization treatment to recover bioactive compounds from tomato peels[J].Journal of Food Engineering, 2019, 262:170-180.
S, FERRARI G, VELIKOV K P, et al.High-pressure homogenization treatment to recover bioactive compounds from tomato peels[J].Journal of Food Engineering, 2019, 262:170-180.
[45] 符群, 李卉, 王路, 等.球磨法和均质法改善薇菜粉物化及功能性质[J].农业工程学报, 2018, 34(9):285-291.
FU Q, LI H, WANG L, et al.Ball milling and homogenization improving physicochemical and functional properties of Osmunda japonica Thunb[J].Transactions of the Chinese Society of Agricultural Engineering, 2018, 34(9):285-291.
[46] 张露, 卢遇, 涂宗财, 等.动态高压微射流预处理对甘薯叶多酚提取物抗氧化性的影响机制初探[J].食品与发酵工业, 2017, 43(6):169-174.
ZHANG L, LU Y, TU Z C, et al.Mechanism of dynamic high pressure microfluidization assisted-extraction on the effect of antioxidant activities of polyphenols from Ipomoea batatas leaves[J].Food and Fermentation Industries, 2017, 43(6):169-174.
[47] 潘鹤林, 陈晨, 商利容.黄姜皂素提取新工艺研究[J].高校化学工程学报, 2011, 25(2):296-301.
PAN H L, CHEN C, SHANG L R.Research on new extraction process for diosgenin[J].Journal of Chemical Engineering of Chinese Universities, 2011, 25(2):296-301.
[48] 王磊, 袁芳, 向俊, 等.响应面法优化高压均质提取椪柑渣中可溶性膳食纤维及抗氧化活性研究[J].中国食品学报, 2015, 15(5):82-89.
WANG L, YUAN F, XIANG J, et al.Optimization of high-pressure homogenization extraction of soluble dietary fiber from ponkan residue using response surface methodology and its antioxidant activities[J].Journal of Chinese Institute of Food Science and Technology, 2015, 15(5):82-89.
[49] XING J J, CHENG Y L, CHEN P, et al.Effect of high-pressure homogenization on the extraction of sulforaphane from broccoli (Brassica oleracea) seeds[J].Powder Technology, 2019, 358:103-109.