人类对蛋白的需求量将不断增加,如果仅一味地从动物获取蛋白,那么预计到2050年,由于动物养殖造成的土地侵蚀及用于种植动物饲料原料对耕地的占用,将会导致全球温室气体排放量增加80%,不利于资源环境可持续发展[1]。同时,过多摄入动物蛋白会导致肥胖症及Ⅱ型糖尿病的发生[2]。因此从健康、环保的角度出发,越来越多的学者推荐摄入植物性蛋白。大豆蛋白是优质植物蛋白的重要来源,因其富含人体所需8种必需氨基酸,且不含胆固醇,摄入后可降低患心血管疾病的风险,是动物蛋白的良好替代品[3]。另外,大豆蛋白具有良好的溶解性、乳化性、持水性、持油性、凝胶性、起泡性等理化特性,是理想的食品加工助剂。
大豆蛋白由多种组分组成,根据离心沉降系数不同分为2S(25 kDa)、7S(180 kDa)、11S(350 kDa)和15S(600 kDa)球蛋白[4]。7S和11S球蛋白是大豆蛋白的主要成分,约占大豆蛋白的70%~80%,其中7S球蛋白约占30%,11S球蛋白约占40%,但7S与11S的比例也因大豆品种而异,约为0.6~4.1[5],二者对大豆蛋白的功能性质起决定作用。7S球蛋白即β-伴大豆球蛋白,是由多糖和N-端天冬氨酸结合形成的一种糖蛋白,含糖量约5%,主要由α、α′和β 3个亚基通过氢键和疏水相互作用连接而成,呈平面三角形堆积(图1-a),相对分子质量140~180 kDa,等电点4.8[4]。11S球蛋白即大豆球蛋白,是由6个分子质量约为35 kDa的酸性亚基(A1a、A1b、A2、A3、A4、A5)和5个分子质量约为20 kDa的碱性亚基(B1a、B1b、B2、B3、B4)通过疏水键和二硫键堆积形成的六聚体非糖蛋白(图1-b),相对分子质量300~370 kDa,等电点6.4[6]。7S球蛋白结构包含核心区(含有2条糖链)和扩展区(含有1条糖链),其中α、α′亚基在核心区和扩展区均有存在,而β亚基仅存在于核心区,由于3个亚基均含有糖基,因此7S球蛋白具有较柔性的空间结构,且亲水能力强。而11S球蛋白含有较多的分子内和分子间二硫键,因此刚性结构显著,且亲水能力较弱[7]。
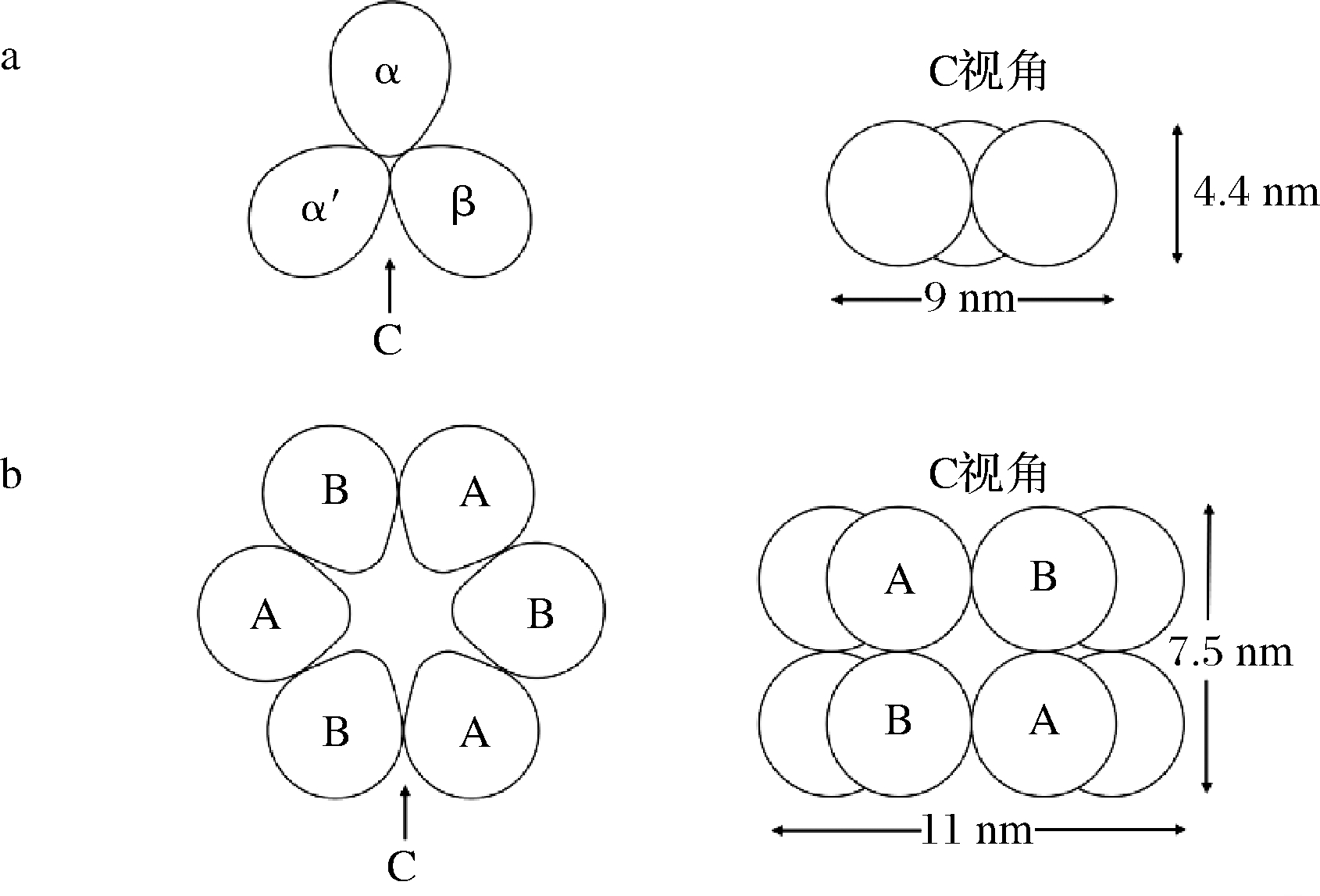
a-7S球蛋白;b-11S球蛋白
图1 大豆7S与11S球蛋白分子结构示意图[4]
Fig.1 Molecular structure diagram of β-glucoglobulin and globulin[4]
7S、11S球蛋白分子结构和氨基酸组成的不同导致二者性质的差异,本文从理化性质和改性修饰角度分别综述了7S、11S球蛋白的研究进展,并提出合理性建议,旨在为7S、11S球蛋白的有效利用和进一步深入研究提供理论参考。
1 7S、11S球蛋白的理化性质
大豆蛋白的主要理化性质包括溶解性、持水和持油性、乳化和乳化稳定性、起泡和起泡稳定性、凝胶性、成膜性等[8],这些性质对食品体系性状具有重要影响。7S与11S球蛋白在结构、氨基酸组成、疏水性残基暴露程度方面存在差异,导致两者理化性质不同。
1.1 溶解性
溶解性通常被作为衡量蛋白质应用价值的重要标记,体现了蛋白质与水分子的相互作用力与结合能力,蛋白质水合能力越强其溶解性越好[9]。pH 7时,11S球蛋白酸性亚基(A)带负电,呈亲水性,碱性亚基(B)带正电,呈疏水性;7S球蛋白的α和α′亚基同源性接近,常作为一个整体研究,二者均含有2条低聚糖链(分别位于核心区和延伸区),呈亲水性,β亚基仅存在核心区且仅有1条糖链,呈疏水性。7S与11S球蛋白亚基的性质决定了二者的两亲性[10]。但7S球蛋白作为糖蛋白,分子中含有N-糖链,因此亲水性整体高于11S球蛋白。吴海波等[9]利用7S球蛋白缺失型大豆品种制备生豆乳发现其溶解性显著低于普通大豆制备的生豆乳。PAVLICEVIC等[8]研究发现在pH 6和8时,7S球蛋白含量与大豆蛋白溶解度呈正相关,其中α和α′亚基含量与溶解度呈正相关,β′亚基(属于β亚基且与β亚基氨基酸含量接近)含量与溶解度呈负相关;而11S球蛋白含量与大豆蛋白溶解度呈负相关,这与中性或弱碱性环境下11S球蛋白的刚性结构有关。
大豆蛋白在食品加工过程中会遭受不同的处理方式,因此会受热、压力、离子、pH等条件影响,发生不同程度的聚集行为。受热后7S、11S球蛋白的溶解度发生不同程度的改变。7S球蛋白受热后形成可溶性聚集体,聚集体外侧被亲水性多糖链覆盖,聚集体间不会进一步聚集,因此受热后7S球蛋白仍具有良好的溶解性;11S球蛋白受热后形成具有不同密度的不溶性聚集体,聚集体外侧被疏水性残基所覆盖,聚集体间进行无限聚集,因此受热后11S球蛋白溶解度显著下降;但在11S球蛋白体系中加入7S球蛋白可以抑制11S球蛋白及其β亚基的热聚集,原理为11S球蛋白聚集体外侧的疏水性基团被7S球蛋白的亲水性多糖链替代,从而提高受热后11S球蛋白的溶解度(图2)[11]。大豆蛋白溶解度强烈依赖于体系中的离子强度和pH。刘红等[12]发现与中性条件(pH 7)相比,在极酸(pH 2)条件下7S、11S球蛋白溶解度变化均不显著,而在极碱(pH 11)条件下二者的溶解度均有提高,且11S球蛋白较7S球蛋白提高的程度更大,这与极碱条件下11S球蛋白展开程度更大有关。因此,较7S球蛋白,11S球蛋白对体系pH变化更敏感。离子环境也会对7S、11S球蛋白溶解度产生成不同程度影响,当向7S、11S球蛋白体系引入盐离子时,盐离子和蛋白质分子共同竞争水分子,使蛋白质与水分子的结合几率降低;此外,盐离子的静电屏蔽作用减弱了蛋白分子间的静电排斥力,分子间通过疏水相互作用发生缔合,导致溶解度下降[13]。陈卓[13]采用氮溶指数反映7S球蛋白的溶解度,发现在不同浓度Na+、K+、Ca2+条件下,7S球蛋白氮溶指数随Na+(0~50 mmol/L)、K+(0~15 mmol/L)浓度的升高变化不明显,但随Ca2+(0~100 mmol/L)浓度的升高逐渐减小,说明7S球蛋白溶解度受离子类型影响。齐宝坤等[14]研究发现11S球蛋白溶解度随体系中NaCl 浓度的增加而降低。
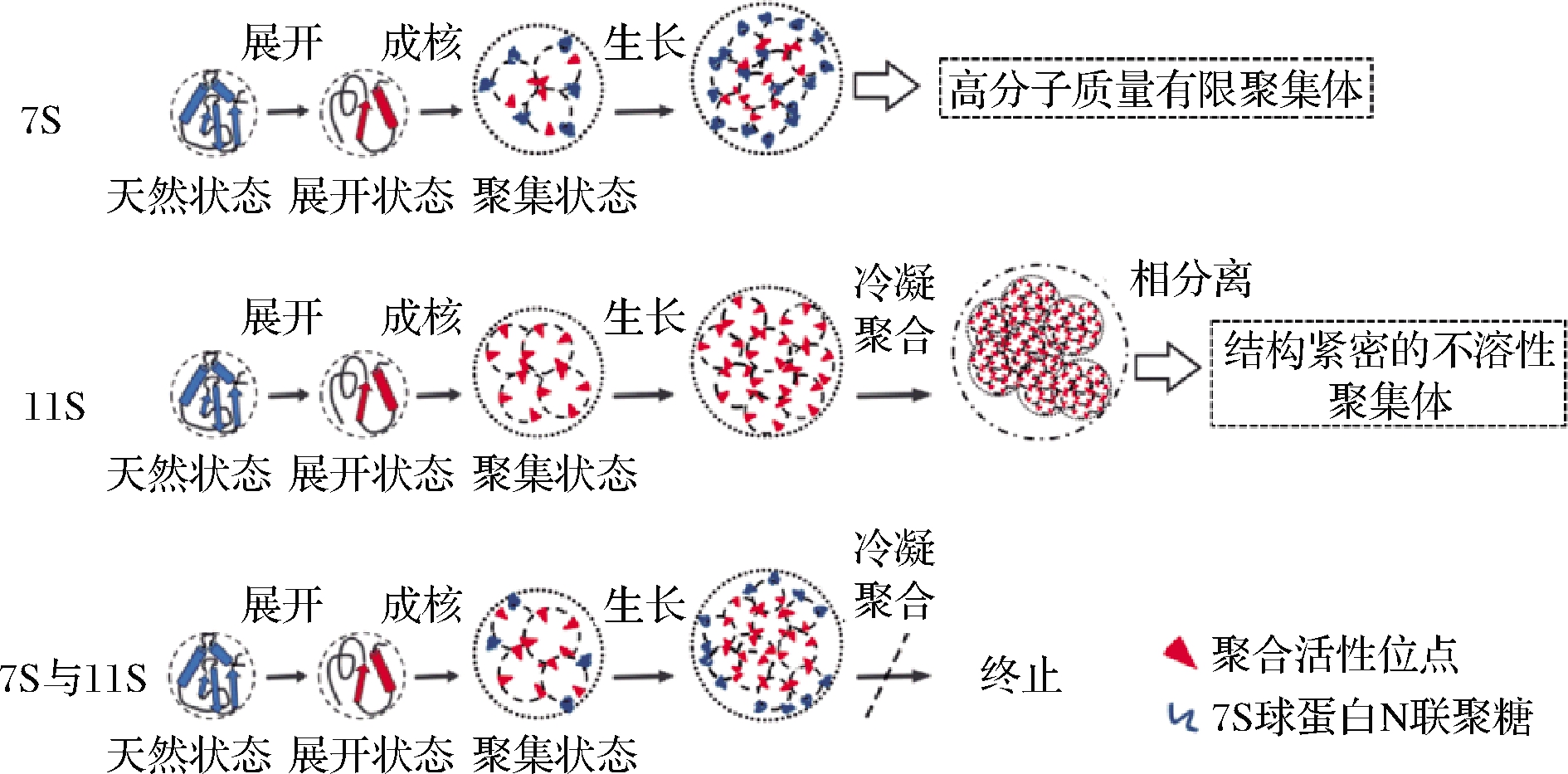
图2 7S、11S球蛋白在pH 7条件下的热聚集行为[11]
Fig.2 Thermal aggregation behaviors of 7S and 11S globulin at pH 7[11]
1.2 乳化性
大豆蛋白由于具有亲水、亲油的两亲性质,常作为乳化剂应用于食品中,如咖啡、奶油、冰激凌等。蛋白质乳化性能的优劣主要取决于:(1)蛋白质分子能否快速吸附于油水界面;(2)吸附于油水界面处的蛋白质分子能否发生快速重排并形成具有黏弹性的界面膜[6]。蛋白质分子空间构象的灵活性与蛋白质界面吸附性能密切相关,通常认为含有二硫键数目少的蛋白具有较为灵活的柔性结构,而含有较多分子内二硫键的蛋白则具有不灵活的刚性结构[7]。7S球蛋白所含二硫键少,亚基缔合结构松散,相比11S球蛋白,不仅分子质量小而且具有更加柔性的空间结构,较低浓度的7S球蛋白在油水体系中能够快速移动并吸附至油水界面处,同时发生去折叠,均匀地覆盖于油水界面(图3-a),因此7S球蛋白的乳化能力较强;而11S球蛋白含有较多的分子内和分子间二硫键,分子结构紧密,且分子质量较大,即使在低浓度下,其运动和吸附至油水界面的速度较慢。此外,不灵活的刚性结构使11S球蛋白在油水界面处的重排速度减慢,导致其在油水界面区域的有效覆盖率降低(图3-b),因此11S球蛋白的乳化能力较低[6]。当7S或11S球蛋白浓度较高时,过量的7S或11S球蛋白吸附于油水界面处,蛋白聚集导致渗透压增高,油体间发生损耗絮凝,二者的乳化能力均降低(图3)[6]。刘军等[15]发现7S∶11S比例高的大豆品种制备的大豆分离蛋白具有较高的乳化活性;陈硕等[16]发现蛋白体系中11S球蛋白含量的增加不仅会导致乳化活性指数的下降,而且油水界面处吸附的蛋白比例也会减少,乳液中的油体由清晰的球形轮廓转变为不规则的絮凝聚集体。上述研究显示7S球蛋白对大豆蛋白乳化性的贡献率大于11S球蛋白。
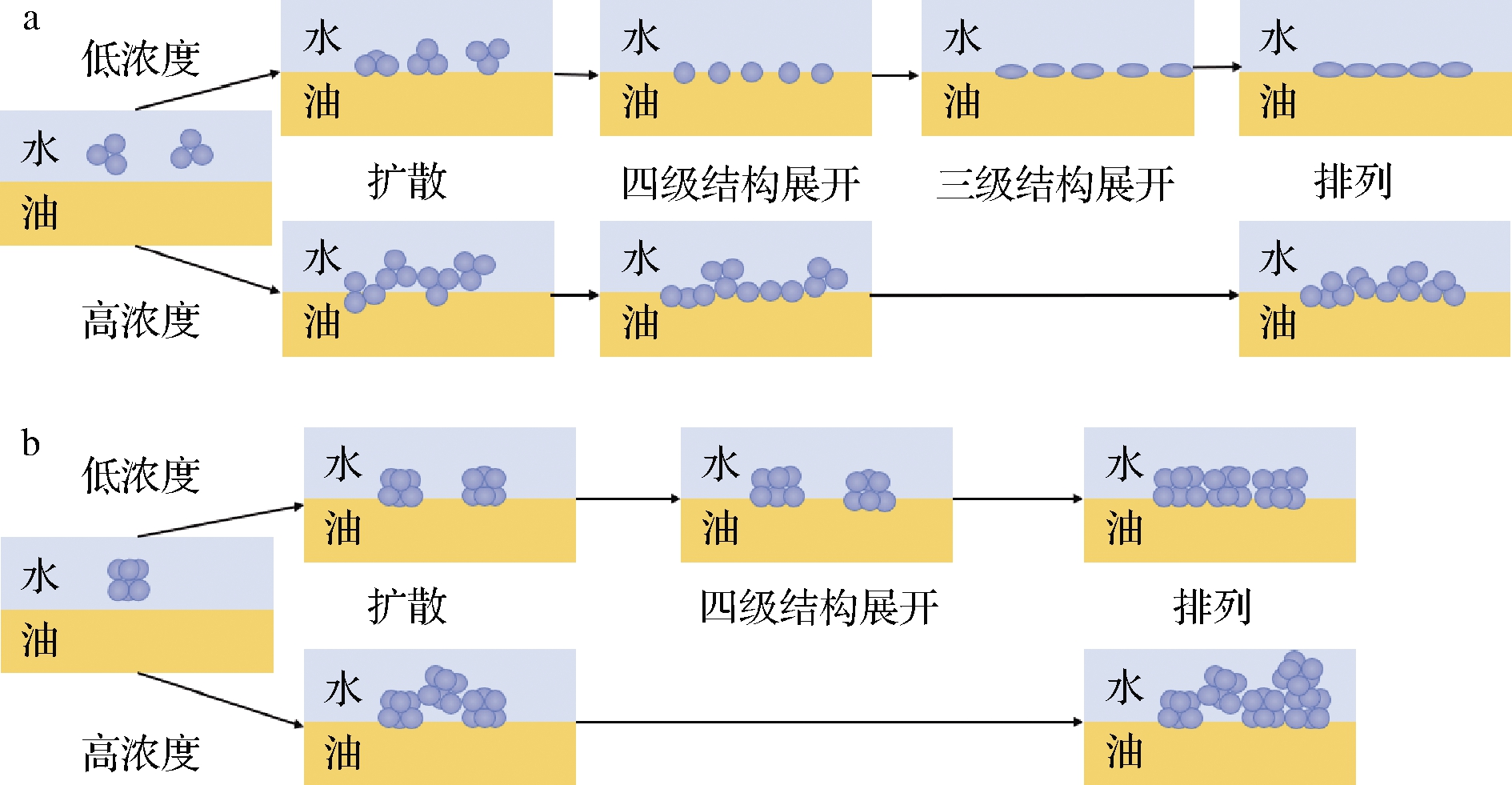
a-7S球蛋白;b-11S球蛋白
图3 7S与11S蛋白在不同浓度下油水界面的吸附行为[6]
Fig.3 Adsorption behaviors of 7S and 11S globulin at oil-water interface at different concentrations[6]
蛋白能否在油水界面形成具有一定黏弹性的界面膜也是决定其乳化能力的另一重要因素。油水界面膜黏弹性越强,油滴抗聚集效果越好,乳液的稳定性越高。TANG[6]构建了7S与11S球蛋白于油水界面处的吸附行为模型,7S球蛋白(或亚基)吸附于油水界面后结构发生重排,分子间发生强烈的侧向相互作用,在油水界面处形成致密的高黏弹性界面膜,从而表现出较高的乳化稳定性(图4-a);11S球蛋白易聚集形成大的聚集体,这些聚集体在油水界面形成厚而不均匀的界面膜,尽管该界面膜表面存有一些“空洞”,但由于天然11S球蛋白较7S球蛋白更易聚集,其形成的聚集体在油水界面形成网络结构,抑制了油滴间聚合,因此仍表现出较好的乳化稳定性(图4-b)。RIVAS等[17]发现pH 7时,由于7S球蛋白具有较强的分子内和分子间内聚力,在疏水相互作用下,7S球蛋白形成的油水界面膜较11S球蛋白形成的界面膜更加刚性有序且坚固,因此7S球蛋白稳定的乳液比11S球蛋白稳定的乳液具有更高的物理稳定性。
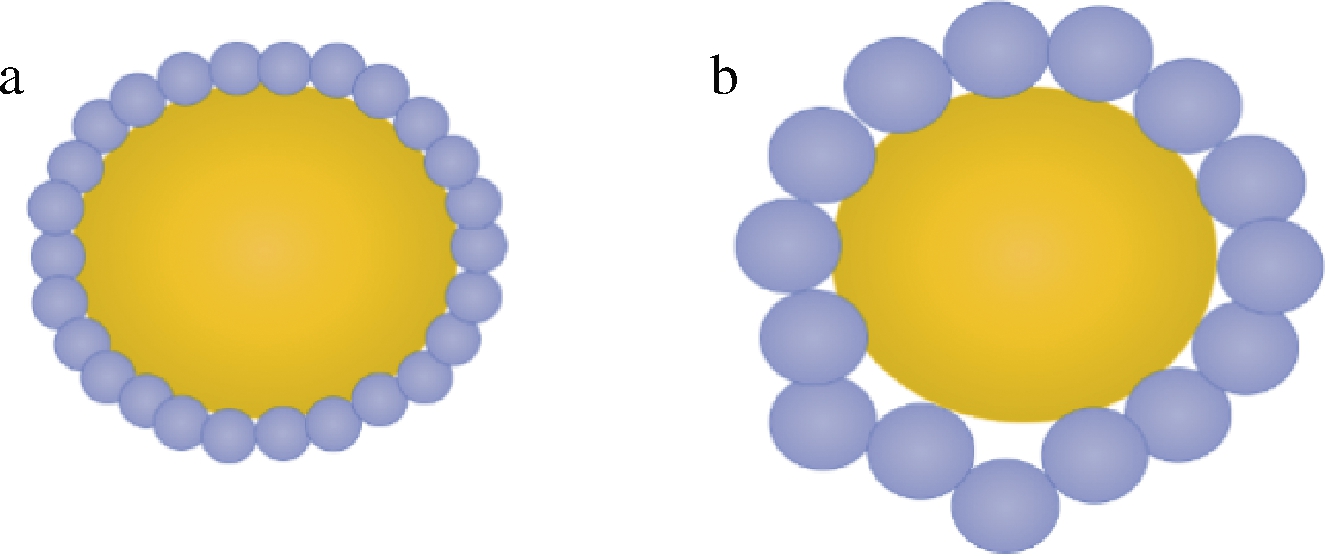
a-7S球蛋白;b-11S球蛋白
图4 吸附于油滴表面的7S与11S球蛋白 形成的界面结构[6]
Fig.4 Interface structure formed by 7S and 11S globulin adsorbed on the surface of oil droplet[6]
7S与11S球蛋白的乳化性与溶解性相似,也易受外界环境(如热、pH、盐离子)影响。研究表明,热处理后可提高11S球蛋白的乳化能力,但降低了7S球蛋白的乳化能力,与11S球蛋白相比,7S球蛋白的乳化能力更易受加热影响[18]。当所处体系pH值改变时,球蛋白结构以及表面所带电荷数量均发生变化,导致其乳化性能改变。刘红等[12]研究发现pH≥7时7S球蛋白的乳化稳定性优于11S球蛋白,当pH<7时,7S球蛋白的乳化稳定性显著低于11S球蛋白。XU等[19]也发现了类似的结论。因此,7S球蛋白乳化稳定性受pH影响更显著。离子浓度对球蛋白乳化稳定性也具有一定影响,TIAN等[20]发现随NaCl浓度的增加,降低了7S球蛋白界面层的黏弹性,对乳化活性具有负面影响。XU等[19]发现在NaCl浓度0~500 mmol/L时,11S球蛋白稳定的纳米乳液物理稳定性优于7S球蛋白,即11S球蛋白形成的乳液耐Na+离子稳定性更好。
1.3 凝胶性
在适宜外界条件影响下,大豆蛋白分子伸展,由环状结构转变成链状结构,原本包埋于分子内部的疏水基团充分暴露,分子间疏水相互作用增强,导致蛋白发生聚集,当蛋白质-蛋白质、蛋白质-水、蛋白相邻多肽链之间引力(疏水相互作用、范德华力、氢键、静电相互作用等)与斥力达到平衡时,蛋白三维凝胶网络结构形成[21]。根据蛋白浓度的不同大豆蛋白凝胶形成方式可分为非热致凝胶和热致凝胶。早在1914年,BRIDGMAN[22]就已发现在不需要热量的情况下,可通过600 MPa压力使液体蛋白形成非热致凝胶。各蛋白组分对压力的敏感性不同,如11S球蛋白经400 MPa处理后变性程度100%,7S球蛋白经600 MPa处理后仍保留30%的天然结构,因此11S与7S球蛋白形成非热致凝胶的最低浓度不同,分别为2.5%和7.5%[23]。
适度的热处理可使蛋白质二级结构改变,大量疏水性基团暴露,有利于凝胶网络的形成和稳定,因此目前更多采用热致凝胶。在大豆蛋白热致凝胶过程中,由于7S、11S球蛋白凝胶机制及凝胶形成参与作用力的不同导致二者凝胶性质的差异。11S球蛋白形成凝胶主要分为3步(图5),首先,在热作用下11S球蛋白分子结构部分去折叠展开,但仍保持球形,并短时间内(约15 s)迅速聚集形成由6个11S球蛋白分子组成的具有短链结构的可溶性聚集体(链Ⅰ)(分子质量:8 000 kDa);然后,链Ⅰ彼此间不断聚集形成更大的可溶性聚集体链Ⅱ;最后,链Ⅱ再与自身或链Ⅰ结合形成凝胶网络单元(链Ⅲ)[24]。
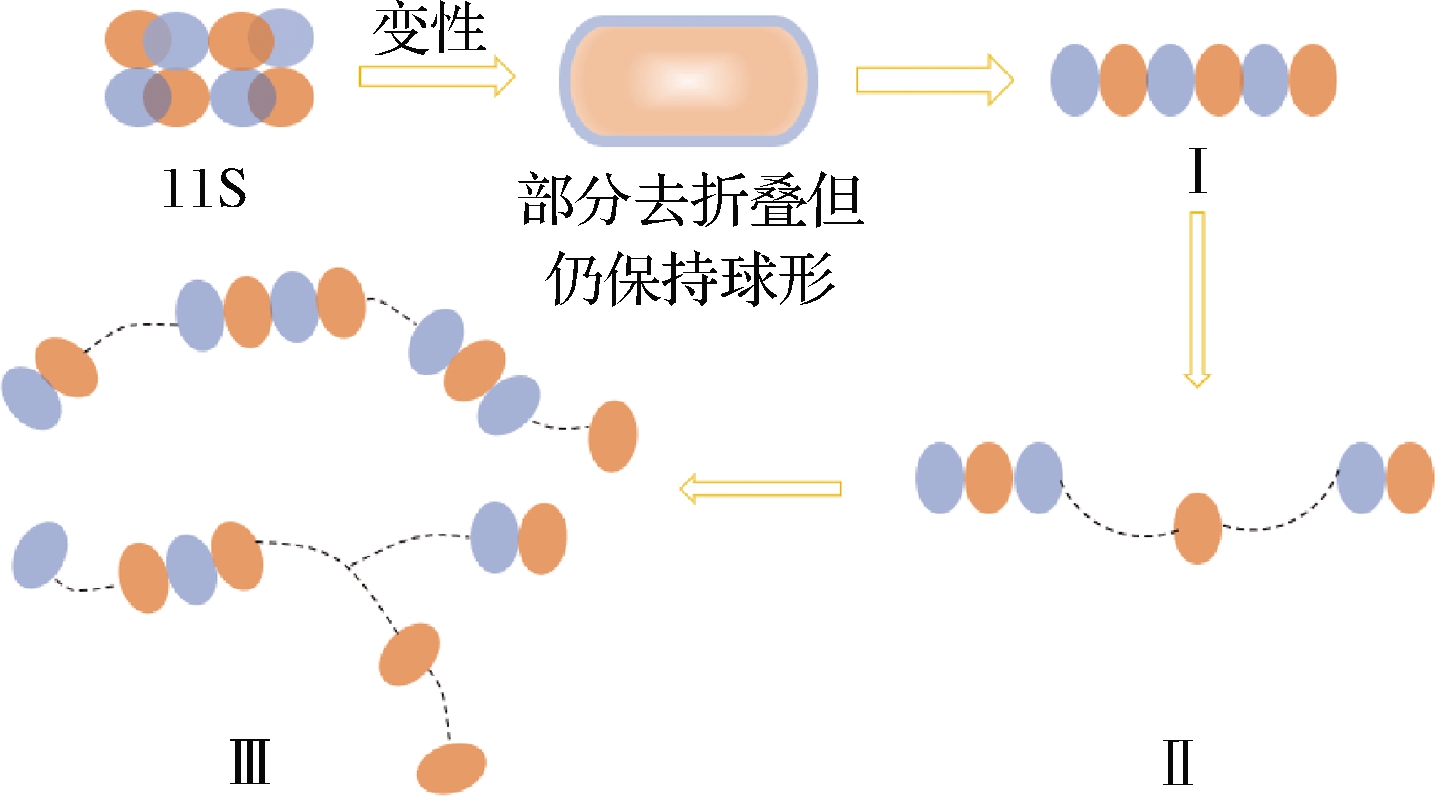
图5 11S球蛋白加热过程中凝胶化机理[24]
Fig.5 Gelation mechanism of 11S globulin during heating[24]
如前所述11S球蛋白分子含有较多二硫键,受热后主要通过疏水相互作用和二硫键形成三维网络结构,其中,二硫键对维持凝胶结构的稳定起关键作用,因此11S球蛋白热致凝胶强度大、硬度高。7S球蛋白加热初始阶段形成可溶性聚集体(分子质量:1 000 kDa),随后可溶性聚集体随机结合形成团簇,最终团簇间聚集形成凝胶[24]。在7S球蛋白形成凝胶过程中,未发生巯基(—SH)与二硫键(S—S)转换反应,主要靠氢键形成网络凝胶结构,因此7S球蛋白形成的凝胶柔软透明。ZHOU等[25]研究发现与无组分缺失的普通大豆为原料的酸豆乳相比,以缺失7S球蛋白的大豆为原料发酵的酸豆乳凝胶化时间缩短。ZHENG等[26]研究发现11S∶7S>1.88的大豆分离蛋白生产的千叶豆腐具有紧密均匀的三维网络结构,且千叶豆腐的弹性、硬度和咀嚼性更高,同时证实在维系千叶豆腐凝胶构象稳定中,非二硫共价键、疏水相互作用、二硫键比离子键和氢键更重要。
7S、11S球蛋白形成凝胶时会受环境体系因素的影响(温度、pH、盐离子等)。在蛋白热致凝胶形成过程中蛋白的变性程度及粒子聚集程度主要与7S、11S的变性温度有关,当加热温度低于蛋白变性温度时,蛋白结构未充分展开,体系中游离巯基数量少,蛋白分子间不易发生交联和聚集,因此不利于凝胶的形成;当加热温度过高时,蛋白变性严重,不易于形成致密的三维网络结构,因此凝胶的硬度、胶黏性均较低,甚至可能因为蛋白过度变性而无法形成凝胶[21]。冯芳等[27]发现当加热温度超过90 ℃时,7S球蛋白形成的凝胶结构松散、脆性高,硬度及胶黏性均较低,而11S球蛋白在加热温度95 ℃时所形成的凝胶硬度及胶黏性最高,这主要是由于7S球蛋白变性温度低(68~75 ℃),高温受热时变性严重,无法形成致密的三维网络结构,而11S球蛋白变性温度较高(85~93 ℃),且能在凝胶过程中形成更多的二硫键,因而高温加热下形成的凝胶具有更高的硬度和胶黏性。pH 主要是通过影响蛋白质子化程度和所带电荷数量影响蛋白凝胶化进程和凝胶性质。如7S球蛋白随pH 值的降低质子化程度增加,凝胶形成速度加快,易形成刚性凝胶[28]。pH 值过高或过低都会使7S与11S球蛋白的变性温度向低温方向移动。当pH 值由6增加到10时,7S球蛋白的变性温度变化不显著,但11S球蛋白变性温度降低10 ℃,因此当pH 值向碱性偏移时对11S球蛋白的热致凝胶性质影响更大[27]。适量盐离子的存在可适度减弱蛋白分子间的静电斥力,有利于蛋白分子发生交联从而促进凝胶的形成;过量的盐离子由于产生较强的静电屏蔽作用,使蛋白分子间的静电斥力极度减弱甚至消失,导致蛋白分子随机聚集,不利于凝胶结构的形成[21]。另外,过量盐离子的存在使7S、11S球蛋白变性温度升高,导致蛋白凝胶速度变慢,凝胶时间延长。冯芳等[27]研究发现在相同加热温度下,7S、11S球蛋白形成的凝胶硬度和胶黏性均随体系中Na+质量浓度的增加呈现先增大后降低的趋势,且凝胶形态由透明细腻变得发白粗糙,但较于7S球蛋白,11S球蛋白受Na+浓度影响更显著,Na+可诱导11S球蛋白二级结构中α-螺旋减少,β-折叠增加,而7S球蛋白二级结构对Na+浓度并不敏感[29]。
1.4 起泡性和泡沫稳定性
大豆蛋白的起泡性是指在食品生产加工中由于融入大量空气导致蛋白体积膨胀形成泡沫的能力,该性质常应用于饼干、蛋糕等烘焙食品加工中,以改善产品的质构和含水量[30]。大豆蛋白在空气-水界面的吸附行为类似于在油-水界面的吸附,包含扩散、吸附和重排3个过程,因此蛋白的表面活性以及能否形成具一定黏弹性的空气-水界面膜是决定其泡沫形成和泡沫稳定性的关键因素。泡沫的空气-水界面张力越小、界面储存模量(E′)越大,代表蛋白的起泡性越好。SIRISON等[31]研究了7S、11S球蛋白形成的泡沫空气-水界面张力随时间的动态变化,7S球蛋白形成的泡沫在1 500 s左右时界面张力开始下降,最终为(58.4±3.8) mN/m,11S球蛋白形成的泡沫界面张力也随时间的延长而下降,但3 600 s时仍为62.3 mN/m,另外,7S球蛋白泡沫在3 500 s后界面E′可达(42.5±5.2) mN/m,而11S最终E′为10 mN/m,即11S球蛋白起泡能力低于7S球蛋白。
pH对7S、11S球蛋白起泡性的影响与二者的等电点有关,研究显示在pH=2时,7S、11S球蛋白的起泡性均较好;在pH=5时,二者的起泡性和泡沫稳定性均最差;pH>5时,7S球蛋白起泡性略有增加,但当pH>7时,11S球蛋白起泡性降低[12]。离子强度也会影响二者起泡性及泡沫稳定性,研究表明在pH=7时,离子强度越低,7S、11S球蛋白的起泡性越高,但在此pH条件下7S球蛋白的泡沫稳定性不受离子强度影响,而11S球蛋白泡沫稳定性随离子强度的增加而增高[32]。
1.5 成膜性
大豆蛋白在适宜加工条件下可以形成具有网络结构的蛋白膜,这主要与蛋白分子内和分子间相互作用有关。大豆蛋白成膜可分为2个阶段:(1)加热阶段,蛋白分子受热结构改变,二硫键断裂,巯基与疏水性残基充分暴露于表面;(2)冷却干燥阶段,蛋白分子通过疏水相互作用、氢键、二硫键重新缔合,形成膜的网络结构[33]。在热诱导膜形成过程中,11S球蛋白的成膜性优于7S球蛋白,主要原因为:(1)11S球蛋白分子含有较多色氨酸和半胱氨酸,较于7S球蛋白,11S球蛋白能形成更多的巯基和二硫键,因此11S球蛋白形成的膜更加致密,拉伸强度更高;(2)7S球蛋白表面疏水性强,热稳定性差,与其他粒子结合能力较弱,因此形成的膜拉伸性及致密性较低[34]。研究发现11S球蛋白形成的膜在145°时拉伸强度为35 MPa,而7S球蛋白为26 MPa,即利用11S球蛋白能生产出更加坚固的膜[33]。蓝伟杰等[34]发现利用11S∶7S为4的大豆蛋白制备的腐竹具有最好的膜拉伸强度及致密性。WEI等[35]发现分别采用7S、11S球蛋白制备的蛋白膜均具有表面光滑,无条带状突起的特性,但11S球蛋白制备的膜水蒸气透过率和透油率均小于7S球蛋白制备的膜,这与11S球蛋白形成的膜交联程度更大、致密性更强有关。
2 7S、11S球蛋白改性修饰技术
我国食品工业在近几年取得了较大发展,不同类型食品对大豆蛋白功能性质的需求不一, 7S、11S球蛋白虽可根据自身结构特点,发挥各自功能优势,但由于共有的球蛋白结构和易受外界环境影响等特性,在许多食品加工中受限。为充分发挥7S、11S球蛋白优势,拓展其在食品领域中的应用,有必要对二者进行一定的改性修饰以提升相应性能。目前常用的改性方法主要有物理改性技术、非共价相互作用技术、糖基化改性技术、pH偏移技术、生物酶解技术和多种方法结合的复合改性技术。
2.1 物理改性技术
物理改性主要指通过加热、超声、高压均质等机械物理手段,破坏蛋白分子聚集状态,促进亚基解离,同时在机械作用力下蛋白结构充分展开,活性位点暴露(例如疏水基团),蛋白结构中α-螺旋含量减少,无规则卷曲含量增加,由排列有序的刚性结构转为更为松散的柔性结构,因此更有利于蛋白在油-水和空气-水界面的锚定,且形成致密有序的网状结构,从而蛋白的理化性质得以提升[36]。表1为常用的7S、11S球蛋白物理改性方法。适度的热处理提高了蛋白的表面疏水性/亲水性,使蛋白界面吸附能力提升。PERRECHIL等[18]研究发现90 ℃热处理30 min提高了富含11S组分蛋白的乳化能力,但降低了富含7S组分蛋白的乳化能力,这与7S、11S球蛋白变性温度有关。经90 ℃处理30 min后,11S球蛋白部分变性,解离后的亚基更利于在油-水界面吸附;而7S球蛋白完全变性,暴露出的疏水性基团在疏水相互作用力下重聚形成聚集体,不利于油-水界面的吸附。SIRISON等[31]将7S、11S球蛋白分别在90 ℃加热30 min,二者的起泡性与未加热相比显著增加,且热处理后11S球蛋白对大豆蛋白起泡性的贡献高于7S球蛋白,这是由于受热后2种蛋白形成的可溶性聚集体比未受热蛋白分子更利于作为“纳米颗粒”在空气-水界面的有效吸附和覆盖,同时加热后7S、11S球蛋白疏水性残基暴露,促进了蛋白在空气-水界面的吸附和重排,但7S球蛋白表面疏水性增加的幅度小于11S球蛋白。超声波、高压均质、射流空化等技术在提升7S、11S球蛋白理化性能方面也有较多的应用。田然等[37]研究发现经不同超声功率(150、450、1 350 W)及时间(15、30 min)处理后,7S、11S球蛋白结构从较为有序的状态变为无序状态,分子结构柔性及表面疏水性增加,因此二者的溶解性、乳化活性和乳化稳定性均提升。KANG等[38]研究发现大豆11S球蛋白经50、100 MPa高压均质2次后,蛋白表面疏水性和游离巯基的暴露程度增加,其溶解度、发泡性和凝胶性均显著提高。解长远等[39]发现经射流空化处理6 min后,11S球蛋白α-螺旋、β-折叠、β-转角含量减小,无规则卷曲含量增加,蛋白分子转变为更无序的状态,且游离巯基含量及表面疏水性增加,因此提升了11S球蛋白在油-水、空气-水的界面活性,最终11S球蛋白的溶解度、乳化性、起泡性均得以提高。但过度的机械处理也会产生负面影响,如:暴露出更多的疏水基团使得疏水相互作用增强、蛋白重聚,产生的不溶性聚集体破坏凝胶网络结构等,因此在蛋白物理改性中探寻最佳改性参数成为研究的关键。
表1 7S、11S球蛋白的物理改性方法
Table 1 Physical modification of 7S, 11S globulin

作用方式原理提升7S球蛋白理化特性提升11S球蛋白理化特性参考文献超声波利用超声波产生的空化效应,促使蛋白分子展开和部分变性,内部活性基团暴露,从而改善7S、11S球蛋白各项理化特性表面疏水性、溶解性、乳化活性、乳化稳定性、凝胶性表面疏水性、溶解性、乳化活性、乳化稳定性、凝胶性[37]高压均质利用湍流、高速剪切等作用力,诱导蛋白化学键的形成与破坏,影响蛋白分子间的相互作用,从而提升7S、11S球蛋白各项理化特性溶解性、起泡性、起泡稳定性、乳化性、乳化稳定性溶解性、乳化性、起泡性、凝胶性[36,38]射流空化蛋白分子通过射流产生的空化效应、高速湍流剪切效应、分子对冲撞击效应等综合作用,使刚性的蛋白分子结构展开,柔性增强,从而提高各项理化特性—溶解性、乳化性、起泡性[39]热处理在一定热处理条件下使蛋白球体结构展开,暴露出巯基和疏水基团,从而增强蛋白分子间相互作用及界面吸附能力起泡性乳化性、起泡性、凝胶性[18,31]
注:-表示无法提升相应球蛋白理化特性(下同)
2.2 非共价相互作用技术
7S、11S球蛋白可通过与表面活性剂、天然活性物质、多糖分子等发生非共价相互作用提高理化性能(表2)。
表2 非共价相互作用技术
Table 2 Noncovalent interaction technique

作用物质原理提升7S球蛋白理化特性提升11S球蛋白理化特性参考文献表面活性剂表面活性剂与11S球蛋白通过疏水相互作用形成复合物,形成的复合物所带电荷可产生静电斥力从而改善11S球蛋白的热聚集行为—热溶解性、热稳定性[40]天然活性物质利用7S、11S球蛋白与天然小分子表面活性物质在界面的竞争性吸附以及二者在界面的相互作用(氢键,疏水作用、静电作用),从而提升7S、11S球蛋白的界面吸附能力及耐环境压力能力乳化性、乳化稳定性、起泡性、起泡稳定性、乳液酸耐受性、乳液耐热稳定性乳化性、乳化稳定性、起泡性、起泡稳定性、耐酸稳定性、耐热稳定性[41-44]多糖利用7S、11S球蛋白与多糖通过静电相互作用形成复合物,从而增加油体间静电和空间斥力,提高所稳定的乳液储存稳定性及耐环境压力能力乳化稳定性耐酸乳化稳定性[45-46]
GUO等[40]在11S球蛋白溶液(pH 8)中加入“人工分子伴侣”十二烷基硫酸钠(sodium dodecyl sulfate,SDS)提高了11S球蛋白受热时的溶解度,这是由于11S球蛋白、SDS混合物受热时,SDS疏水端与11S球蛋白分子结合形成复合物,亲水端为11S蛋白分子表面提供静电屏障,从而抑制了蛋白的热聚集,其机理如图6所示。
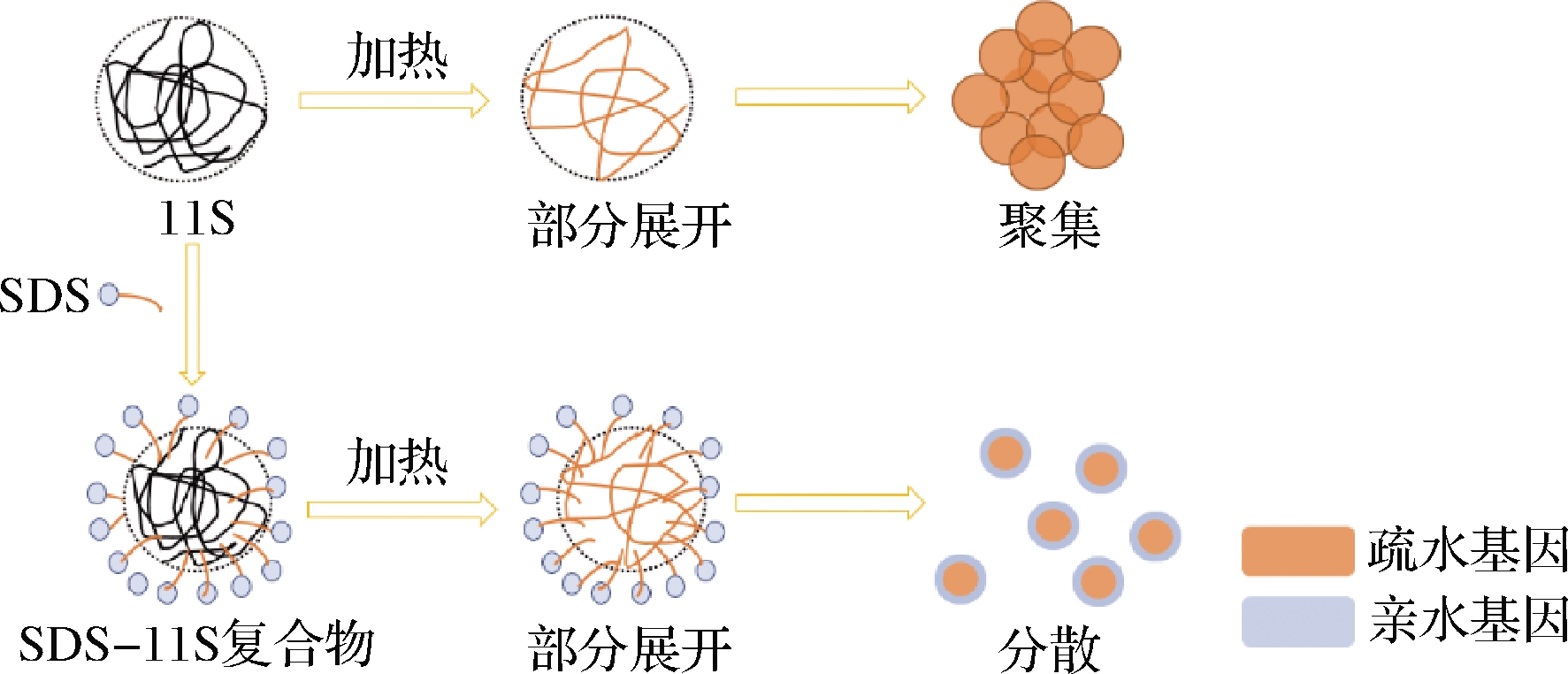
图6 SDS抑制11S球蛋白热聚集机理示意图[40]
Fig.6 Schematic diagram on the mechanism of SDS on thermal aggregation inhibition of 11S[40]
由于合成的表面活性剂(SDS)含有少量毒性同时存在固有的降解特性,目前常采用天然活性物质代替化学合成的表面活性剂,如大豆皂苷、甜菊糖苷等[41-44]。这些天然活性物质具有两亲性,可与7S、11S球蛋白在界面发生竞争性吸附,并与其通过氢键、疏水相互作用、静电相互作用结合形成复合物,协同提升7S、11S球蛋白的乳化性和起泡性。相较于7S、11S球蛋白,7S或11S与大豆皂苷(soyasaponin,Ssa)形成的7S/11S-Ssa复合物耐酸、耐热稳定性提高、起泡能力增强,且较于11S-Ssa,7S-Ssa复合物降低油水界面张力的能力更强、起泡性能更高[42]。向体系中添加不同浓度的天然活性物质会影响空气-水界面的吸附性能,添加适宜浓度的天然活性物质可有效提升11S球蛋白起泡性,WAN等[41]发现甜菊糖苷(stevia,STE)浓度为0.1% 时,11S球蛋白形成的11S-STE复合物在降低空气-水界面张力方面与单纯的11S球蛋白分子相似(图7-a);STE浓度升高至0.25%~0.5% 时,形成的11S-STE复合物由于11S、STE的协同作用降低了空气-水界面张力,且11S-STE复合物形成的界面层具有良好的弹性,表现出良好的起泡能力和泡沫稳定性(图7-b);当STE浓度达1%~2% 时,由于体系中存在过多的单体STE,STE分子优先吸附于空气-水界面,导致界面层的主要成分为STE,缺乏11S的界面层表面弹性低,泡沫稳定性下降,但仍优于单纯的11S球蛋白(图7-c)。

a-低浓度STE (0.1%);b-中间浓度STE(0.25%~0.5%); c-高浓度STE(1%~2%)
图7 11S-STE混合物在空气-水界面的 吸附行为示意图[41]
Fig.7 Schematic diagram of adsorption behavior of 11S-STE mixture at air-water interface[41]
利用特定pH条件下,球蛋白分子与多糖分子带有相反电荷,从而形成蛋白-多糖静电复合物以提升7S、11S球蛋白的乳化稳定性及抗极端环境能力也是目前常采用的方法之一。YUAN等[45]在体系pH 4.5时制备了11S球蛋白(带少量负电)与壳聚糖(带正电)的静电复合物(11S球蛋白∶壳聚糖为0.1~0.2),由11S-壳聚糖静电复合物稳定的乳液在pH 4.5时的稳定性得到显著提升。XIANG等[46]将pH值均为3的7S球蛋白乳液(带正电)与高甲氧基果胶(high methoxyl pectin,HMP)溶液(带负电)混合,由于静电沉积原理HMP分子吸附于油水界面处的7S分子表面,形成的7S-HMP乳液经3 000 psi均质后,粒径显著小于仅由7S稳定的乳液,且具有良好的贮存稳定性。
2.3 共价改性技术
蛋白质的共价改性主要采用糖基化改性技术。糖基化是蛋白质、多肽、氨基酸侧链上的游离氨基与糖类分子中的还原端羰基共价结合生成糖蛋白的非酶反应[47]。亲水性多糖与蛋白糖基化后形成的偶联物氢键数量增加,亲水基团数量提高,因而溶解性提升,同时蛋白与多糖结合后提高了偶联物的带电数量,蛋白的等电点向更低的pH方向移动,拓宽了蛋白可溶性pH范围;经糖基化改性后蛋白柔性增强,二者结合形成的两亲性偶联物可更快的迁移并通过蛋白质的疏水区牢固的锚定在油-水界面上,形成黏弹性界面膜,而多糖可提供空间屏障防止乳液絮凝和聚结[48]。
糖基化一般分为湿法糖基化和干法糖基化,湿法糖基化适用于小分子糖类反应,操作简单、糖基化速度较快、反应时间相对较短,但也存在反应过程易导致褐变严重、蛋白质快速聚集、反应程度不可控等缺陷;干法糖基化适用于大部分蛋白与多糖反应,且反应后产物性质测定方便,是目前应用最广泛的糖基化方法,但也存在反应周期长、效率低等缺点[49]。通过对7S、11S球蛋白分子的糖基化修饰可提升二者的乳化性、凝胶性等功能特性。表3列举了7S、11S球蛋白经糖基化改性对功能性质提升的相关研究。ZHANG等[51]利用7S球蛋白与葡聚糖进行干热糖基化反应,得到的偶联物可通过提高油滴间的静电斥力,提升乳液稳定性。田燕[52]利用D-半乳糖通过湿法糖基化改性7S球蛋白,改性后的其三级结构遭到破坏,肽链展开,蛋白分子构象更趋于柔性,内部疏水性基团暴露,表现出油-水界面的吸附优越性,从而乳化活性提高,同时由于多糖的引入提高的蛋白表面电荷和空间位阻,乳液稳定性有所提高。李冰等[53]用麦芽糖对大豆11S球蛋白进行湿法糖基化改性,改性后11S球蛋白形成的凝胶硬度提高了20.7%,弹性模量、黏性模量均提高,凝胶形成时间明显缩短。PENG等[55]将11S球蛋白与大豆可溶性多糖通过干法糖基化改性技术共价结合,糖基化后的11S球蛋白构象柔性增强(解离成[AB]亚基),促进了蛋白在油-水界面的吸附,从而提高了11S球蛋白的乳化活性和乳化稳定性。
表3 7S、11S球蛋白糖基化改性相关研究
Table 3 Studies on glycosylation modification of 7S and 11S globulins

蛋白种类多糖种类糖基化方法性能提高参考文献7S球蛋白黄原胶湿热法乳化活性[50]葡聚糖干热法乳液稳定性[51]D-半乳糖湿热法乳化活性[52]11S球蛋白麦芽糖湿热法凝胶性[53]果糖湿热法乳化活性[54]大豆可溶性多糖干热法乳化活性[55]
2.4 pH偏移技术
球蛋白经极碱性(pH 10~12)或极酸性(pH 2~3)环境处理后,由于蛋白分子氨基质子化(NH2到![]() 或羧基去质子化(COOH到COO-),因此自身带有较多的正电荷或负电荷,强烈的静电斥力增强了多肽段的解离。当体系pH值调至中性(pH 7)后蛋白分子内部电荷斥力减弱,从而发生一定程度折叠,形成高度可溶的蛋白质单体或聚集体,此聚集体被称为“熔融球状体”。熔融球状体具有良好的乳化和发泡能力,且通过碱性pH偏移(pH 12)处理后的蛋白单体可形成由二硫键连接的可溶性纳米聚集体,有利于蛋白油水界面的吸附,从而提升乳化性(图8)[56]。pH偏移技术破坏了蛋白四级结构,平衡蛋白亲水/亲油性,显著提高了蛋白溶解性。杨昱等[57]研究发现经极端碱性(pH 10~13)处理后,7S、11S球蛋白溶解度均增加,但7S溶解度较11S球蛋白增加程度小;酸性条件(pH 1~4)处理后,7S球蛋白溶解度均不同程度减小,而11S球蛋白只有经pH 1处理后溶解度稍有增大,因此,对于提高蛋白溶解度而言,碱性pH偏移比酸性pH偏移更有效,且较于7S球蛋白,pH偏移技术对提升11S球蛋白溶解度更有效。利用pH偏移技术改性后的球蛋白制备的乳液还具有较好的抗热稳定性,TIAN等[58]研究发现利用经pH 12处理后,7S球蛋白制备的乳状液抗热稳定性较好。
或羧基去质子化(COOH到COO-),因此自身带有较多的正电荷或负电荷,强烈的静电斥力增强了多肽段的解离。当体系pH值调至中性(pH 7)后蛋白分子内部电荷斥力减弱,从而发生一定程度折叠,形成高度可溶的蛋白质单体或聚集体,此聚集体被称为“熔融球状体”。熔融球状体具有良好的乳化和发泡能力,且通过碱性pH偏移(pH 12)处理后的蛋白单体可形成由二硫键连接的可溶性纳米聚集体,有利于蛋白油水界面的吸附,从而提升乳化性(图8)[56]。pH偏移技术破坏了蛋白四级结构,平衡蛋白亲水/亲油性,显著提高了蛋白溶解性。杨昱等[57]研究发现经极端碱性(pH 10~13)处理后,7S、11S球蛋白溶解度均增加,但7S溶解度较11S球蛋白增加程度小;酸性条件(pH 1~4)处理后,7S球蛋白溶解度均不同程度减小,而11S球蛋白只有经pH 1处理后溶解度稍有增大,因此,对于提高蛋白溶解度而言,碱性pH偏移比酸性pH偏移更有效,且较于7S球蛋白,pH偏移技术对提升11S球蛋白溶解度更有效。利用pH偏移技术改性后的球蛋白制备的乳液还具有较好的抗热稳定性,TIAN等[58]研究发现利用经pH 12处理后,7S球蛋白制备的乳状液抗热稳定性较好。
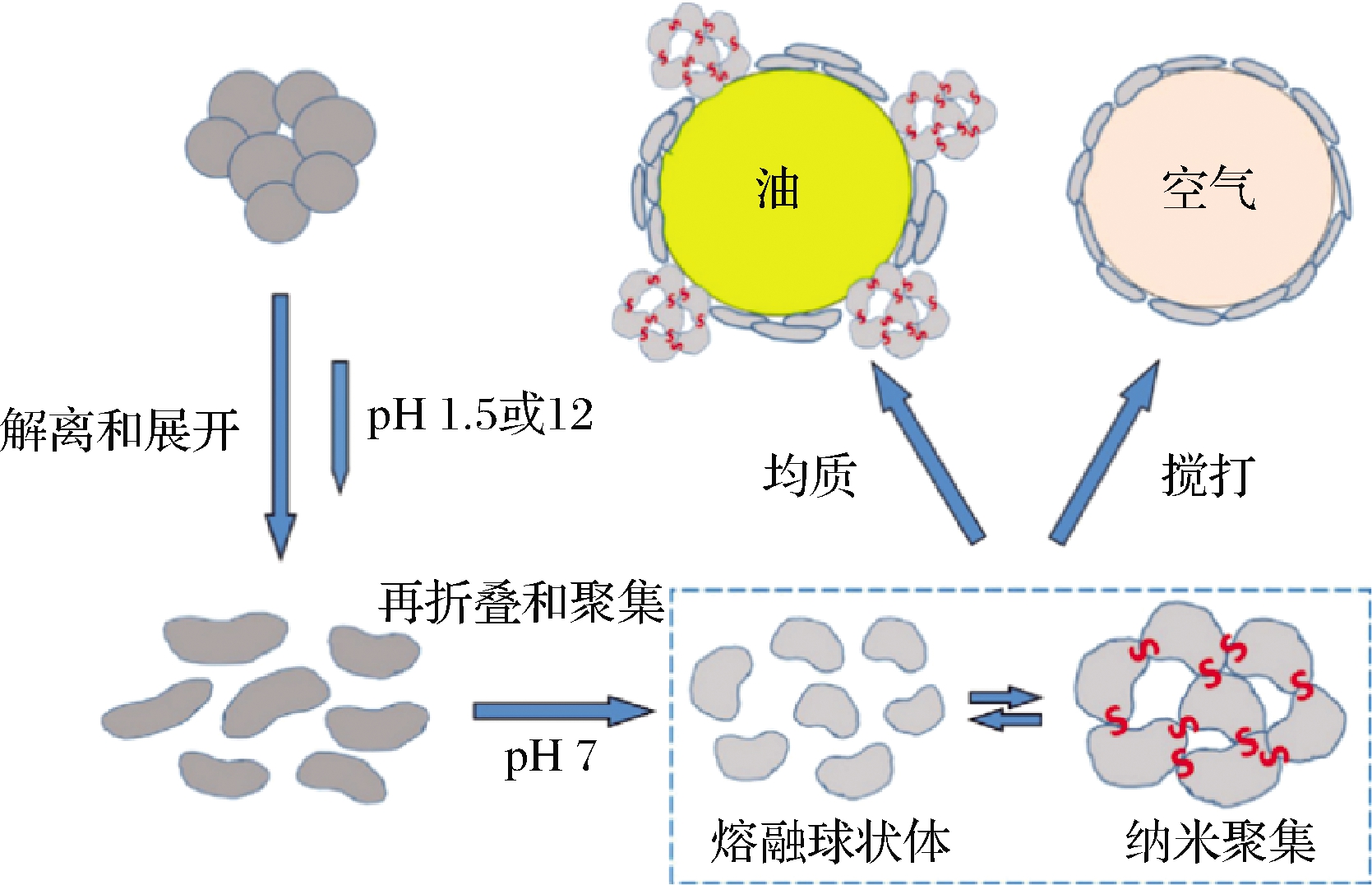
图8 pH偏移过程及其对蛋白质表面性能的影响[56]
Fig.8 pH migration process and its effect on protein surface properties[56]
2.5 酶法改性技术
酶法改性是指蛋白在酶的催化下降解成小分子或交联生成新结构的过程[59]。与物理改性、共价改性等技术相比,酶法改性技术因其高效、专一性强,作用条件温和(pH 6~8、温度40~60 ℃),可最大程度保持改性产物的营养,且水解物易于人体消化吸收,因此具有更大的市场潜力和应用价值。酶法改性中蛋白酶的种类会直接影响改性后蛋白的理化性质,常见的蛋白酶包括:动物蛋白酶、植物蛋白酶及微生物蛋白酶。杨春华等[60]研究发现与天然11S球蛋白相比,经碱性蛋白酶和胃蛋白酶复合酶解后的大豆11S球蛋白热稳定性显著提高,酶解使11S球蛋白分子内部氢键断裂,其中的亲水基团更易与水分子紧密连接,从而限制了11S球蛋白结构的展开,因而其热稳定性提高。段春红等[61]采用菠萝蛋白酶限制性酶解7S球蛋白,然后将其添加入猪肉肠中,发现在7S球蛋白水解度为6%时,得到猪肉肠的质构特性(硬度、弹性、咀嚼性、回复性和内聚性)最优,且显著高于未酶解7S球蛋白添加的猪肉肠,限制性酶解改变了7S球蛋白的表面疏水性和相对分子质量,使蛋白交联程度更大,从而提升了凝胶强度,同时可有效保留肉制品中的脂肪和水分。另外,蛋白酶解改性效果会受多种因素影响,如酶解温度、底物浓度、酶解时间等,因此有效调控酶解反应条件对提升7S、11S球蛋白性能也至关重要。范丽丽等[59]采用转谷氨酰胺酶(transglutaminase,MTGase)对7S球蛋白进行酶解改性,研究发现最佳改性条件为55 ℃,pH 7,酶添加量为20 U/g,55 ℃反应温度利于7S球蛋白结构伸展,暴露出更多活性位点,同时此温度下MTGase酶活性较高,增强了MTGase酶催化7S球蛋白交联作用,蛋白表面疏水性进一步增强,因此提升了改性后7S球蛋白乳化活性。
2.6 复合改性技术
单一改性技术往往存在耗时耗能、效率低、改性效果不显著等特点,采用多种技术手段(物理、化学、生物等)复合改性蛋白,综合各单一改性技术优点,可显著提升蛋白理化特性,且具有高效、低成本的优势[62]。如采用酶法与糖基化技术结合,通过酶解后蛋白表面活性增强,更利于与糖类的共价交联,从而提升蛋白糖基化改性效果;采用超声辅助酶法改性技术,通过适度的超声处理使蛋白暴露更多酶切位点,从而进一步提升酶解改性效果;采用超声波联合加热技术,利用超声波处理提高蛋白质分子对加热温度的敏感性,从而提升热处理改性效果等。LIU等[62]通过超声联合加热改性大豆11S球蛋白,复合改性后的11S球蛋白柔性增加,其乳化活性和乳化稳定性较单独超声改性的11S球蛋白显著提高。范丽丽[63]利用Na2SO3协同MTGase改性大豆7S球蛋白,7S球蛋白经Na2SO3处理后,稳定蛋白结构的分子间作用力遭到破坏,内部的赖氨酸残基和谷氨酸残基暴露,增加了MTGase的反应位点,促进了蛋白分子内和分子间ε-赖氨酸和γ-谷氨酰基共价键的形成,蛋白交联成更加致密的凝胶网络结构,从而增强了蛋白凝胶强度和凝胶持水性。目前,针对复合改性大豆蛋白的研究较多,但7S、11S球蛋白复合改性研究的报道较少,因此未来在采用复合改性技术提升二者理化性质方面具有更多的研究空间。
3 总结与展望
综上,7S、11S球蛋白根据自身结构特点表现出不同优势的功能特性,同时二者可通过多种改性技术进一步提升理化性质及抗环境压力能力。大豆蛋白作为植物蛋白的主要来源,不仅是人体获得优质蛋白的重要来源,也是重要的食品加工助剂。7S、11S球蛋白作为大豆蛋白的主要组分,如能充分明晰二者理化性质,探索更加实用有效的改性方法,将对未来生产实际具有重要指导意义,将来可从以下几个方面对7S、11S球蛋白展开进一步研究:(1)目前7S、11S球蛋白理化性质的研究主要集中于溶解性、乳化性和凝胶性,而关于起泡性、成膜性的研究较少,未来可加大这方面的研究,以拓宽7S、11S球蛋白的应用领域;(2)目前针对大豆蛋白的改性技术手段较多,但应用于7S、11S球蛋白改性方面仍较少。如复合改性技术在大豆蛋白改性方面应用较多,但仍较少应用于7S、11S球蛋白的改性,因此针对7S、11S的改性仍有待进一步深入,以充分发挥7S、11S球蛋白的性能优势;(3)加快新型技术在7S、11S球蛋白改性方面的应用,冷等离子技术、电化学技术、脉冲电场技术等非热加工技术均可在较大程度减少对食品感官和营养价值有害影响前提下,实现对蛋白理化性质的改善,且具有高效节能、环境友好等优点,将来可作为7S、11S球蛋白改性的研究重点;(4)目前7S、11S球蛋白的制备主要利用二者等电点的不同,采用逐级酸沉方式从大豆蛋白中分离出来,由于二者等电点较接近(7S为 pH 4.8,11S为 pH 6.4),因此提取中彼此易污染,且提取纯化工艺繁琐,生产成本高,加重了7S、11S球蛋白广泛应用的困难。如能进一步加强特定基因型品种选育,培育出特定7S、11S含量的基因型大豆原料,对推动二者在食品加工中的应用具有重要意义。
[1] ESTELL M, HUGHES J, GRAFENAUER S.Plant protein and plant-based meat alternatives:Consumer and nutrition professional attitudes and perceptions[J].Sustainability, 2021, 13(3):1478.
[2] CHEN Z L, FRANCO O H, LAMBALLAIS S, et al.Associations of specific dietary protein with longitudinal insulin resistance, prediabetes and type 2 diabetes:The Rotterdam Study[J].Clinical Nutrition, 2020, 39(1):242-249.
[3] 任红玉, 李昊阳, 陈海燕, 等.稀土镧和铈对大豆蛋白质含量和氨基酸组成的影响及营养评价[J].食品科学, 2019, 40(6):9-15.
REN H Y, LI H Y, CHEN H Y, et al.Effects of foliar application of lanthanum and cerium on protein content and amino acid composition of soybeans and nutritional evaluation[J].Food Science, 2019, 40(6):9-15.
[4] SUI X N, ZHANG T Y, JIANG L Z.Soy protein:Molecular structure revisited and recent advances in processing technologies[J].Annual Review of Food Science and Technology, 2021, 12:119-147.
[5] JOHN H, CHANDRA P, GIRI S K, et al.Effect of processing methods on 11S/7S protein and nitrogen solubility index of soy protein isolate[J].Journal of the Institution of Engineers (India):Series A, 2021, 102(4):989-994.
[6] TANG C H.Emulsifying properties of soy proteins:A critical review with emphasis on the role of conformational flexibility[J].Critical Reviews in Food Science and Nutrition, 2017, 57(12):2 636-2 679.
[7] ZHU Y, FU S Y, WU C L, et al.The investigation of protein flexibility of various soybean cultivars in relation to physicochemical and conformational properties[J].Food Hydrocolloids, 2020, 103:105709.
[8] PAVLICEVIC M Z, TOMIC M D, DJONLAGIC J A, et al.Evaluation of variation in protein composition on solubility, emulsifying and gelling properties of soybean genotypes synthesizing β′ subunit[J].Journal of the American Oil Chemists’ Society, 2018, 95(2):123-134.
[9] 吴海波, 张麒, 邱硕, 等.均质/加热条件下组分缺失型原料豆乳理化特性研究[J].农业机械学报, 2021, 52(8):374-385.
WU H B, ZHANG Q, QIU S, et al.Physicochemical properties of soymilk prepared from component deficient soybean under homogenization or heating conditions[J].Transactions of the Chinese Society for Agricultural Machinery, 2021, 52(8):374-385.
[10] CHEN Y M, ONO T.Protein particle and soluble protein structure in prepared soymilk[J].Food Hydrocolloids, 2014, 39:120-126.
[11] GUO J, YANG X Q, HE X T, et al.Limited aggregation behavior of β-conglycinin and its terminating effect on glycinin aggregation during heating at pH 7.0[J].Journal of Agricultural and Food Chemistry, 2012, 60(14):3 782-3 791.
[12] 刘红, 康玉凡.pH对大豆7S、11S球蛋白功能特性影响[J].粮食与油脂, 2013, 26(8):17-20.
LIU H, KANG Y F.Effect of pH on functional properties of 7S, 11S globulin in soybean[J].Cereals & Oils, 2013, 26(8):17-20.
[13] 陈卓. 超滤—渗滤技术制备饮料专用大豆蛋白的研究[D].广州:华南理工大学, 2014.
CHEN Z.The preparation of soy protein for drinks by diafiltration-ultrafiltration technology[D].Guangzhou:South China University of Technology, 2014.
[14] 齐宝坤, 江连洲, 王欢, 等.离子强度对大豆11S球蛋白表面疏水性及结构的影响[J].食品科学, 2018, 39(8):39-44.
QI B K, JIANG L Z, WANG H, et al.Effect of ionic strength on surface hydrophobicity and structure of 11S glycinin[J].Food Science, 2018, 39(8):39-44.
[15] 刘军, 马春芳, 闫龙, 等.大豆原料对分离蛋白加工及功能特性的影响[J].大豆科技, 2019(6):4-10.
LIU J, MA C F, YAN L, et al.Effects of soybean raw materials on processing and functional characteristics in soybean protein isolate[J].Soybean Science & Technology, 2019(6):4-10.
[16] 陈硕, 唐传核.不同比例球蛋白组成对大豆蛋白溶液乳化性与界面特性的影响[J].现代食品科技, 2016, 32(9):62-68.
CHEN S, TANG C H.Effect of varying β-conglycinin/glycinin ratios on the emulsifying and interfacial properties of soybean proteins[J].Modern Food Science and Technology, 2016, 32(9):62-68.
[17] RIVAS H J, SHERMAN P.Soy and meat proteins as emulsion stabilizers.4.The stability and interfacial rheology of O/W emulsions stabilised by soy and meat protein fractions[J].Colloids and Surfaces, 1984, 11(1-2):155-171.
[18] PERRECHIL F A, RAMOS V A, CUNHA R L.Synergistic functionality of soybean 7S and 11S fractions in oil-in-water emulsions:Effect of protein heat treatment[J].International Journal of Food Properties, 2015, 18(11):2 593-2 602.
[19] XU J, MUKHERJEE D, CHANG S K C.Physicochemical properties and storage stability of soybean protein nanoemulsions prepared by ultra-high pressure homogenization[J].Food Chemistry, 2018, 240:1 005-1 013.
[20] TIAN Y, TAHA A, ZHANG P P, et al.Effects of protein concentration, pH, and NaCl concentration on the physicochemical, interfacial, and emulsifying properties of β-conglycinin[J].Food Hydrocolloids, 2021, 118:106784.
[21] 蔡燕萍, 游寅寅, 刘建华, 等.大豆蛋白凝胶性及其改良方法的研究进展[J].食品与发酵工业, 2021, 47(15):298-306.
CAI Y P, YOU Y Y, LIU J H, et al.Research progress on gelation of soybean protein and its improvement methods[J].Food and Fermentation Industries, 2021, 47(15):298-306.
[22] BRIDGMAN P W.The coagulation of albumen by pressure[J].Journal of Biological Chemistry, 1914, 19(4):511-512.
[23] NAKAMURA T, UTSUMI S, MORI T.Interactions during heat-induced gelation in a mixed system of soybean 7S and 11S globulins[J].Agricultural and Biological Chemistry, 1986, 50(10):2 429-2 435.
[24] TANG C H.Nanostructures of soy proteins for encapsulation of food bioactive ingredients[M]//Biopolymer Nanostructures for Food Encapsulation Purposes.Amsterdam:Elsevier, 2019:247-285.
[25] ZHOU Y P, LI X F, HUA Y F, et al.The absence of lipoxygenase and 7S globulin of soybeans and heating temperatures on the properties of soymilks and soy yogurts[J].LWT, 2019, 115:108431.
[26] ZHENG L, WANG Z J, KONG Y, et al.Different commercial soy protein isolates and the characteristics of Chiba tofu[J].Food Hydrocolloids, 2021, 110:106115.
[27] 冯芳, 刘文豪, 陈志刚.大豆7S、11S蛋白的结构与热致凝胶特性的分析[J].食品科学, 2020, 41(2):58-64.
FENG F, LIU W H, CHEN Z G.Structure and heat-induced gelation properties of soybean 7S and 11S proteins[J].Food Science, 2020, 41(2):58-64.
[28] NISHINARI K, FANG Y, GUO S, et al.Soy proteins:A review on composition, aggregation and emulsification[J].Food Hydrocolloids, 2014, 39:301-318.
[29] YANG Y X, WANG Q M, TANG Y W, et al.Effects of ionic strength and (-)-epigallocatechin gallate on physicochemical characteristics of soybean 11S and 7S proteins[J].Food Hydrocolloids, 2021, 119:106836.
[30] WOUTERS A G B, FIERENS E, ROMBOUTS I, et al.Exploring the relationship between structural and air-water interfacial properties of wheat (Triticum aestivum L.) gluten hydrolysates in a food system relevant pH range[J].Journal of Agricultural and Food Chemistry, 2017, 65(6):1 263-1 271.
[31] SIRISON J, ISHII T, MATSUMIYA K, et al.Comparison of surface and foaming properties of soy lipophilic protein with those of glycinin and β-conglycinin[J].Food Hydrocolloids, 2021, 112:106345.
[32] RU Z-HENESTROSA V P, S
Z-HENESTROSA V P, S NCHEZ C C, ESCOBAR M D M Y, et al.Interfacial and foaming characteristics of soy globulins as a function of pH and ionic strength[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2007, 309(1-3):202-215.
NCHEZ C C, ESCOBAR M D M Y, et al.Interfacial and foaming characteristics of soy globulins as a function of pH and ionic strength[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2007, 309(1-3):202-215.
[33] RANI S, KUMAR R.A review on material and antimicrobial properties of soy protein isolate film[J].Journal of Polymers and the Environment, 2019, 27(8):1 613-1 628.
[34] 蓝伟杰, 林莹, 康庆, 等.原料组分与工艺条件对腐竹品质的影响[J].食品科学, 2020, 41(16):252-258.
LAN W J, LIN Y, KANG Q, et al.Effects of raw material composition and processing conditions on quality of Yuba[J].Food Science, 2020, 41(16):252-258.
[35] WEI Y X, HUANG Z E, YU Z L, et al.Preparation and properties of fractionated soybean protein isolate films[J].Materials (Basel, Switzerland), 2021, 14(18):5436.
[36] LI Y P, SUKMANOV V О, MA H J.The effect of high pressure on soy protein functional features:A review[J].Journal of Chemistry and Technologies, 2021, 29(1):77-91.
[37] 田然, 冯俊然, 隋晓楠, 等.高强度超声处理对大豆7S和11S球蛋白结构和理化性质的影响[J].食品工业科技, 2022,43(5):87-97.
TIAN R, FENG J R, SUI X N, et al.Effect of high intensity ultrasound on the conformational and physicochemical properties of soy 7S and 11S globulin[J].Science and Technology of Food Industry,2022,43(5):87-97.
[38] KANG Z L, BAI R, LU F, et al.Effects of high pressure homogenization on the solubility, foaming, and gel properties of soy 11S globulin[J].Food Hydrocolloids, 2022, 124:107261.
[39] 解长远, 王中江, 郭增旺, 等.射流空化对大豆11S球蛋白结构和功能特性的影响[J].食品科学, 2020, 41(9):57-65.
XIE C Y, WANG Z J, GUO Z W, et al.Effect of jet cavitation on the structure and functional properties of soybean 11S globulin[J].Food Science, 2020, 41(9):57-65.
[40] GUO J, YANG X Q, GU W, et al.Inhibition of glycinin thermal aggregation by an artificial chaperone sodium dodecyl sulphate[J].International Journal of Food Science & Technology, 2012, 47(4):665-673.
[41] WAN Z L, WANG L Y, WANG J M, et al.Synergistic foaming and surface properties of a weakly interacting mixture of soy glycinin and biosurfactant stevioside[J].Journal of Agricultural and Food Chemistry, 2014, 62(28):6 834-6 843.
[42] ZHU L J, XU Q Y, LIU X Y, et al.Oil-water interfacial behavior of soy β-conglycinin-soyasaponin mixtures and their effect on emulsion stability[J].Food Hydrocolloids, 2020, 101:105531.
[43] ZHU L J, XU Q Y, LIU X Y, et al.Soy glycinin-soyasaponin mixtures at oil-water interface:Interfacial behavior and O/W emulsion stability[J].Food Chemistry, 2020, 327:127062.
[44] ZHU L J, YIN P, XIE T Y, et al.Interaction between soyasaponin and soy β-conglycinin or glycinin:Air-water interfacial behavior and foaming property of their mixtures[J].Colloids and Surfaces B:Biointerfaces, 2020, 186:110707.
[45] YUAN Y, WAN Z L, YIN S W, et al.Formation and dynamic interfacial adsorption of glycinin/chitosan soluble complex at acidic pH:Relationship to mixed emulsion stability[J].Food Hydrocolloids, 2013, 31(1):85-93.
[46] XIANG N, LYU Y, NARSIMHAN G.Characterization of fish oil in water emulsion produced by layer by layer deposition of soy β-conglycinin and high methoxyl pectin[J].Food Hydrocolloids, 2016, 52:678-689.
[47] NICOLETTI TELIS V R.O/W emulsions stabilized by interactions between proteins and polysaccharides[M]//Encyclopedia of Food Chemistry.Amsterdam:Elsevier, 2019:494-498.
[48] KAN X H, CHEN G J, ZHOU W T, et al.Application of protein-polysaccharide Maillard conjugates as emulsifiers:Source, preparation and functional properties[J].Food Research International, 2021, 150:110740.
[49] 艾正文, 于鹏, 桂敏.糖基化反应对乳清蛋白功能特性影响的研究进展[J].食品科技, 2020, 45(10):248-252.
AI Z W, YU P, GUI M.Research progress on the effect of glycosylation on the functional properties of whey protein[J].Food Science and Technology, 2020, 45(10):248-252.
[50] 张波, 迟玉杰.β-伴大豆球蛋白糖基化改性对其乳化性影响的研究[J].食品工业科技, 2012, 33(23):85-89.
ZHANG B, CHI Y J.The effect of β-conglycinin glycosylation with xanthan gum on emulsifying properties[J].Science and Technology of Food Industry, 2012, 33(23):85-89.
[51] ZHANG J B, WU N N, YANG X Q, et al.Improvement of emulsifying properties of Maillard reaction products from β-conglycinin and dextran using controlled enzymatic hydrolysis[J].Food Hydrocolloids, 2012, 28(2):301-312.
[52] 田燕. 环境条件及糖基化对大豆7S蛋白油水界面性质影响及乳化机理研究[D].武汉:华中农业大学, 2021.
TIAN Y.The effects of environmental factors and glycation on the oil/water interfacial properties of 7S and investigations of emulsification mechanisim[D].Wuhan:Huazhong Agricultural University, 2021.
[53] 李冰, 迟玉杰, 鲍志杰, 等.大豆11S球蛋白-麦芽糖共价改性及其凝胶流变特性[J].食品与发酵工业, 2013, 39(7):39-43.
LI B, CHI Y J, BAO Z J, et al.The optimization of glycinin covalent modification technology and rheological properties of glycinin-maltose Maillard products[J].Food and Fermentation Industries, 2013, 39(7):39-43.
[54] 章鼎敏, 刘贵梅, 卢永翎, 等.大豆11S球蛋白糖基化有害交联产物的形成及抑制机理[J].食品科学, 2018, 39(7):7-13.
ZHANG D M, LIU G M, LU Y L, et al.Formation and inhibition mechanism of harmful cross-linked products generated from glycosylation of 11S globulin[J].Food Science, 2018, 39(7):7-13.
[55] PENG X Q, XU Y T, LIU T X, et al.Molecular mechanism for improving emulsification efficiency of soy glycinin by glycation with soy soluble polysaccharide[J].Journal of Agricultural and Food Chemistry, 2018, 66(46):12 316-12 326.
[56] JIANG J, WANG Q L, XIONG Y L.A pH shift approach to the improvement of interfacial properties of plant seed proteins[J].Current Opinion in Food Science, 2018, 19:50-56.
[57] 杨昱, 雷泽夏, 白靖文, 等.极端pH处理对大豆分离蛋白、β-伴大豆球蛋白、大豆球蛋白结构和功能特性的影响[J].中国食品学报, 2018, 18(7):306-313.
YANG Y, LEI Z X, BAI J W, et al.Effect of extreme pH treatment on the structure and functional properties of soybean protein, β-conglycinin and glycinin[J].Journal of Chinese Institute of Food Science and Technology, 2018, 18(7):306-313.
[58] TIAN Y, ZHANG Z, ZHANG P P, et al.The role of conformational state of pH-shifted β-conglycinin on the oil/water interfacial properties and emulsifying capacities[J].Food Hydrocolloids, 2020, 108:105990.
[59] 范丽丽, 窦博鑫, 张晓琳, 等.大豆7S球蛋白的MTGase条件对其表面疏水性与功能特性、溶液性质的影响及相关性分析[J].食品工业科技, 2020, 41(5):52-57;62.
FAN L L, DOU B X, ZHANG X L, et al.Effect of MTGase conditions on surface hydrophobicity, functional properties and solution properties of soybean 7S globulin and correlation analysis of its indexes[J].Science and Technology of Food Industry, 2020, 41(5):52-57;62.
[60] 杨春华, 殷希文.11S球蛋白改性前后的结构表征[J].河南工业大学学报(自然科学版), 2016, 37(5):19-25.
YANG C H, YIN X W.Stuctural characterization of 11 s globulin before and after modification[J].Journal of Henan University of Technology (Natural Science Edition), 2016, 37(5):19-25.
[61] 段春红, 韩晓红, 阎贺静, 等.菠萝蛋白酶限制性酶解大豆7S球蛋白产物在猪肉肠中的应用[J].中国油脂, 2012, 37(4):48-51.
DUAN C H, HAN X H, YAN H J, et al.Application in pork sausage of soybean conglycinin hydrolysates obtained by limited proteolysis with Bromelain[J].China Oils and Fats, 2012, 37(4):48-51.
[62] LIU L L, ZENG J H, SUN B Y, et al.Ultrasound-assisted mild heating treatment improves the emulsifying properties of 11S globulins[J].Molecules (Basel, Switzerland), 2020, 25(4):875.
[63] 范丽丽. Na2SO3协同MTGase对大豆7S球蛋白功能特性及结构的影响[D].哈尔滨:哈尔滨商业大学, 2020.
FAN L L.Effects of Na2SO3 and MTGase on functional properties and structure of soybean 7S globulin[D].Harbin:Harbin University of Commerce, 2020.