构建分子内二硫键提升谷氨酰胺转氨酶热稳定性
杜建辉,刘松,陆信曜,陈坚
江南大学生物工程学院系统与生物加工工程研究室陈坚院士团队
谷氨酰胺转氨酶(Transglutaminase,TGase)于1957年在豚鼠肝脏中被发现。在之后的三十年中豚鼠肝脏来源的TGase一直是商业TGase的唯一来源。然而,因其在应用时预处理较复杂,并且由于其预处理时具有红色素沉积的副作用促使人们不断地寻找新的替代品。直到1989年,茂源链霉菌(Streptomyces mobaraensis,S. mobaraensis)的TGase作为第一个在微生物体内发现的TGase开始广泛地应用于不同领域。此后愈来愈多微生物来源TGase被发现、纯化、性质鉴定、异源表达乃至作为酶制剂在食品领域发挥着重要的作用。
较差的热稳定性,是包括TGase在内诸多工业化酶制剂亟待解决的问题。传统改造酶热稳定性的方法包括随机突变、化学修饰等,现如今,更多的人们选择更为高效的理性设计,通过预测蛋白质功能和活性的方法对酶进行预测与改造。本文首先根据野生型S. mobaraensis TGase的晶体结构对一个已报道的高稳定型TGase对变体(MS)进行构象建模。经结构优化后,使用Disulfide by Design 2.0线上服务器对其进行二硫键预测。根据能量分组挑选出12种二硫键突变体。对热稳定性最好的突变体进行热稳定性及催化活性机制解析、动力学分析及结构分析。从软件设计改造突变体至对最佳突变体进行性质鉴定、机制解析、动力学及结构分析,实现了理性设计与实验操作逻辑上的完美融合。
理性设计时,通过I-TASSER线上服务器根据野生型成熟TGase构象(PDB:1iu4)对突变体MS构象建模。在MS构象基础上,通过Rosetta-StructureRelax模块对MS构象进行优化。将获得的最终构象上传至Disulfide by design 2.0线上服务器进行二硫键突变预测。对预测得到的55个突变体根据能量进行分组,在各分组中抽取2个作为实验对象,进行突变后验证。获得最佳突变体MS-P22C-Q328C,热稳定性提升91.06%,酶活下降13.2%。
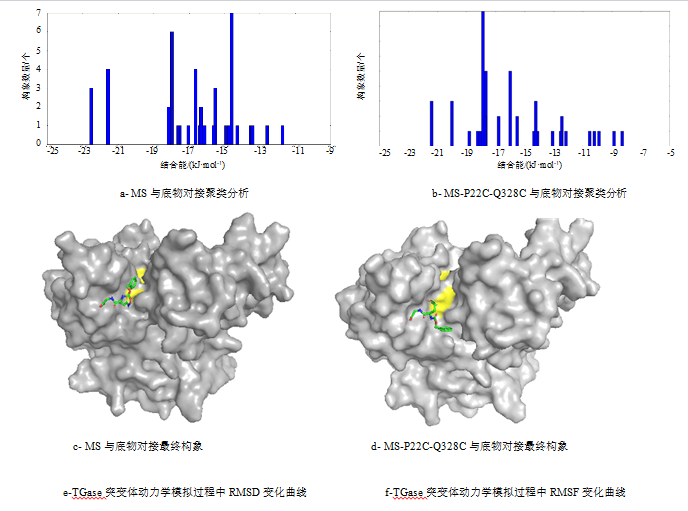
对模拟出的MS和MS-P22C-Q328C结构分析,MS-P22C-Q328C分子中的二硫键位于酶分子长Loop结构上。在突变体MS-P22C-Q328C中,二硫键可能限制了Loop环摆动,从而提高了其热稳定性。此外该Loop结构位于底物进入酶分子的通道,其刚性的增强可能影响了酶与底物结合,导致了MS-P22C-Q328C底物亲和力和活性的下降的下降。以标准底物CBZ-Gln-Gly与MS及变体进行对接时,MS及MS-P22C-Q328C与底物的结合能分别为-17.96 kJ/mol和-17.50 kJ/mol(图ab),前者较后者与底物结合更紧密。
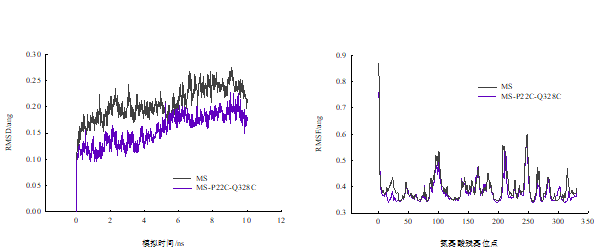
通过分子动力学中的升温动力学分析TGase突变体在体系中运动的情况,基于MS对突变体MS-P22C-Q328C进行建模,对二者同时进行能量最小化处理和热量平衡。经动力学模拟后观察TGase突变体的RMSD变化,发现突变体MS-P22C-Q328C的RMSD整体变化低于MS,说明其在高温状态下刚性更强,不易于变性(图e)。对TGase突变体的各氨基酸位移变化分析,发现突变体MS-P22C-Q328C蛋白中区域15-32及311-330中氨基酸整体位移降低,即RMSF低于MS(图f)。推断突变氨基酸对P22C-Q328C可有效的提高区域的刚性程度,从而提高蛋白整体稳定性。